Dofetilde: un nou antiaritmic clasa III
Volumul III, numărul 4/septembrie / octombrie 2000
Jodie Zalewski, Pharm.D.
revenirea la indicele de actualizare a farmacoterapiei
Introducere
Dofetilida (tikosyn agent antiaritmic utilizat pentru Conversia și menținerea ritmului sinusal normal la pacienții cu fibrilație/flutter atrial foarte simptomatic. Este diferit de alte antiaritmice de clasa III prin faptul că prezintă blocarea selectivă a canalului de potasiu, fără efect asupra sistemului de conducere. Dofetilida prelungește repolarizarea atrială și ventriculară și, prin urmare, crește perioada refractară în mușchiul cardiac. Alți agenți antiaritmici de clasa III posedă proprietăți antiaritmice suplimentare. Sotalol (un ß-blocant) și amiodaronă scăderea AV nodal de conducție. Din acest motiv, împreună cu toxicitatea de organ a amiodaronei (de ex. fibroza pulmonară, disfuncția tiroidiană și hepatică), acești agenți nu sunt potriviți pentru toți pacienții. Mecanismul selectiv al dofetilidei pare a fi mai bun decât alți agenți din clasa sa; cu toate acestea, dofetilida trebuie utilizată în continuare cu precauție datorită efectelor sale adverse.
efecte Adverse
deoarece dofetilida acționează asupra canalului de potasiu și lărgește potențialul de acțiune, apare prelungirea intervalului QT, care este asociat cu torsada vârfurilor. Prelungirea intervalului QT este direct legată de doza și concentrația plasmatică a dofetilidei. Concentrația poate deveni crescută din cauza interacțiunilor medicamentoase sau a funcției renale slabe. Prin urmare, dofetilida este rezervată pentru utilizare numai la pacienții cu simptomatologie ridicată.
FDA a mandatat producătorul de Dofetilidă, Pfizer, să impună linii directoare stricte pentru a asigura utilizarea adecvată și dozarea corectă. Impulsul a fost conștientizarea sporită a potențialului de torsade de vârfuri induse de medicamente (demonstrat prin eliminarea astemizolului, terfenadinei și cisapridei de pe piață). Pentru ca terapia cu dofetilidă să fie inițiată, un pacient trebuie internat într-un spital certificat timp de cel puțin 72 de ore pentru monitorizarea cardiacă. Înainte ca un spital să fie o unitate certificată, un formular care verifică finalizarea programului de educație Pfizer de către membrii personalului trebuie să fie la dosar la companie.
evaluarea pacientului
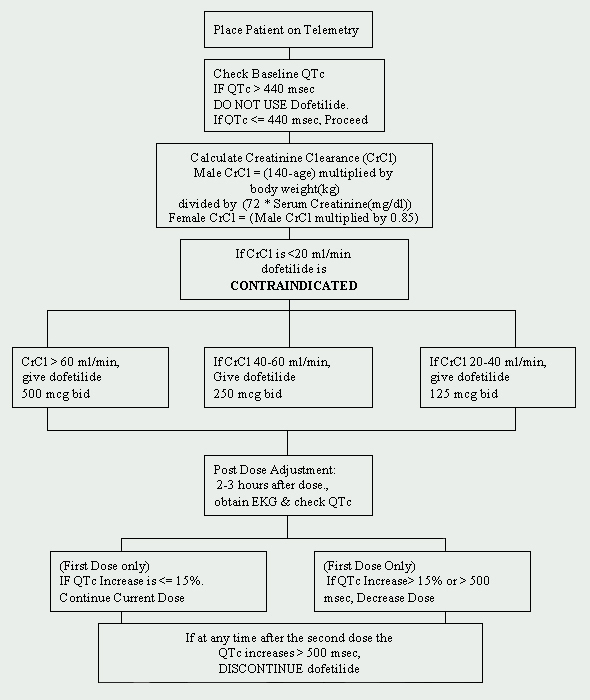
la Cleveland Clinic Foundation, dofetilida este limitată la Departamentul de Cardiologie. A fost implementat un protocol de inițiere a dofetilidei, care este în conformitate cu reglementările impuse de producător (a se vedea Figura 1). Pacienții care urmează să fie inițiați cu dofetilidă trebuie admiși la o unitate de telemetrie aprobată pentru monitorizarea electrocardiografică (EKG). O astfel de monitorizare este necesară pentru a determina prezența prelungirii intervalului QT. Valorile inițiale ale QTc (intervalul QT corectat: QTc = QTMsec / rădăcina pătrată a RR sec) sunt necesare și dacă QTc este mai mare de 440msec (500 Msec la pacienții cu anomalii ale conducerii ventriculare), dofetilida este contraindicată.
o altă evaluare esențială la momentul inițial este funcția renală. Deoarece dofetilida este eliminată pe cale renală, funcția renală slabă (măsurată prin clearance-ul creatininei ) poate duce la acumularea de dofetilidă și, prin urmare, poate crește riscul de aritmii. Doza inițială de dofetilidă este determinată de clearance-ul creatininei (vezi Tabelul 1). Pacienții cu funcție renală normală (CrCl > 60 ml/min) sunt inițiați cu 500 mcg administrate oral de două ori pe zi. Dofetilida este contraindicată la pacienții cu un clearance al creatininei < 20 ml/min.
Tabelul 1: Initial Dofetilide Dose
| Calculated CrCl (ml/min) | Dofetilide Dose |
|---|---|
| >60 | 500 mcg twice daily |
| 40-60 | 250 mcg twice daily |
| 20-39 | 125 mcg twice daily |
| <20 | 125 mcg twice daily |
trebuie obținut, de asemenea, un panou metabolic de bază de bază (BMP). Anomaliile electrolitice trebuie corectate înainte de inițierea dofetilidei, deoarece hipokaliemia și hipomagneziemia pot face pacienții mai susceptibili la aritmii. Dacă potasiul seric (K+) este < 4 mEq/l și/sau Magneziul seric (Mg++) este < 2 mEq/l, atunci deficiențele trebuie completate și verificate din nou înainte de administrarea dofetilidei.
interacțiunile medicamentoase trebuie, de asemenea, abordate înainte de a începe terapia cu dofetilide. Utilizarea concomitentă de verapamil (Călan®, Calan SR®, Covera-HS®, Isoptin®, Isoptin SR®, Verelan®, Verelan PM®), cimetidina (Tagamet®), trimetoprim (Proloprim®, Trimpex®, sau în combinație produse Bactrim®, Septra®), ketoconazol (Nizoral®), proclorperazina (Compazine®) și de megestrol (Megace®) cu dofetilidă este contraindicată. Acești agenți încetinesc eliminarea dofetilidei prin inhibarea sistemului de transport renal, ceea ce duce la o creștere a nivelurilor de dofetilidă. În plus, medicamentele care nu inhibă, dar sunt secretate altfel pe această cale trebuie utilizate cu precauție (de ex., triamteren, metformin, amilorid). Alți agenți care trebuie evitați sunt cei care prelungesc intervalul QT, cum ar fi fenotiazine, cisapridă, bepridil, antidepresive triciclice, eritromicină și clasa I (de exemplu, chinidină, procainamidă, lidocaină, flecainidă) și agenți antiaritmici de clasa III. În cele din urmă, agenții care provoacă hipokaliemie sau hipomagneziemie, cum ar fi diureticele, trebuie, de asemenea, utilizați cu precauție.
dozare, administrare și monitorizare
dacă pacientul este lipsit de toate contraindicațiile, poate fi inițiată administrarea dofetilidei. Un EKG repetat se efectuează la 2 până la 3 ore după prima doză pentru a evalua intervalul QTc. Dacă intervalul QTc a crescut > 15% sau dacă QTc este > 500Msec (550Msec la pacienții cu anomalii de conducere ventriculară), doza de dofetilidă trebuie scăzută. În general, doza este redusă la jumătate (vezi Tabelul 2). Pentru restul perioadei de inițiere de 72 de ore, monitorizarea EKG se efectuează la două până la trei ore după fiecare doză ulterioară de dofetilidă. Nu se recomandă reduceri suplimentare ale dozei în funcție de intervalul QTc. Dacă în orice moment după a doua doză QTc devine > 500Msec (550 Msec la pacienții cu anomalii de conducere ventriculară), dofetilida trebuie întreruptă. Monitorizarea cardiacă continuă prin telemetrie este continuată timp de cel puțin 72 de ore sau 12 ore după conversia electrică sau farmacologică la ritmul sinusal normal, oricare dintre acestea este mai mare.
Tabelul 2: Tabel de ajustare a prelungirii intervalului QT
| doza inițială bazată pe CrCl | doza ajustată (pentru prelungirea intervalului QT) |
|---|---|
| 500 mcg de două ori pe zi | 250 mcg de două ori pe zi |
| 250 mcg de două ori pe zi | 125 mcg de două ori pe zi zilnic |
| 125 mcg de două ori pe zi | 125 mcg o dată pe zi |
Pfizer, în colaborare cu FDA, a luat un alt pas pentru a asigura utilizarea corectă a dofetilidei. O singură farmacie (comandă prin poștă) din Statele Unite, Statlanders Pharmacy din Pennsylvania, distribuie dofetilide. Un formular de înscriere a serviciilor de farmacie trebuie completat și trimis prin fax către Statlanders înainte de externarea pacientului pentru a preveni întreruperea terapiei. La externare, pacienții primesc o cantitate de medicament de o săptămână. Această ofertă oferă pacientului suficiente medicamente până la livrarea prescripției de comandă prin poștă.
concluzie
deși dofetilida este un agent antiaritmic eficient pentru fibrilația / flutterul atrial simptomatic, aceasta trebuie inițiată cu precauție. Respectarea strictă a liniilor directoare impuse de FDA este necesară pentru a asigura siguranța pacientului.