Dofetilde: Un Nuevo Antiarrítmico de Clase III
Volumen III, Número 4 / Septiembre / Octubre de 2000
Jodie Zalewski, Pharm.D.
Volver a la Farmacoterapia Índice de Actualización
Introducción
Dofetilida (Tikosyn®) es una nueva clase III agente antiarrítmico utilizado para la conversión y el mantenimiento del ritmo sinusal en pacientes con muy sintomático de la fibrilación auricular/flutter. Se diferencia de otros antiarrítmicos de clase III en que presenta un bloqueo selectivo del canal de potasio, sin efecto sobre el sistema de conducción. La dofetilida prolonga la repolarización auricular y ventricular, y por lo tanto aumenta el período refractario dentro del músculo cardíaco. Otros agentes antiarrítmicos de clase III poseen propiedades antiarrítmicas adicionales. El sotalol (un ß-bloqueador) y la amiodarona disminuyen la conducción ganglionar AV. Por esta razón, junto con las toxicidades de los órganos de la amiodarona (p. ej. fibrosis pulmonar, disfunción tiroidea y hepática), estos agentes no son adecuados para todos los pacientes. El mecanismo selectivo de la dofetilida parece ser mejor que otros agentes de su clase; sin embargo, la dofetilida debe utilizarse con precaución debido a sus efectos adversos.
Efectos adversos
Debido a que la dofetilida actúa sobre el canal de potasio y amplía el potencial de acción, se produce una prolongación del intervalo QT, que se asocia con torsades de pointes. La prolongación del intervalo QT está directamente relacionada con la dosis y la concentración plasmática de dofetilida. La concentración puede elevarse debido a interacciones medicamentosas o a una función renal deficiente. Por lo tanto, la dofetilida está reservada para su uso únicamente en pacientes muy sintomáticos.
La FDA ha ordenado al fabricante de dofetilida, Pfizer, que imponga pautas estrictas para asegurar el uso apropiado y la dosificación correcta. El impulso fue la mayor conciencia del potencial de torsades de pointes inducidas por medicamentos (demostrado por la eliminación del mercado de astemizol, terfenadina y cisaprida). Para que se inicie la terapia con dofetilida, el paciente debe ser ingresado en un hospital certificado durante al menos 72 horas para la monitorización cardíaca. Antes de que un hospital sea un centro certificado, debe estar en los archivos de la compañía un formulario que verifique la finalización del programa educativo de Pfizer por parte de los miembros del personal.
Evaluación del paciente
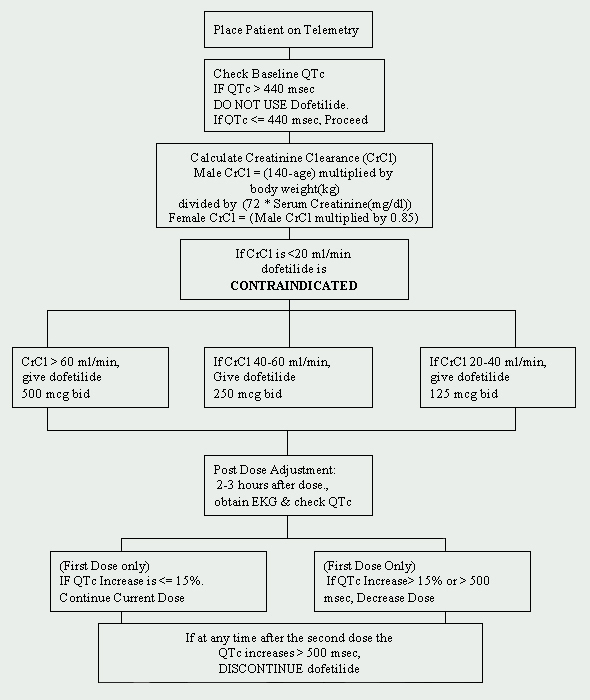
En la Cleveland Clinic Foundation, la dofetilida está restringida al Departamento de Cardiología. Se ha implementado un protocolo para el inicio de la dofetilida que cumple con las regulaciones impuestas por el fabricante (Ver Figura 1). Los pacientes que se inicien con dofetilida deben ser admitidos en una unidad de telemetría aprobada para monitorización electrocardiográfica (ECG). Este control es necesario para determinar la presencia de prolongación del intervalo QT. Se requieren mediciones basales del QTc (intervalo QT corregido: QTc = QTMseg / raíz cuadrada de RR sec) y si el QTc es mayor de 440 Mseg (500 Mseg en pacientes con anomalías de la conducción ventricular), la dofetilida está contraindicada.
Otra evaluación basal crucial es la función renal. Debido a que la dofetilida se elimina por vía renal, una función renal deficiente (medida por el aclaramiento de creatinina ) puede conducir a la acumulación de dofetilida y, por lo tanto, aumentar el riesgo de arritmias. La dosis inicial de dofetilida está determinada por el aclaramiento de creatinina (Ver Tabla 1). Los pacientes con función renal normal (CrCl > 60 ml/min) se inician con 500 mcg administrados por vía oral dos veces al día. La dofetilida está contraindicada en pacientes con un aclaramiento de creatinina < 20 ml/min.
Cuadro 1: Initial Dofetilide Dose
| Calculated CrCl (ml/min) | Dofetilide Dose |
|---|---|
| >60 | 500 mcg twice daily |
| 40-60 | 250 mcg twice daily |
| 20-39 | 125 mcg twice daily |
| <20 | 125 mcg twice daily |
También se debe obtener un panel metabólico básico (BMP) basal. Las anomalías electrolíticas deben corregirse antes de iniciar el tratamiento con dofetilida, ya que la hipopotasemia y la hipomagnesemia pueden hacer que los pacientes sean más susceptibles a las arritmias. Si el potasio sérico (K+) es < 4 mEq/L y/o el magnesio sérico (Mg++) es < 2 mEq/L, las deficiencias deben repetirse y comprobarse de nuevo antes de administrar dofetilida.
Las interacciones medicamentosas también deben abordarse antes de comenzar el tratamiento con dofetilida. El uso concomitante de verapamilo (Calan®, Calan SR®, Copera-HS®, Isoptin®, Isoptin SR®, Verelan®, Verelan PM®), cimetidina (Tagamet®), trimetoprim (Proloprim®, Trimpex® o en productos combinados Bactrim®, Septra®), ketoconazol (Nizoral®), proclorperazina (Compazine®) y megestrol (Megace®) con dofetilida está contraindicado. Estos agentes ralentizan la eliminación de la dofetilida al inhibir el sistema de transporte renal, lo que conduce a un aumento de los niveles de dofetilida. Además, los medicamentos que no inhiben, pero que de otro modo se secretan a través de esta vía, deben usarse con precaución (p. ej., triamtereno, metformina, amilorida). Otros agentes que se deben evitar son los que prolongan el intervalo QT, como fenotiazinas, cisaprida, bepridil, antidepresivos tricíclicos, eritromicina y agentes antiarrítmicos de clase I (por ejemplo, quinidina, procainamida, lidocaína, flecainida) y de clase III. Por último, los agentes que causan hipopotasemia o hipomagnesemia, como los diuréticos, también deben usarse con precaución.
Dosificación, Administración y Monitorización
Si el paciente no presenta ninguna contraindicación, se puede iniciar el tratamiento con dofetilida. Se realiza un ECG repetido de 2 a 3 horas después de la primera dosis para evaluar el intervalo QTc. Si el intervalo QTc ha aumentado > 15% o si el intervalo QTc es > 500Mseg (550Mseg en pacientes con anomalías de la conducción ventricular), se debe disminuir la dosis de dofetilida. En general, la dosis se reduce a la mitad (Ver Tabla 2). Durante el resto del período de inicio de 72 horas, la monitorización por electrocardiograma se realiza de dos a tres horas después de cada dosis posterior de dofetilida. No se recomiendan reducciones adicionales de dosis en función del intervalo QTc. Si en cualquier momento después de la segunda dosis el intervalo QTc se convierte en > 500 Mseg (550 Mseg en pacientes con anomalías de la conducción ventricular), se debe interrumpir el tratamiento con dofetilida. La monitorización cardíaca continua por telemetría se continúa durante un mínimo de 72 horas, o 12 horas después de la conversión eléctrica o farmacológica a ritmo sinusal normal, lo que sea mayor.
Cuadro 2: Tabla de Ajuste de la Prolongación del intervalo QT
| Dosis inicial Basada en el CrCl | Dosis Ajustada (para prolongación del intervalo QT) |
|---|---|
| 500 mcg dos veces al día | 250 mcg dos veces al día |
| 250 mcg dos veces al día | 125 mcg dos veces al día |
| 125 mcg dos veces al día | 125 mcg una vez al día |
Pfizer, junto con la FDA, ha tomado otro paso para asegurar el uso adecuado de dofetilida. Solo una farmacia (por correo) en los Estados Unidos, Statlanders Pharmacy en Pensilvania, dispensa dofetilida. Se debe completar un formulario de Inscripción de Servicios de Farmacia y enviarlo por fax a los residentes de los Estados Unidos antes del alta del paciente para evitar la interrupción de la terapia. Al ser dados de alta, los pacientes reciben un suministro de medicamento para una semana. Este suministro proporciona al paciente suficiente medicamento hasta que se entregue su receta por correo.
Conclusión
Aunque la dofetilida es un agente antiarrítmico eficaz para la fibrilación/aleteo auricular sintomático, debe iniciarse con precaución. Para garantizar la seguridad del paciente, es necesario cumplir estrictamente con las directrices establecidas por la FDA.