Dofetilde: Una nuova Classe III antiaritmico
Volume III, Numero 4 / settembre / ottobre 2000
Jodie Zalewski, Pharm.D.
Ritornare alla terapia farmacologica Aggiornamento Indice
Introduzione
Dofetilide (Tikosyn®) è un nuovo agente antiaritmico di classe III utilizzati per la conversione e mantenimento del normale ritmo sinusale in pazienti con altamente sintomatico fibrillazione atriale/flutter. È diverso da altri antiaritmici di classe III in quanto presenta un blocco selettivo del canale del potassio, senza alcun effetto sul sistema di conduzione. La dofetilide prolunga sia la ripolarizzazione atriale che ventricolare e quindi aumenta il periodo refrattario all’interno del muscolo cardiaco. Altri agenti antiaritmici di classe III possiedono proprietà antiaritmiche aggiuntive. Sotalolo (un ß-bloccante) e amiodarone riducono la conduzione nodale AV. Per questo motivo, accoppiato con le tossicità dell’organo di amiodarone (ad es. fibrosi polmonare, tiroide e disfunzione epatica), questi agenti non sono adatti a tutti i pazienti. Il meccanismo selettivo di dofetilide sembra essere migliore di altri agenti nella sua classe; tuttavia, dofetilide deve ancora essere usato con cautela a causa dei suoi effetti avversi.
Effetti avversi
Poiché la dofetilide agisce sul canale del potassio e allarga il potenziale d’azione, si verifica un prolungamento dell’intervallo QT, che è associato a torsioni di punta. Il prolungamento dell’intervallo QT è direttamente correlato alla dose e alla concentrazione plasmatica di dofetilide. La concentrazione può diventare elevata a causa di interazioni farmacologiche o scarsa funzionalità renale. Pertanto, dofetilide è riservato per l’uso solo in pazienti altamente sintomatici.
La FDA ha incaricato il produttore di dofetilide, Pfizer, di imporre linee guida rigorose per assicurare un uso appropriato e un dosaggio corretto. L’impulso è stato l’accresciuta consapevolezza del potenziale di torsades de pointes indotte da farmaci (dimostrato dalla rimozione di astemizolo, terfenadina e cisapride dal mercato). Affinché la terapia con dofetilide possa essere iniziata, un paziente deve essere ricoverato in un ospedale certificato per almeno 72 ore per il monitoraggio cardiaco. Prima che un ospedale sia una struttura certificata, un modulo che verifica il completamento del programma educativo di Pfizer da parte dei membri del personale deve essere in archivio con l’azienda.
Valutazione del paziente
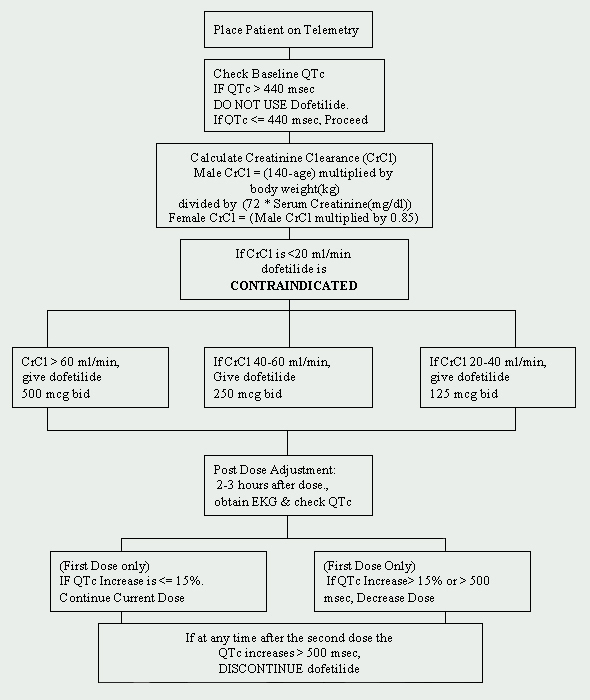
Presso la Cleveland Clinic Foundation, dofetilide è limitato al Dipartimento di Cardiologia. È stato implementato un protocollo per l’avvio del dofetilide ed è conforme alle normative imposte dal produttore (vedi Figura 1). I pazienti che devono iniziare il trattamento con dofetilide devono essere ricoverati in un’unità di telemetria approvata per il monitoraggio elettrocardiografico (ECG). Tale monitoraggio è necessario per determinare la presenza di prolungamento del QT. Sono necessarie misurazioni del QTc al basale (intervallo QT corretto: QTc = QTMsec / radice quadrata di RR sec ) e se il QTc è superiore a 440Msec (500 Msec in pazienti con anomalie della conduzione ventricolare), la dofetilide è controindicata.
Un’altra valutazione fondamentale al basale è la funzionalità renale. Poiché la dofetilide viene eliminata per via renale, una scarsa funzionalità renale (misurata dalla clearance della creatinina) può portare all’accumulo di dofetilide e quindi aumentare il rischio di aritmie. La dose iniziale di dofetilide è determinata dalla clearance della creatinina (Vedere Tabella 1). I pazienti con funzionalità renale normale (CrCl > 60 ml/min) sono iniziati con 500 mcg somministrati per via orale due volte al giorno. Dofetilide è controindicato nei pazienti con clearance della creatinina < 20 ml / min.
Tabella 1: Initial Dofetilide Dose
| Calculated CrCl (ml/min) | Dofetilide Dose |
|---|---|
| >60 | 500 mcg twice daily |
| 40-60 | 250 mcg twice daily |
| 20-39 | 125 mcg twice daily |
| <20 | 125 mcg twice daily |
Si deve anche ottenere un pannello metabolico di base (BMP) di base. Le anomalie elettrolitiche devono essere corrette prima di iniziare la dofetilide perché l’ipopotassiemia e l’ipomagnesiemia possono rendere i pazienti più suscettibili alle aritmie. Se il potassio sierico (K+) è < 4 mEq/L e/o il magnesio sierico (Mg++) è < 2 mEq/L, prima di somministrare dofetilide è necessario ripianare e ricontrollare le carenze.
Anche le interazioni farmacologiche devono essere affrontate prima di iniziare la terapia con dofetilide. L’uso concomitante di verapamil (Calan®, Calan SR®, Covera-HS®, Isoptin®, Isoptin SR®, Cialis®, Verelan PM®), cimetidina (Tagamet®), il trimetoprim (Proloprim®, Trimpex®, o nei prodotti di combinazione Bactrim®, Septra®), ketoconazolo (Nizoral®), proclorperazina (Compazine®) e il megestrolo (Megace®) con dofetilide è controindicato. Questi agenti rallentano l’eliminazione della dofetilide inibendo il sistema di trasporto renale, che porta ad un aumento dei livelli di dofetilide. Inoltre, i farmaci che non inibiscono, ma sono altrimenti secreti attraverso questa via devono essere usati con cautela (ad es., triamterene, metformina, amiloride). Altri agenti che dovrebbero essere evitati sono quelli che prolungano l’intervallo QT, come fenotiazine, cisapride, bepridil, antidepressivi triciclici, eritromicina e classe I (ad esempio, chinidina, procainamide, lidocaina, flecainide) e agenti antiaritmici di classe III. Infine, gli agenti che causano ipopotassiemia o ipomagnesiemia, come i diuretici, devono essere usati con cautela.
Dosaggio, somministrazione e monitoraggio
Se il paziente è privo di tutte le controindicazioni, la dofetilide può essere iniziata. Un ECG ripetuto viene eseguito 2-3 ore dopo la prima dose per valutare l’intervallo QTc. Se l’intervallo QTc è aumentato > del 15% o se il QTc è > 500 Msec (550 Msec in pazienti con anomalie della conduzione ventricolare), la dose di dofetilide deve essere ridotta. In generale, la dose è dimezzata (Vedere Tabella 2). Per il resto del periodo di inizio di 72 ore, il monitoraggio dell’ECG viene eseguito a due o tre ore dopo ogni dose successiva di dofetilide. Non sono raccomandate ulteriori riduzioni della dose in base all ‘ intervallo QTc. Se in qualsiasi momento dopo la seconda dose il QTc diventa > 500Msec (550 Msec in pazienti con anomalie della conduzione ventricolare), la dofetilide deve essere interrotta. Il monitoraggio cardiaco continuo mediante telemetria è continuato per un minimo di 72 ore, o 12 ore dopo la conversione elettrica o farmacologica al ritmo sinusale normale, a seconda di quale sia maggiore.
Tabella 2: Prolungamento dell’intervallo QT Tabella di Regolazione
| Dose Iniziale Basato su CrCl | Regolato Dose (per Prolungamento dell’intervallo QT) |
|---|---|
| 500 mcg due volte al giorno | 250 mcg due volte al giorno |
| 250 mcg due volte al giorno | 125 mcg due volte al giorno |
| 125 mcg due volte al giorno | 125 mcg una volta al giorno |
Pfizer, in collaborazione con la FDA, ha preso un altro passo per assicurare l’uso corretto di dofetilide. Solo una farmacia (per corrispondenza) negli Stati Uniti, Statlanders Farmacia in Pennsylvania, eroga dofetilide. Un modulo di iscrizione ai servizi di farmacia deve essere compilato e inviato via fax a Statlanders prima della dimissione del paziente per prevenire l’interruzione della terapia. Al momento della dimissione, i pazienti ricevono una fornitura di una settimana di farmaco. Questa fornitura dà al paziente abbastanza farmaci fino a quando non viene consegnata la prescrizione per corrispondenza.
Conclusione
Sebbene la dofetilide sia un efficace agente antiaritmico per la fibrillazione atriale sintomatica / flutter, deve essere iniziata con cautela. Per garantire la sicurezza del paziente è necessario rispettare rigorosamente le linee guida prescritte dalla FDA.