Dofétilde: Un Nouvel Antiarythmique de Classe III
Volume III, Numéro 4 | Septembre / Octobre 2000
Jodie Zalewski, Pharm.D.
Retour à l’index de mise à jour de la pharmacothérapie
Introduction
Le Dofétilide (Tikosyn®) est une nouvelle classe III agent antiarythmique utilisé pour la conversion et le maintien du rythme sinusal normal chez les patients présentant une fibrillation / flutter auriculaire hautement symptomatique. Il est différent des autres antiarythmiques de classe III en ce qu’il présente un blocage sélectif des canaux potassiques, sans effet sur le système de conduction. Le Dofétilide prolonge la repolarisation auriculaire et ventriculaire et augmente donc la période réfractaire dans le muscle cardiaque. D’autres agents antiarythmiques de classe III possèdent des propriétés antiarythmiques supplémentaires. Le sotalol (un ß-bloquant) et l’amiodarone diminuent la conduction nodale AV. Pour cette raison, associée aux toxicités organiques de l’amiodarone (p. ex. fibrose pulmonaire, dysfonction thyroïdienne et hépatique), ces agents ne conviennent pas à tous les patients. Le mécanisme sélectif du dofétilide semble être meilleur que les autres agents de sa classe; cependant, le dofétilide doit toujours être utilisé avec prudence en raison de ses effets indésirables.
Effets indésirables
Comme le dofétilide agit sur le canal potassique et élargit le potentiel d’action, il se produit un allongement de l’intervalle QT, associé aux torsades de pointes. L’allongement de l’intervalle QT est directement lié à la dose et à la concentration plasmatique de dofétilide. La concentration peut devenir élevée en raison d’interactions médicamenteuses ou d’une mauvaise fonction rénale. Par conséquent, le dofétilide est réservé à une utilisation uniquement chez les patients hautement symptomatiques.
La FDA a mandaté le fabricant du dofétilide, Pfizer, d’imposer des directives strictes pour assurer une utilisation appropriée et un dosage correct. L’impulsion a été la prise de conscience accrue du potentiel de torsades de pointes d’origine médicamenteuse (démontrée par l’élimination de l’astémizole, de la terfénadine et du cisapride du marché). Pour que le traitement par dofétilide soit initié, un patient doit être admis dans un hôpital certifié pendant au moins 72 heures pour une surveillance cardiaque. Avant qu’un hôpital soit un établissement certifié, un formulaire confirmant l’achèvement du programme de formation de Pfizer par les membres du personnel doit être versé au dossier de l’entreprise.
Évaluation des patients
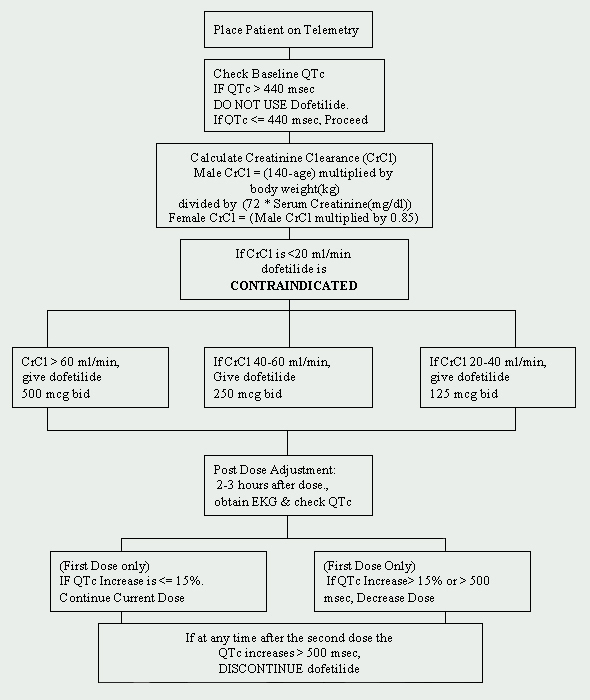
À la Cleveland Clinic Foundation, le dofétilide est limité au département de cardiologie. Un protocole d’initiation du dofétilide a été mis en œuvre et est conforme aux réglementations imposées par le fabricant (voir Figure 1). Les patients devant commencer à prendre du dofétilide doivent être admis dans une unité de télémétrie agréée pour un suivi électrocardiographique (ECG). Une telle surveillance est nécessaire pour déterminer la présence d’un allongement de l’intervalle QT. Des mesures du QTc de base (intervalle QT corrigé: QTc = QTMsec / racine carrée de RR sec) sont nécessaires et si le QTc est supérieur à 440 Msec (500 Msec chez les patients présentant des anomalies de la conduction ventriculaire), le dofétilide est contre-indiqué.
Une autre évaluation de base cruciale est la fonction rénale. Étant donné que le dofétilide est éliminé par voie rénale, une mauvaise fonction rénale (mesurée par la clairance de la créatinine) peut entraîner une accumulation de dofétilide et, par conséquent, augmenter le risque d’arythmie. La dose initiale de dofétilide est déterminée par la clairance de la créatinine (Voir Tableau 1). Les patients ayant une fonction rénale normale (CrCl > 60 ml / min) sont initiés à 500 mcg administrés par voie orale deux fois par jour. Le dofétilide est contre-indiqué chez les patients présentant une clairance de la créatinine de < 20 ml / min.
Tableau 1: Initial Dofetilide Dose
| Calculated CrCl (ml/min) | Dofetilide Dose |
|---|---|
| >60 | 500 mcg twice daily |
| 40-60 | 250 mcg twice daily |
| 20-39 | 125 mcg twice daily |
| <20 | 125 mcg twice daily |
Un panel métabolique de base de base (BMP) de base doit également être obtenu. Les anomalies électrolytiques doivent être corrigées avant l’initiation du dofétilide car une hypokaliémie et une hypomagnésémie peuvent rendre les patients plus sensibles aux arythmies. Si le potassium sérique (K+) est < 4 mEq /L et / ou le magnésium sérique (Mg++) est < 2 mEq /L, les carences doivent être replétées et revérifiées avant l’administration du dofétilide.
Les interactions médicamenteuses doivent également être abordées avant de commencer le traitement par le dofétilide. L’utilisation concomitante de vérapamil (Calan®, Calan SR®, Covera-HS®, Isoptin®, Isoptin SR®, Verelan®, Verelan PM®), de cimétidine (Tagamet®), de triméthoprime (Proloprim®, Trimpex®, ou en association avec des produits Bactrim®, Septra®), de kétoconazole (Nizoral®), de prochlorpérazine (Compazine®) et de mégestrol (Megace®) avec le dofétilide est contre-indiquée. Ces agents ralentissent l’élimination du dofétilide en inhibant le système de transport rénal, ce qui entraîne une augmentation des taux de dofétilide. De plus, les médicaments qui n’inhibent pas, mais qui sont par ailleurs sécrétés par cette voie, doivent être utilisés avec prudence (p. ex., triamtérène, metformine, amiloride). D’autres agents à éviter sont ceux qui prolongent l’intervalle QT, tels que les phénothiazines, le cisapride, le bépridil, les antidépresseurs tricycliques, l’érythromycine et les agents de classe I (par exemple, quinidine, procaïnamide, lidocaïne, flécaïnide) et les antiarythmiques de classe III. Enfin, les agents qui provoquent une hypokaliémie ou une hypomagnésémie, tels que les diurétiques, doivent également être utilisés avec prudence.
Dosage, administration et surveillance
Si le patient est dépourvu de toutes contre-indications, le dofétilide peut être instauré. Un ECG répété est effectué 2 à 3 heures après la première dose pour évaluer l’intervalle QTc. Si l’intervalle QTc a augmenté > de 15% ou si l’intervalle QTc est > de 500 msec (550 msec chez les patients présentant des anomalies de la conduction ventriculaire), la dose de dofétilide doit être diminuée. En général, la dose est divisée par deux (voir tableau 2). Pour le reste de la période d’initiation de 72 heures, la surveillance par électrocardiogramme est effectuée deux à trois heures après chaque dose ultérieure de dofétilide. Aucune réduction de dose supplémentaire n’est recommandée en fonction de l’intervalle QTc. Si, à tout moment après la deuxième dose, le QTc devient > 500 Msec (550 Msec chez les patients présentant des anomalies de la conduction ventriculaire), le dofétilide doit être arrêté. La surveillance cardiaque continue par télémétrie est poursuivie pendant au moins 72 heures, ou 12 heures après la conversion électrique ou pharmacologique au rythme sinusal normal, selon la valeur la plus élevée.
Tableau 2: Tableau de Réglage de l’Allongement de l’Intervalle QT
| Dose de départ Basée sur CrCl | Dose ajustée (pour l’Allongement de l’Intervalle QT) |
|---|---|
| 500 mcg deux fois par jour | 250 mcg deux fois par jour |
| 250 mcg deux fois par jour | 125 mcg deux fois par jour |
| 125 mcg deux fois par jour | 125 mcg une fois par jour |
Pfizer, en collaboration avec la FDA, a pris une autre étape pour assurer une utilisation correcte du dofétilide. Une seule pharmacie (par correspondance) aux États-Unis, Statlanders Pharmacy en Pennsylvanie, distribue le dofétilide. Un formulaire d’inscription aux services de pharmacie doit être rempli et télécopié à Statlanders avant la sortie du patient pour éviter toute interruption du traitement. À la sortie, les patients reçoivent un approvisionnement en médicament d’une semaine. Cette fourniture donne au patient suffisamment de médicaments jusqu’à ce que sa prescription par correspondance soit livrée.
Conclusion
Bien que le dofétilide soit un agent antiarythmique efficace pour la fibrillation / flutter auriculaire symptomatique, il doit être initié avec prudence. Le respect strict des directives prescrites par la FDA est nécessaire pour assurer la sécurité des patients.