Dofetilde: Ein neues Antiarrhythmikum der Klasse III
Band III, Nummer 4 | September/ Oktober 2000
Jodie Zalewski, Pharm.D.
Zurück zum Pharmakotherapie-Aktualisierungsindex
Einführung
Dofetilid (Tikosyn®) ist ein neues Antiarrhythmikum der Klasse III, das zur Umwandlung und Aufrechterhaltung eines normalen Sinusrhythmus verwendet wird bei Patienten mit hochsymptomatischem Vorhofflimmern/ -flattern. Es unterscheidet sich von anderen Antiarrhythmika der Klasse III dadurch, dass es eine selektive Kaliumkanalblockade ohne Wirkung auf das Leitungssystem aufweist. Dofetilid verlängert sowohl die atriale als auch die ventrikuläre Repolarisation und erhöht daher die Refraktärzeit innerhalb des Herzmuskels. Andere Antiarrhythmika der Klasse III besitzen zusätzliche antiarrhythmische Eigenschaften. Sotalol (ein ß-Blocker) und Amiodaron verringern die AV-Knotenleitung. Aus diesem Grund, gekoppelt mit den Organtoxizitäten von Amiodaron (z.B. b. Lungenfibrose, Schilddrüsen- und Leberfunktionsstörungen) sind diese Mittel nicht für alle Patienten geeignet. Der selektive Mechanismus von dofetilide scheint, als andere Mittel in seiner Klasse besser zu sein; jedoch muss dofetilide noch mit der Verwarnung wegen seiner nachteiligen Wirkungen verwendet werden.
Nebenwirkungen
Da Dofetilid auf den Kaliumkanal wirkt und das Aktionspotential erweitert, kommt es zu einer Verlängerung des QT-Intervalls, die mit Torsades de pointes verbunden ist. Die Verlängerung des QT-Intervalls steht in direktem Zusammenhang mit der Dosis und der Plasmakonzentration von Dofetilid. Die Konzentration kann aufgrund von Wechselwirkungen mit anderen Arzneimitteln oder einer schlechten Nierenfunktion erhöht werden. Daher ist Dofetilid nur für die Anwendung bei hochsymptomatischen Patienten reserviert.Die FDA hat den Hersteller von Dofetilid, Pfizer, beauftragt, strenge Richtlinien zu verhängen, um eine angemessene Verwendung und korrekte Dosierung zu gewährleisten. Der Anstoß war das erhöhte Bewusstsein für das Potenzial für arzneimittelinduzierte Torsades de Pointes (nachgewiesen durch die Entfernung von Astemizol, Terfenadin und Cisaprid vom Markt). Damit die Dofetilid-Therapie eingeleitet werden kann, muss ein Patient zur Herzüberwachung für mindestens 72 Stunden in ein zertifiziertes Krankenhaus eingeliefert werden. Bevor ein Krankenhaus eine zertifizierte Einrichtung ist, muss ein Formular, das den Abschluss des Bildungsprogramms von Pfizer durch Mitarbeiter bestätigt, beim Unternehmen hinterlegt sein.
Patientenbewertung
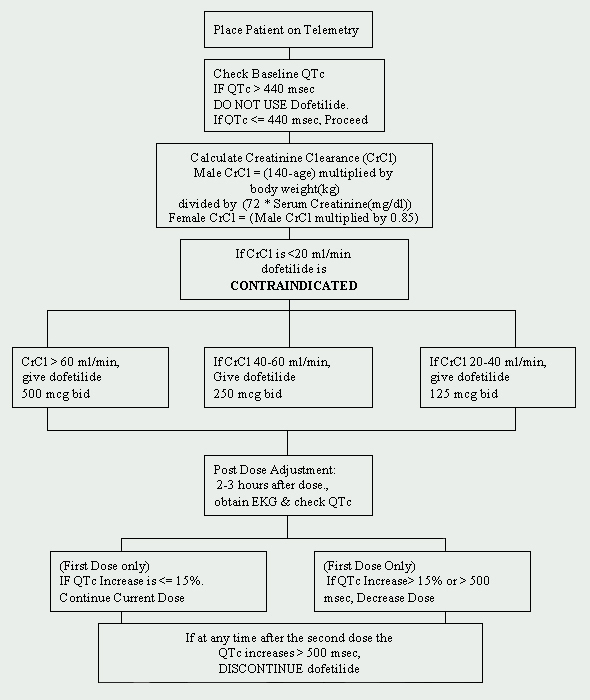
Bei der Cleveland Clinic Foundation ist Dofetilid auf die Abteilung für Kardiologie beschränkt. Ein Protokoll zur Einleitung von Dofetilid wurde implementiert und entspricht den vom Hersteller auferlegten Vorschriften (siehe Abbildung 1). Patienten, die mit Dofetilid begonnen werden sollen, müssen in eine zugelassene Telemetrieeinheit zur elektrokardiographischen (EKG) Überwachung aufgenommen werden. Eine solche Überwachung ist notwendig, um das Vorhandensein einer QT-Verlängerung festzustellen. Baseline-QTc (korrigiertes QT-Intervall: QTc = QTMsec / Quadratwurzel der RR-Sekunde ) Messungen sind erforderlich, und wenn die QTc größer als 440 Msec (500 Msec bei Patienten mit ventrikulären Leitungsstörungen) ist, ist Dofetilid kontraindiziert.
Eine weitere wichtige Baseline-Beurteilung ist die Nierenfunktion. Da Dofetilid renal eliminiert wird, kann eine schlechte Nierenfunktion (gemessen an der Kreatinin-Clearance ) zur Akkumulation von Dofetilid führen und daher das Risiko für Arrhythmien erhöhen. Die Anfangsdosis von Dofetilid wird durch die Kreatinin-Clearance bestimmt (siehe Tabelle 1). Patienten mit normaler Nierenfunktion (CrCl > 60 ml / min) werden mit 500 mcg begonnen, die zweimal täglich oral verabreicht werden. Dofetilid ist bei Patienten mit einer Kreatinin-Clearance von < 20 ml/ min kontraindiziert.
Tabelle 1: Initial Dofetilide Dose
| Calculated CrCl (ml/min) | Dofetilide Dose |
|---|---|
| >60 | 500 mcg twice daily |
| 40-60 | 250 mcg twice daily |
| 20-39 | 125 mcg twice daily |
| <20 | 125 mcg twice daily |
Ein Baseline Basic Metabolic Panel (BMP) sollte ebenfalls erhalten werden. Elektrolytstörungen müssen korrigiert werden, bevor Dofetilid eingeleitet wird, da Hypokaliämie und Hypomagnesiämie Patienten anfälliger für Arrhythmien machen können. Wenn Serumkalium (K +) < 4 mEq/ l und / oder Serummagnesium (Mg ++) < 2 mEq/ l beträgt, müssen die Mängel vor der Verabreichung von Dofetilid aufgefüllt und erneut überprüft werden.
Arzneimittelwechselwirkungen müssen auch vor Beginn der Dofetilid-Therapie behandelt werden. Die gleichzeitige Anwendung von Verapamil (Calan®, Calan SR®, Covera-HS®, Isoptin®, Isoptin SR®, Verelan®, Verelan PM®), Cimetidin (Tagamet®), Trimethoprim (Proloprim®, Trimpex® oder in Kombination Produkte Bactrim®, Septra®), Ketoconazol (Nizoral®), Prochlorperazin (Compazine®) und Megestrol (Megace®) mit Dofetilid sind kontraindiziert. Diese Mittel verlangsamen die Elimination von Dofetilid, indem sie das renale Transportsystem hemmen, was zu einem Anstieg der Dofetilidspiegel führt. Darüber hinaus sollten Arzneimittel, die nicht hemmen, aber ansonsten über diesen Weg ausgeschieden werden, mit Vorsicht angewendet werden (z., triamteren, Metformin, Amilorid). Andere Mittel, die vermieden werden sollten, sind solche, die das QT-Intervall verlängern, wie Phenothiazine, Cisaprid, Bepridil, trizyklische Antidepressiva, Erythromycin und Klasse I (z. B. Chinidin, Procainamid, Lidocain, Flecainid) und Klasse III Antiarrhythmika. Schließlich sollten Mittel, die Hypokaliämie oder Hypomagnesiämie verursachen, wie Diuretika, ebenfalls mit Vorsicht angewendet werden.
Dosierung, Verabreichung und Überwachung
Wenn der Patient keine Kontraindikationen aufweist, kann Dofetilid eingeleitet werden. Ein wiederholtes EKG wird 2 bis 3 Stunden nach der ersten Dosis durchgeführt, um das QTc-Intervall zu bestimmen. Wenn das QTc-Intervall > 15% zugenommen hat oder wenn das QTc > 500 MS beträgt (550 ms bei Patienten mit ventrikulären Leitungsstörungen), muss die Dosis von Dofetilid verringert werden. Im Allgemeinen wird die Dosis halbiert (siehe Tabelle 2). Für den Rest der 72-stündigen Einleitungsphase wird die EKG-Überwachung zwei bis drei Stunden nach jeder nachfolgenden Dosis Dofetilid durchgeführt. Basierend auf dem QTc-Intervall wird keine zusätzliche Dosisreduktion empfohlen. Wenn zu irgendeinem Zeitpunkt nach der zweiten Dosis der QTc > 500 MS (550 Ms bei Patienten mit ventrikulären Leitungsstörungen) beträgt, sollte Dofetilid abgesetzt werden. Die kontinuierliche telemetrische Herzüberwachung wird mindestens 72 Stunden oder 12 Stunden nach der elektrischen oder pharmakologischen Umstellung auf den normalen Sinusrhythmus fortgesetzt, je nachdem, welcher Wert größer ist.
Tabelle 2: Tabelle zur Anpassung der QT-Verlängerung
| Anfangsdosis basierend auf CrCl | Angepasste Dosis (für die QT-Verlängerung) |
|---|---|
| 500 mcg zweimal täglich | 250 mcg zweimal täglich |
| 250 mcg zweimal täglich | 125 mcg zweimal täglich |
| 125 mcg zweimal täglich | 125 mcg einmal täglich |
Pfizer hat in Zusammenarbeit mit der FDA ein weiterer Schritt, um die ordnungsgemäße Verwendung von Dofetilid zu gewährleisten. Nur eine Apotheke (Versandhandel) in den Vereinigten Staaten, Statlanders Apotheke in Pennsylvania, verzichtet Dofetilid. Ein Registrierungsformular für Apothekendienste muss vor der Entlassung des Patienten ausgefüllt und an Statlanders gefaxt werden, um eine Unterbrechung der Therapie zu verhindern. Nach der Entlassung erhalten die Patienten eine einwöchige Medikamentenversorgung. Diese Versorgung gibt dem Patienten genügend Medikamente, bis sein Versandrezept geliefert wird.
Schlussfolgerung
Obwohl Dofetilid ein wirksames Antiarrhythmikum bei symptomatischem Vorhofflimmern / -flattern ist, muss es mit Vorsicht eingeleitet werden. Die strikte Einhaltung der von der FDA vorgeschriebenen Richtlinien ist notwendig, um die Patientensicherheit zu gewährleisten.