Dofetilde: A New Class III Antiarrhythmic
Volume III, Number 4 / September / oktober 2000
Jodie Zalewski, Pharm.D.
Return to Pharmacotherapy Update Index
Introduction
Dofetilide (Tikosyn®) is een nieuwe klasse III antiaritmica gebruikt voor de conversie naar en handhaving van een normaal sinusritme bij patiënten met zeer symptomatisch atriumfibrilleren/flutter. Het verschilt van andere klasse III antiaritmica in die zin dat het selectieve kaliumkanaalblokkade vertoont, zonder effect op het geleidingssysteem. Dofetilide verlengt zowel atriale als ventriculaire repolarisatie, en verhoogt daarom de vuurvaste periode binnen de hartspier. Andere klasse III antiaritmica bezitten aanvullende antiaritmische eigenschappen. Sotalol (een ß-Blokker) en amiodaron verminderen de AV-knoopgeleiding. Om deze reden, in combinatie met de orgaantoxiciteit van amiodaron (bijv. longfibrose, schildklier-en leverdisfunctie), zijn deze middelen niet geschikt voor alle patiënten. Het selectieve mechanisme van dofetilide schijnt beter te zijn dan andere agenten in zijn klasse; nochtans, moet dofetilide nog met voorzichtigheid wegens zijn nadelige gevolgen worden gebruikt.
bijwerkingen
omdat dofetilide inwerkt op het kaliumkanaal en het actiepotentieel verbreedt, treedt verlenging van het QT-interval op, wat geassocieerd is met torsades de pointes. Verlenging van het QT-interval is direct gerelateerd aan de dosis en plasmaconcentratie van dofetilide. De concentratie kan verhoogd worden als gevolg van geneesmiddelinteracties of een slechte nierfunctie. Daarom is dofetilide alleen bestemd voor gebruik bij patiënten die zeer symptomatisch zijn.
de FDA heeft de fabrikant van dofetilide, Pfizer, opdracht gegeven strikte richtlijnen op te leggen om een juist gebruik en een juiste dosering te garanderen. De impuls was de verhoogde bewustwording van het potentieel voor geneesmiddelengeïnduceerde torsades de pointes (aangetoond door de verwijdering van astemizol, terfenadine en cisapride uit de markt). Om de behandeling met dofetilide te starten, moet een patiënt ten minste 72 uur worden opgenomen in een gecertificeerd ziekenhuis voor hartmonitoring. Voordat een ziekenhuis een gecertificeerde faciliteit is, moet een formulier ter bevestiging van de voltooiing van Pfizer ‘ s opleidingsprogramma door medewerkers in het dossier van het bedrijf.
Patiëntbeoordeling
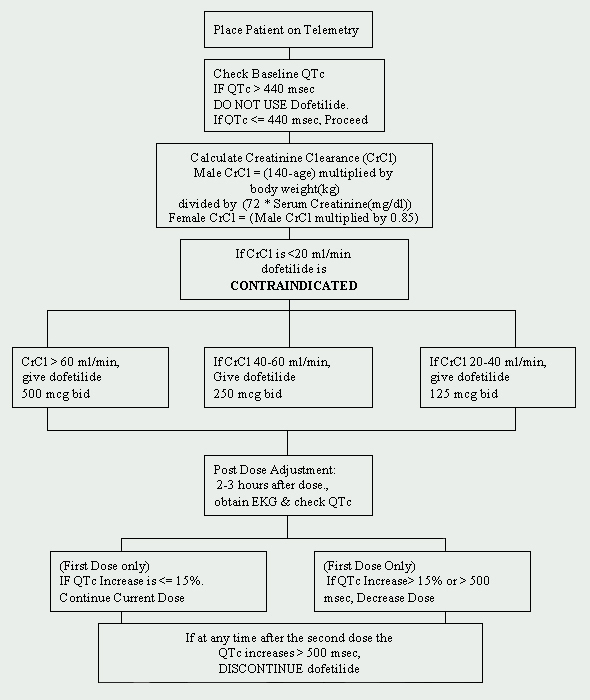
bij de Cleveland Clinic Foundation is dofetilide beperkt tot het departement Cardiologie. Een protocol voor de inleiding van dofetilide is geïmplementeerd en is in overeenstemming met de door de fabrikant opgelegde voorschriften (zie Figuur 1). Patiënten die moeten worden gestart met dofetilide moeten worden toegelaten tot een goedgekeurde telemetrie-eenheid voor elektrocardiografische (EKG) monitoring. Dergelijke controle is noodzakelijk om de aanwezigheid van QT-verlenging te bepalen. Baseline QTc (gecorrigeerd QT-interval: QTc = QTMsec / vierkantswortel van RR sec ) metingen zijn vereist en als de QTc groter is dan 440Msec (500 msec bij patiënten met ventriculaire geleidingsafwijkingen), is dofetilide gecontra-indiceerd.
een andere cruciale uitgangswaarde is de nierfunctie. Omdat dofetilide via de nieren wordt geëlimineerd, kan een slechte nierfunctie (gemeten aan de hand van de creatinineklaring ) leiden tot de accumulatie van dofetilide en daardoor het risico op aritmieën verhogen. De aanvangsdosis van dofetilide wordt bepaald door de creatinineklaring (zie Tabel 1). Patiënten met een normale nierfunctie (CrCl > 60 ml/min) worden gestart met 500 mcg tweemaal daags oraal toegediend. Dofetilide is gecontra-indiceerd bij patiënten met een creatinineklaring van < 20 ml/min.
Tabel 1: Initial Dofetilide Dose
| Calculated CrCl (ml/min) | Dofetilide Dose |
|---|---|
| >60 | 500 mcg twice daily |
| 40-60 | 250 mcg twice daily |
| 20-39 | 125 mcg twice daily |
| <20 | 125 mcg twice daily |
een baseline basic metabolic panel (BMP) moet ook worden verkregen. Elektrolytafwijkingen moeten worden gecorrigeerd voordat met dofetilide wordt begonnen, omdat hypokaliëmie en hypomagnesiëmie patiënten gevoeliger kunnen maken voor aritmieën. Als het serumkalium (K+) < 4 mEq/L is en/of het serummagnesium (Mg++) < 2 mEq/L is, moeten de deficiënties worden aangevuld en opnieuw worden gecontroleerd voordat dofetilide wordt toegediend.
geneesmiddelinteracties moeten ook worden aangepakt voordat met dofetilidetherapie wordt begonnen. Gelijktijdig gebruik van verapamil (Calan®, Calan SR®, Covera-HS®, Isoptin®, Isoptin SR®, Verelan®, Verelan PM®), cimetidine (Tagamet®), trimethoprim (Proloprim®, Trimpex®, of in combinatieproducten Bactrim®, Septra®), ketoconazol (Nizoral®), prochlorperazine (Compazine®) en Megestrol (Megace®) met dofetilide is gecontra-indiceerd. Deze middelen vertragen de eliminatie van dofetilide door het renale transportsysteem te remmen, wat leidt tot een toename van dofetilidespiegels. Bovendien moeten geneesmiddelen die niet remmen, maar anderszins via deze route worden uitgescheiden, met voorzichtigheid worden gebruikt (bijv. triamtereen, metformine, amiloride). Andere middelen die vermeden moeten worden zijn middelen die het QT-interval verlengen, zoals fenothiazinen, cisapride, bepridil, tricyclische antidepressiva, erytromycine en klasse I (bijv. kinidine, procaïnamide, lidocaïne, flecaïnide) en klasse III antiaritmica. Tot slot moeten middelen die hypokaliëmie of hypomagnesiëmie veroorzaken, zoals diuretica, ook met voorzichtigheid worden gebruikt.
dosering, toediening en Monitoring
als de patiënt geen contra-indicaties heeft, kan dofetilide worden gestart. Een herhaald ECG wordt 2 tot 3 uur na de eerste dosis uitgevoerd om het QTc-interval te beoordelen. Als het QTc-interval is toegenomen > 15% of als de QTc > 500Msec (550Msec bij patiënten met ventriculaire geleidingsafwijkingen), moet de dosis dofetilide worden verlaagd. In het algemeen wordt de dosis gehalveerd (zie Tabel 2). Gedurende de rest van de 72 uur durende startperiode wordt de ECG-monitoring twee tot drie uur na elke volgende dosis dofetilide uitgevoerd. Op basis van het QTc-interval worden geen extra dosisverlagingen aanbevolen. Als op enig moment na de tweede dosis de QTc > 500Msec wordt (550 msec bij patiënten met ventriculaire geleidingsafwijkingen), moet de behandeling met dofetilide worden gestaakt. Continue cardiale monitoring met telemetrie wordt voortgezet gedurende minimaal 72 uur, of 12 uur na elektrische of farmacologische conversie naar normaal sinusritme, afhankelijk van wat het grootst is.
Tabel 2: QT-Verlenging, Aanpassing van de Tabel
| startdosering Gebaseerd op CrCl | Aangepaste Dosis (voor QT-Verlenging) |
|---|---|
| 500 mcg tweemaal daags | 250 mcg tweemaal daags |
| 250 mcg tweemaal daags | 125 mcg tweemaal daags |
| 125 mcg tweemaal daags | 125 mcg eenmaal daags |
Pfizer, in combinatie met de FDA, heeft genomen nog een stap om het juiste gebruik van dofetilide te verzekeren. Slechts één apotheek (mail-order)in de Verenigde Staten, Statlanders apotheek in Pennsylvania, geeft dofetilide. Een inschrijfformulier voor apotheekdiensten moet worden ingevuld en gefaxt naar Statlanders voorafgaand aan het ontslag van de patiënt om onderbreking van de therapie te voorkomen. Bij ontslag krijgen patiënten een weeklevering van geneesmiddelen. Deze levering geeft de patiënt genoeg medicatie totdat hun postorderrecept is afgeleverd.
conclusie
hoewel dofetilide een effectief antiaritmicum is voor symptomatisch atriumfibrilleren / flutter, moet het met voorzichtigheid worden gestart. Strikte naleving van de FDA-richtlijnen is noodzakelijk om de veiligheid van de patiënt te waarborgen.