Generieke naam: tuberculine gezuiverd eiwitderivaat
doseringsvorm: injectie, oplossing
medisch beoordeeld door Drugs.com. laatst bijgewerkt op 1 Nov 2020.
- overzicht
- bijwerkingen
- dosering
- Professional
- interacties
- meer
AHFS Categorie: 36:84
Rx only
Diagnostische Antigeen
(helpen bij het opsporen van een infectie met Mycobacterium tuberculosis)
VOOR INTRADERMALE GEBRUIK
Polysorbaat 80 Gestabiliseerd Oplossing van Gezuiverde Tuberculine Eiwit Afgeleide voor de Tuberculine Test bij Mensen
Tubersol Beschrijving
Tubersol® Tuberculine Gezuiverd Eiwit Afgeleide (Mantoux) (PPD) (1) voor intradermale tuberculine test is bereid uit een grote Master Batch Connaught Tuberculine (CT68) (2) en is een cel-gratis gezuiverd eiwit fractie verkregen door een menselijke stam van Mycobacterium tuberculosis gekweekt op een eiwitvrij synthetisch medium en geïnactiveerd. (2) het gebruik van een standaardpreparaat dat is afgeleid van één enkele partij (CT68) is goedgekeurd om variaties tussen partijen door dezelfde fabrikant te elimineren. (2)
Tubersol is een heldere, kleurloze vloeistof.
| Tubersol bevat: | |
| gezuiverd eiwitderivaat van M. tuberculosis | 5 tu per 0.1 mL |
| Polysorbate 80 | 0.0006% |
| Phenol | 0.22% to 0.35% w/v |
| in sterile isotonic phosphate buffered saline. | |
Before release, each successive lot is tested for potency in comparison with the US Standard Tuberculin PPD-S. (3)
onafhankelijke studies uitgevoerd door de US Public Health Service bij de mens hebben de hoeveelheid CT68 in gestabiliseerde oplossing bepaald die nodig is (4) (5) (6) om bio-equivalentie met tuberculine PPD-S (in fosfaatbuffer zonder polysorbaat 80) te produceren met behulp van 5 Amerikaanse eenheden (TU) tuberculine PPD-s als standaard.
Tubersol – Klinische Farmacologie
werkingsmechanisme
de sensibilisatie na infectie met mycobacteriën komt voornamelijk voor in de regionale lymfeklieren. Kleine lymfocyten (T-lymfocyten) prolifereren als reactie op de antigene stimulus om specifiek gesensibiliseerde lymfocyten te veroorzaken. Na 3-8 weken komen deze lymfocyten in de bloedstroom en circuleren ze jarenlang. (7) daaropvolgende restimulatie van deze gesensibiliseerde lymfocyten met hetzelfde of een soortgelijk antigeen, zoals de intradermale injectie van Tubersol, roept een lokale reactie op die door deze cellen wordt gemedieerd. (8)
kenmerkend is dat vertraagde overgevoeligheidsreacties op tuberculine na 5 tot 6 uur beginnen, na 48 tot 72 uur maximaal zijn en over een periode van dagen afnemen. De resulterende immuunrespons bestaat uit induratie als gevolg van celinfiltratie en af en toe vesiculatie en necrose. Klinisch is een vertraagde overgevoeligheidsreactie op tuberculine een manifestatie van een eerdere infectie met M tuberculose of een verscheidenheid aan niet-tuberculose bacteriën. In de meeste gevallen wordt Sensibilisatie geïnduceerd door natuurlijke mycobacteriële infectie of door vaccinatie met BCG vaccin.
indicaties en gebruik voor Tubersol
Tubersol tuberculine Purified Protein derivaat (Mantoux), is geïndiceerd om de diagnose van tuberculose infectie (TB) te ondersteunen bij personen met een verhoogd risico op het ontwikkelen van een actieve ziekte.
de Centers for Disease Control and Prevention (CDC) hebben richtlijnen gepubliceerd met betrekking tot populaties die baat zouden hebben bij tuberculine skin testing (TST). De huidige aanbevelingen zijn te vinden op: http://www.cdc.gov/tb/publications/factsheets/testing.htm.
eerdere BCG-vaccinatie is geen contra-indicatie voor tuberculinetests. De huidtestresultaten van met BCG gevaccineerde personen kunnen worden gebruikt om de diagnose van TB-infectie te ondersteunen of uit te sluiten. Echter, een FDA-goedgekeurde interferon gamma release assay heeft de voorkeur boven tuberculine huidtest voor personen van 5 jaar en ouder die eerder gevaccineerd waren met BCG. (9)
contra-indicaties
allergie voor een bestanddeel van Tubersol of een anafylactische of andere allergische reactie op een eerdere tuberculine-PPD-test is een contra-indicatie voor het gebruik van Tubersol. (Zie beschrijving en hoe geleverd.)
Tubersol mag niet worden toegediend aan:
- personen die een ernstige reactie (bijv. necrose, blaarvorming, anafylactische shock of ulceraties) hebben gehad op een eerdere TST,
- personen met gedocumenteerde actieve tuberculose of een duidelijke voorgeschiedenis van behandeling voor een TB-infectie of-ziekte, (10)
- personen met ernstige brandwonden of eczeem.
waarschuwingen
overgevoeligheid
allergische reacties kunnen optreden na het gebruik van Tubersol, zelfs bij personen zonder voorgeschiedenis van overgevoeligheid voor de productcomponenten. (11) epinefrine injectie (1:1.000) en andere geschikte middelen die worden gebruikt voor de beheersing van onmiddellijke allergische reacties, moeten onmiddellijk beschikbaar zijn.
Syncope
Syncope (flauwvallen) kan optreden in samenhang met de toediening van injecteerbare geneesmiddelen, waaronder Tubersol. Er moeten Procedures worden ingesteld om valletsel te voorkomen en de cerebrale perfusie na syncope te herstellen.
voorzorgsmaatregelen
Algemene
diagnostische beperkingen
vals-positieve of vals-negatieve tuberculine huidtestreacties kunnen bij sommige personen voorkomen. (Zie interpretatie van de Test.)
vals-positieve tuberculinereactietesten komen voor bij personen die zijn geïnfecteerd met andere mycobacteriën, waaronder vaccinatie met BCG.
niet alle geïnfecteerde personen zullen een vertraagde overgevoeligheidsreactie op een tuberculinetest hebben.
van veel factoren is gemeld dat ze een verminderd vermogen veroorzaken om te reageren op de tuberculinetest in aanwezigheid van tuberculeuze infectie. (Zie interpretatie van de Test.)
informatie voor patiënten
voorafgaand aan toediening van Tubersol dient de huidige gezondheidstoestand en medische voorgeschiedenis van de patiënt te worden beoordeeld. De arts moet de immunisatiegeschiedenis van de patiënt controleren op mogelijke gevoeligheid voor componenten van Tubersol.
de zorgverlener moet de patiënt informeren over de noodzaak om terug te keren voor het lezen van de test. Het zelflezen van de test is onnauwkeurig en onbetrouwbaar gebleken.
de zorgverlener dient de patiënt een permanent persoonlijk dossier te verstrekken. Bovendien is het van essentieel belang dat de gezondheidsdeskundige de testgeschiedenis registreert in het permanente medische dossier van elke patiënt. Dit permanente kantoorverslag moet de naam van het product, de gegeven datum, de dosis, de fabrikant en het nummer van de partij bevatten, alsmede het testresultaat in millimeter verharding (in voorkomend geval inclusief 0 mm). De rapportage van resultaten Alleen als negatief of positief is niet bevredigend.
geneesmiddelinteracties
reactiviteit op de test kan worden onderdrukt of onderdrukt bij personen die corticosteroïden of immunosuppressiva krijgen. (8)
reactiviteit op Tubersol kan tijdelijk worden onderdrukt door bepaalde levende virusvaccins (mazelen, bof, rubella, orale polio, gele koorts en varicella). Als onlangs een parenteraal levend verzwakt virusvaccin is toegediend, moet de tuberculinetest worden uitgesteld tot >1 maand na vaccinatie. (8) (12) (Zie interpretatie van de Test.)
wanneer tuberculinescreening tegelijk met een mazelenbevattend vaccin of ander parenteraal levend verzwakt virusvaccin vereist is, verdient gelijktijdige toediening van Tubersol en het vaccin op afzonderlijke plaatsen de voorkeur.
carcinogenese, mutagenese, verminderde vruchtbaarheid
Tubersol is niet onderzocht op het carcinogene of mutagene potentieel of verminderde vruchtbaarheid.
zwangerschap
reproductiestudies bij dieren zijn niet uitgevoerd met Tubersol. Het is ook niet bekend of Tubersol foetale schade kan veroorzaken bij toediening aan een zwangere vrouw of het voortplantingsvermogen kan beïnvloeden. Tubersol mag alleen aan een zwangere vrouw worden gegeven als dit duidelijk noodzakelijk is.
moeders die borstvoeding geven
Het is niet bekend of Tubersol wordt uitgescheiden in de moedermelk. Omdat veel geneesmiddelen in de moedermelk worden uitgescheiden, moet voorzichtigheid worden betracht wanneer Tubersol wordt toegediend aan een zogende vrouw.
gebruik bij kinderen
Er is geen contra-indicatie voor tuberculine huidtesten bij zuigelingen. Zuigelingen <6 maanden oud die besmet zijn met M. tuberculosis mogen niet reageren op Tubersol. (Zie interpretatie van de Test.
geriatrisch gebruik
klinische studies met Tubersol omvatten niet voldoende aantallen personen van 65 jaar en ouder om te bepalen of zij anders reageren dan jongere personen.
bijwerkingen
verharding op de Tubersol-injectieplaats is de verwachte reactie voor een positieve huidtest. (Zie interpretatie van de Test.)
de informatie met betrekking tot bijwerkingen is samengesteld uit historische klinische studies en postmarketingervaring met Tubersol.
Algemene aandoeningen en toedieningsplaatsstoornissen
pijn op de injectieplaats, pruritus op de injectieplaats en ongemak op de injectieplaats. Erytheem op de injectieplaats of huiduitslag op de injectieplaats (zonder verharding) die binnen 12 uur na de test optrad. Deze reacties wijzen niet op een tbc-infectie. Bloeding op de injectieplaats en hematoom op de injectieplaats tot drie dagen na toediening van de test. Blaasjes op de injectieplaats, ulcus op de injectieplaats of necrose op de injectieplaats bij zeer gevoelige personen. Litteken op de injectieplaats als gevolg van sterk positieve reacties. Pyrexie
Immuunsysteemaandoeningen
overgevoeligheid, inclusief anafylaxie/anafylactische reacties, angio-oedeem, urticaria
Ademhalingsstelsel -, borstkas-en mediastinumaandoeningen
Stridor, dyspneu
huid-en onderhuidaandoeningen
Rash, gegeneraliseerde rash
Zenuwstelselaandoeningen
Presyncope, syncope (inclusief syncope geassocieerd met tonisch-clonische bewegingen en andere aanvallen-achtige activiteit) soms resulterend in tijdelijk bewustzijnsverlies met verwonding
melding van bijwerkingen
neem contact op met de farmacovigilantie om vermoedelijke bijwerkingen te melden Afdeling Sanofi Pasteur Inc., Discovery Drive, Swiftwater, PA 18370 of bel 1-800-822-2463 (1-800-vaccin) of Food and Drug Administration (FDA) MEDWATCH programma op 1-800-32-1088 en www.fda.gov/medwatch
Tubersol dosering en toediening
dosering
vijf (5) tuberculine-eenheden (tu) per testdosis van 0,1 mL is de standaardsterkte die wordt gebruikt voor intradermale (Mantoux) tests.
wijze van toediening
Tubersol is uitsluitend geïndiceerd voor intradermale injectie. Injecteer niet intraveneus, intramusculair of subcutaan. Indien subcutane injectie plaatsvindt, kan de test niet worden geïnterpreteerd.
inspecteer voor gebruik op vreemde deeltjes en/of verkleuring. Als deze voorwaarden bestaan, dient u het product niet toe te dienen.
gebruik voor elke injectie een aparte spuit en naald. (13)
de volgende procedure wordt aanbevolen voor het uitvoeren van de Mantoux-test:
- de voorkeursplaats van de test is het volaire aspect van de onderarm. Vermijd gebieden op de huid die rood of gezwollen zijn. Vermijd zichtbare aders.
- Reinig de huid met een geschikt kiemicide en laat de huid drogen voordat het antigeen wordt geïnjecteerd.
- Dien de testdosis (0,1 mL) Tubersol toe met een 1 mL spuit gekalibreerd in tienden en voorzien van een korte, 26 of 27 gauge naald van een kwart tot een halve inch.
- veeg de stop van de injectieflacon schoon met een geschikt kiemicide en laat drogen voordat de naald wordt ingebracht. Steek vervolgens de naald voorzichtig door de stop en zuig 0,1 mL Tubersol op in de spuit. Vermijd het injecteren van overtollige lucht bij het verwijderen van elke dosis, zodat de injectieflacon niet te veel onder druk komt te staan en mogelijk lekkage op de plaats van prikken veroorzaakt.
- steek het punt van de naald in de meest oppervlakkige lagen van de huid met de afschuining van de naald naar boven gericht en dien de dosis toe door middel van een langzame intradermale injectie. Als de intradermale injectie goed wordt uitgevoerd, zal een duidelijke bleke bleb stijgen op de naaldpunt, ongeveer 10 mm (3/8″) in diameter. Deze bleb zal zich binnen enkele minuten verspreiden. Kleed de site niet aan.
- na de injectie kan op de toedieningsplaats een druppel bloed verschijnen. Dep de plaats lichtjes om het bloed te verwijderen, maar vermijd het uitpersen van de geïnjecteerde tuberculinetestvloeistof.
in het geval van een onjuist uitgevoerde injectie (dat wil zeggen, geen bleb gevormd), herhaal de test onmiddellijk op een andere plaats, ten minste 2 inch van de eerste plaats en omcirkel de tweede injectieplaats als indicatie dat dit de te lezen plaats is.
Informeer de patiënt over de noodzaak om terug te keren voor het lezen van de test door een getrainde zorgverlener. Zelflezen kan onnauwkeurig zijn en wordt sterk ontmoedigd.
interpretatie van de Test
de huidtest moet 48 tot 72 uur na toediening van Tubersol door een getrainde gezondheidsdeskundige worden gelezen. De gevoeligheid van de huidtest wordt alleen door verharding aangegeven; roodheid mag niet worden gemeten.
meet de induratiediameter dwars op de lange as van de onderarm en noteer de meting in millimeters (inclusief 0 mm). (8) de punt van een balpen, voorzichtig geduwd onder een hoek van 45° naar de plaats van injectie, zal stoppen bij de rand van verharding.
registreer ook de aanwezigheid en de grootte (indien aanwezig) van necrose en oedeem, hoewel deze niet worden gebruikt bij de interpretatie van de test.
positieve reacties
Tuberculinereactiviteit kan wijzen op latente infectie, eerdere infectie en/of ziekte met M. tuberculose en wijst niet noodzakelijk op de aanwezigheid van actieve tuberculeuze ziekte. Personen die positieve tuberculinereacties vertonen, moeten volgens de huidige richtlijnen voor de volksgezondheid als positief worden beschouwd en worden doorverwezen voor verdere medische beoordeling. (8) (10) het herhaaldelijk testen van niet-geïnfecteerde personen maakt hen niet gevoelig voor Tubersol. (7) (8) (10)
de significantie van induratiemetingen bij het diagnosticeren van latente TB-infectie moet worden overwogen in termen van de voorgeschiedenis van de patiënt en het risico op het ontwikkelen van actieve TB-ziekte, zoals aangegeven in Tabel 1. (10)
| Reactie ≥5 mm van de Verharding | Reactie ≥10 mm van de Verharding | Reactie ≥15 mm van de Verharding |
|---|---|---|
| * Risico van tuberculose bij patiënten die werden behandeld met corticosteroïden neemt toe met een hogere dosering en langere duur. † Voor personen die anders een laag risico lopen en aan het begin van de tewerkstelling worden getest, wordt een reactie van ≥15 mm verharding als positief beschouwd. | ||
| HIV-positieve personen Recente contactpersonen van tuberculose (TB) geval patiënten Fibrotische veranderingen op röntgenfoto van de borst in overeenstemming met voorafgaande TB Patiënten met orgaantransplantatie en andere immuungecompromitteerde patiënten (bijvoorbeeld met het equivalent van ≥15 mg/d van prednison voor 1 maand of meer)* |
Recente immigranten (d.w.z. binnen de laatste 5 jaar) van een hoge prevalentie Injectie drugsgebruikers Bewoners of werknemers† van het volgende hoog-risico samenkomen instellingen: gevangenissen en gevangenissen, verpleegtehuizen en andere langdurige voorzieningen voor ouderen, ziekenhuizen en andere zorginstellingen, residentiële voorzieningen voor patiënten met verworven immunodeficiëntiesyndroom (AIDS) en daklozenopvang Mycobacteriologie laboratoriumpersoneel personen met de volgende klinische aandoeningen die hen in een hoog risico plaatsen: silicose, diabetes mellitus, chronisch nierfalen, sommige hematologische aandoeningen (bijv. leukemieën en lymfomen), andere specifieke maligniteiten (bijv. kinderen jonger dan 4 jaar of zuigelingen , kinderen en adolescenten blootgesteld aan volwassenen met een hoog risico |
personen zonder risicofactoren voor TB |
een TST-conversie wordt gedefinieerd als een toename van ≥10 mm induratie binnen een periode van 2 jaar, ongeacht de leeftijd. (10)
de mogelijkheid moet worden overwogen dat de gevoeligheid van de huidtest ook te wijten kan zijn aan een eerder contact met atypische mycobacteriën of eerdere BCG-vaccinatie. (8) (10)
negatieve reacties
een persoon die bij de eerste test geen positieve reactie op 5 TU vertoont, maar waarvan wordt vermoed dat hij TB-positief is, kan opnieuw worden getest met 5 TU. (Zie Booster-Effect en Tweestappentests.) Elke persoon die geen positieve reactie vertoont op een eerste injectie van 5 TU of een tweede test met 5 TU, kan als tuberculine-negatief worden beschouwd.
vals-positieve reacties
vals-positieve tuberculinereacties kunnen voorkomen bij personen die zijn geïnfecteerd met andere mycobacteriën, waaronder vaccinatie met BCG. (8) een diagnose van M. tuberculosis-infectie en het gebruik van preventieve therapie moeten echter worden overwogen voor elke met BCG gevaccineerde persoon die een positieve TST-reactie heeft, met name als de persoon een verhoogd risico op TB-infectie heeft of loopt. (Zie indicaties en gebruik.) (14) (15)
vals-negatieve reacties
niet alle geïnfecteerde personen hebben een vertraagde overgevoeligheidsreactie op een tuberculinetest.
bij ouderen of bij degenen die voor het eerst worden getest, kunnen de reacties zich langzaam ontwikkelen en hun piek pas na 72 uur bereiken.
aangezien het na blootstelling aan M. tuberculosis tot 8 weken kan duren voordat tuberculinegevoeligheid ontstaat (zie werkingsmechanisme), moeten personen met een negatieve tuberculinetest <8 weken na een mogelijke TB-blootstelling opnieuw worden getest ≥8-10 weken na de laatst bekende of vermoede blootstelling. (16)
veranderde immuunstatus
verminderde of verzwakte celgemedieerde immuniteit (CMI) kan mogelijk een vals-negatieve tuberculinereactie veroorzaken. Veel factoren zijn gemeld om een verminderd vermogen te veroorzaken om op de tuberculinetest te reageren in aanwezigheid van tuberculeuze infectie, waaronder virale infecties (bijv. mazelen, bof, waterpokken en HIV), vaccinaties met levend virus (bijv., mazelen, bof, rodehond, orale polio en gele koorts), overweldigende tuberculose, andere bacteriële infecties, leukemie, sarcoïdose, schimmelinfecties, metabole stoornissen, lage eiwit Staten, ziekten die lymfoïde organen, drugs (corticosteroïden en vele andere immunosuppressiva), en malignancy of stress. (8) (17) (18) een TST moet worden uitgesteld voor patiënten met ernstige virale infecties of vaccinatie met levend virus in de afgelopen maand. Personen met verkoudheid kunnen tuberculine getest worden.
omdat de TST-resultaten bij HIV-geïnfecteerde personen minder betrouwbaar zijn naarmate de CD4-tellingen afnemen, moet de screening zo vroeg mogelijk na het optreden van de HIV-infectie worden voltooid. (18)
Boostereffect en Tweestappentests
indien tuberculinetests met regelmatige tussenpozen worden uitgevoerd, bijvoorbeeld bij gezondheidswerkers of gevangenispersoneel, moeten tweestappentests worden uitgevoerd als uitgangssituatie om te voorkomen dat een boostereffect wordt geïnterpreteerd als een tuberculineconversie. Als de eerste test geen of een kleine reactie vertoonde, moet de tweede test één tot vier weken later worden uitgevoerd. Beide tests moeten na 48 tot 72 uur worden gelezen en geregistreerd. Patiënten met een tweede tuberculinetest (booster) respons van ≥10 mm moeten worden beschouwd als patiënten met een tbc-infectie in het verleden. (14) (19)
personen die geen boost geven bij herhaalde tests na één week, maar bij wie de tuberculinereacties na één jaar positief worden, moeten worden geacht een nieuw verworven tuberculose-infectie te hebben en dienovereenkomstig worden behandeld. (7)
Hoe wordt Tubersol geleverd
Tubersol tuberculine Purified Protein derivaat (Mantoux), bio-equivalent aan 5 Amerikaanse eenheden (TU) PPD-S per testdosis (0.1 mL) wordt geleverd in:
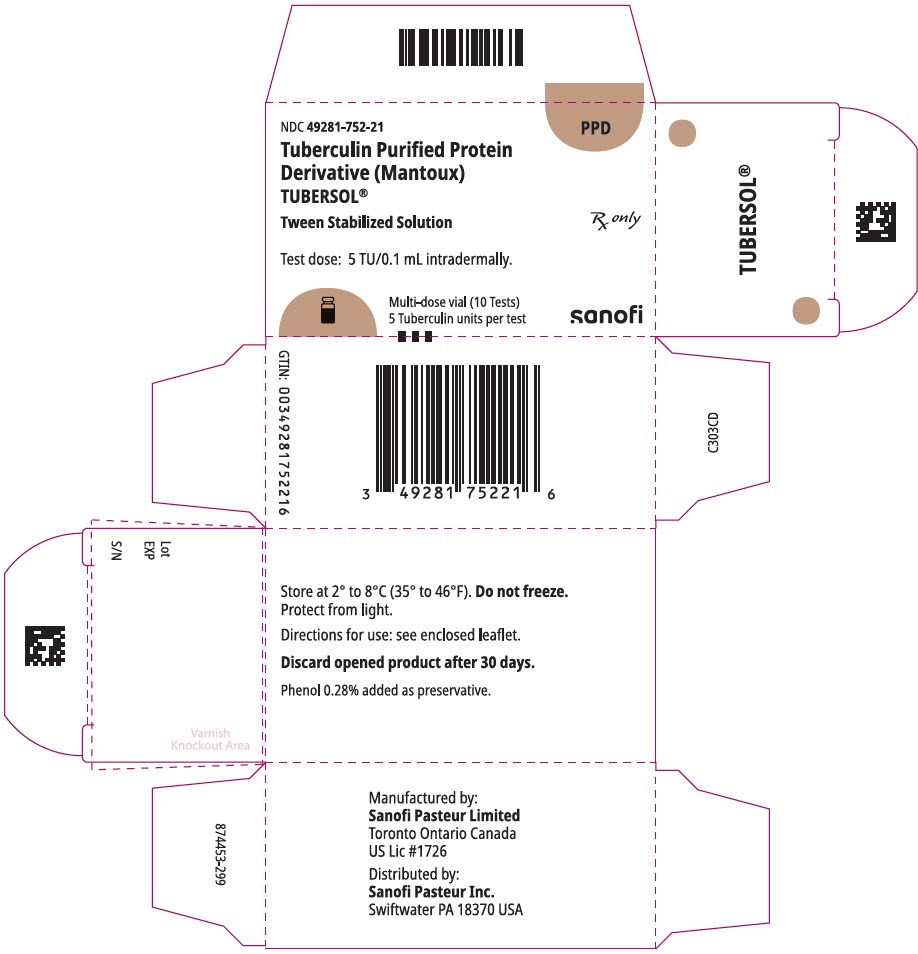
1 mL multi-dose flacon (10 tests). NDC Nr. 49281-752-78; verpakking van 1 injectieflacon, NDC Nr. 49281-752-21
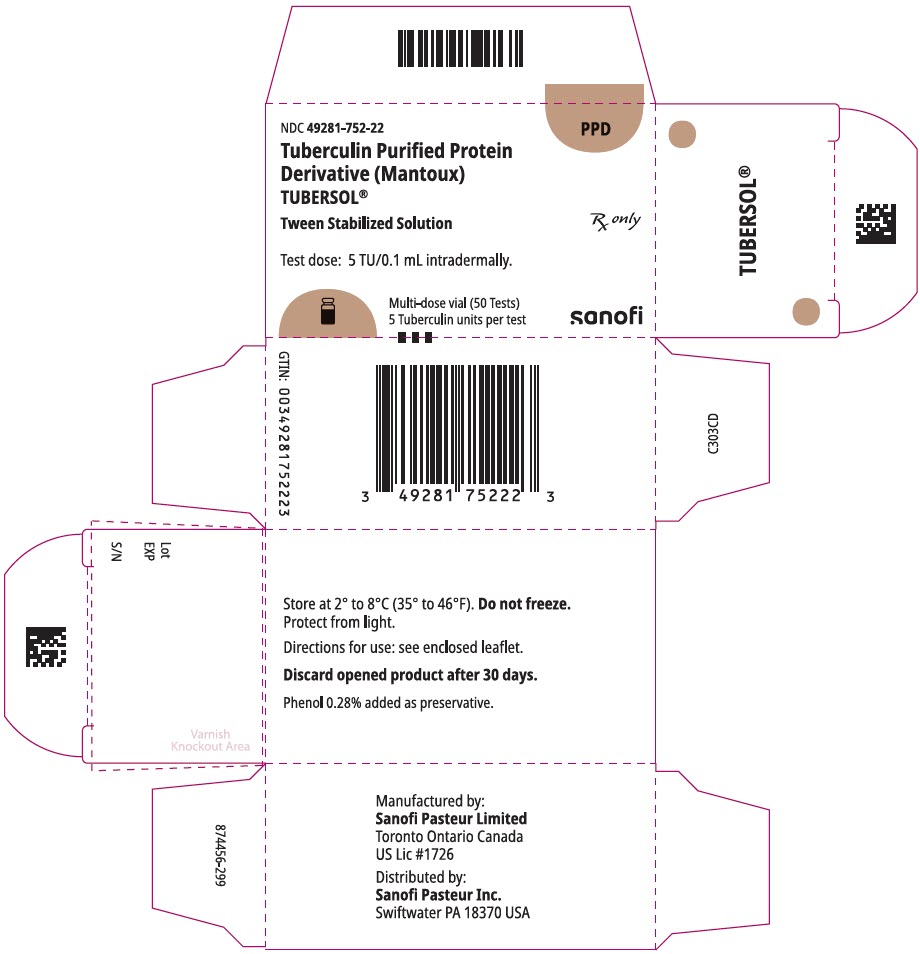
5 mL multi-dose flacon (50 tests). NDC Nr. 49281-752-98; verpakking van 1 injectieflacon, NDC Nr. 49281-752-22
De stop van de injectieflacon voor dit product bevat geen natuurlijk latexrubber.
opslag
Bewaren bij 2 ° tot 8 ° C (35° tot 46°F). (20) Niet in de vriezer bewaren. Gooi het product weg als het wordt ingevroren.
beschermen tegen licht. PPD-oplossingen voor tuberculine kunnen nadelig worden beïnvloed door blootstelling aan licht. Het product moet in het donker worden bewaard, behalve wanneer de doses daadwerkelijk uit de injectieflacon worden opgezogen. (21)
een injectieflacon Tubersol die 30 dagen in gebruik is, moet worden weggegooid. (22)
niet gebruiken na de vervaldatum.
1 Landi S. bereiding, zuivering en stabiliteit van tuberculine. Appl Microbiol 1963; 11: 408-412. 2 Landi s, et al. Bereiding en karakterisering van een grote partij tuberculine gezuiverd eiwitderivaat (PPD-CT68). Ann Scalvo.1980;22:889-907. 3 US Code of Federal Regulations, Titel 21, deel 610, subdeel C-Standard preparations and limits of potency. 4 Landi s, et al. Adsorptie van tuberculine PPD aan glazen en plastic oppervlakken. Stier. WHO 1966; 35: 593-602. 5 Landi s, et al. Ongelijkheid van de potentie tussen gestabiliseerde en niet-gestabiliseerde verdunde tuberculineoplossingen. Am Rev Respir Dis 1971; 104: 385-393. 6 Landi s, et al. Stabiliteit van verdunde oplossingen van tuberculine gezuiverd eiwitderivaat. Tuberkel 1978; 59: 121-133. 7 Menzies D. interpretatie van herhaalde tuberculinetests. Am J Respir Crit Care Med 1999; 159: 15-21. 8 American Thoracic Society: Diagnostic standards and classification of tuberculosis in adults and children. Am J Respir Crit Care Med 2000; 161: 1376-1395. 9 CDC. Bijgewerkte richtlijnen voor het gebruik van Interferon Gamma Release Assays om Mycobacterium tuberculosis Infection op te sporen – Verenigde Staten, 2010. MMWR 2010; 59 (RR-5):1-25. 10 CDC. Gerichte tuberculinetests en behandeling van latente tuberculose-infecties. MMWR 2000; 49 (RR-6): 23-5. 11 Froeschle JE, et al. Onmiddellijke overgevoeligheidsreacties na gebruik van tuberculine huidtesten. Clin infected Dis 2002; 34: e12-13. 12 Brickman HF, et al. Het tijdstip van tuberculinetests in verband met immunisatie met levende virale vaccins. Kindergeneeskunde: 1975; 55: 392-396. 13 CDC. Algemene aanbevelingen inzake immunisatie: aanbevelingen van de Adviescommissie inzake Immunisatiepraktijken (ACIP) en de American Academy of Family Physicians (AAFP). MMWR 2002; 51 (RR-2): 1-36. 14 CDC. Guidelines for preventing the transmission of Mycobacterium tuberculosis in health-care settings, 2005. MMWR 2005; 54 (RR-17): 1-141. 15 CDC. De rol van BCG vaccin in de preventie en bestrijding van tuberculose in de Verenigde Staten. Een gemeenschappelijke verklaring van de Adviesraad voor de uitroeiing van tuberculose en het Raadgevend Comité voor Immunisatiepraktijken. MMWR 1996; 45 (RR-4): 1-18. 16 CDC. Richtlijnen voor het onderzoek naar contacten van personen met infectieuze tuberculose: aanbevelingen van de National Tuberculosis Controllers Association en CDC. MMWR 2005; 54 (RR-15): 1-37. 17 Mori en Shiozawa. Onderdrukking van tuberculineovergevoeligheid veroorzaakt door rubella-infectie. Am Rev Respir Dis 1985; 886-888. 18 CDC. Richtlijnen voor de preventie en behandeling van opportunistische infecties bij met HIV geïnfecteerde volwassenen en adolescenten. Aanbevelingen van de CDC, de National Institutes of Health, en de HIV Medicine Association of Infectious Diseases Society of America. MMWR 2009; 58 (RR-4): 1-207. 19 CDC. Preventie en bestrijding van tuberculose in gevangenissen en detentiecentra: aanbevelingen van de CDC. MMWR 2006; 55 (RR-9): 1-44. 20 Landi s, et al. Stabiliteit van verdunde oplossing van tuberculine gezuiverd eiwitderivaat bij extreme temperaturen. J Biol Stand 1981; 9: 195-199. 21 Landi s, et al. Effect van licht op tuberculine gezuiverde eiwitderivaten. Am Rev Respir Dis 1975; 111: 52-61. 22 Landi s, et al. Effect van oxidatie op de stabiliteit van tuberculine purified protein derivaat (PPD) In: internationaal Symposium over Tuberculines en BCG vaccin. Bazel: International Association of Biological Standardization, 1983. Dev Biol Stand 1986; 58: 545-552.
geproduceerd door:
Sanofi Pasteur Limited
Toronto Ontario Canada
gedistribueerd door:
Sanofi Pasteur Inc.
Swiftwater PA 18370 USA
productinformatie vanaf
November 2020
hoofddisplay – 1 mL Flaconetiket
tuberculine gezuiverd
Eiwitderivaat
(Mantoux)
Tubersol®
multi-dose flacon
1 mL (10 Tests)
testdosis: 5 TU/0,1 mL ID.
beschermen tegen licht.
weggooien geopend
product na 30 dagen.
RX alleen
Sanofi Pasteur Limited
datum geopend

hoofddisplay – 1 mL flacon
NDC 49281-752-21
PPD
tuberculine Purified Protein
derivaat (Mantoux)
Tubersol®
tween gestabiliseerde oplossing
multi-dose flacon 10 tests 5 tu
RX alleen
testdosis: 5 tu/0,1 ml intradermaal.
Bio-equivalent aan 5 Amerikaanse eenheden (TU) PPD-S
SANOFI PASTEUR
hoofdscherm – 5 mL Flaconetiket
tuberculine Purified Protein
derivaat (Mantoux)
Tubersol®
multi-dose flacon
5 mL (50 Tests)
testdosis: 5 tu/0,1 ml ID.
Rx alleen
beschermen tegen licht.
na 30 dagen geopend product weggooien.
Sanofi Pasteur Limited
datum geopend

hoofddisplay – 5 mL flacon doos
NDC 49281-752-22
PPD
tuberculine gezuiverd eiwit
derivaat (Mantoux)
Tubersol®
Tween gestabiliseerde oplossing
multi-dosis flacon 50 testen 5 tu
RX alleen
testdosis: 5 tu/0,1 ml intradermaal.
Bio-equivalent to 5 US units (TU) of PPD-S
SANOFI PASTEUR
| Tubersol tuberculin purified protein derivative injection, solution |
|||||||||||||||||||
|
|||||||||||||||||||
|
|||||||||||||||||||
|
|||||||||||||||||||
|
|||||||||||||||||||
|
|||||||||||||||||||
|
|||||||||||||||||||
Labeler – Sanofi Pasteur Inc. (086723285)
| Establishment | |||
| Name | Address | ID/FEI | Operations |
| Sanofi Pasteur Limited | 208206623 | MANUFACTURE(49281-752) | |
Meer over Tubersol (tuberculine gezuiverd eiwit afgeleide)
- bijwerkingen
- Borstvoeding
- Dosering Informatie
- Drug Interactions
- Prijzen & Coupons
- Drug klasse: in vivo diagnostische biologicals
Consument hulpbronnen
- Geavanceerde Lezen
Professionele hulpbronnen
- Prescribing Information
Overige merken Aplisol
behandeling in Verband met gidsen
- Diagnose en Onderzoek
Medische Disclaimer