nazwa ogólna: tuberkulina oczyszczona pochodna białka
postać dawkowania: wstrzyknięcie, roztwór
Drugs.com. Ostatnia aktualizacja: Nov 1, 2020.
- przegląd
- skutki uboczne
- dawkowanie
- profesjonalne
- interakcje
- Więcej
AHFS Kategoria: 36:
tylko Rx
antygen diagnostyczny
(pomoc w wykrywaniu zakażenia Mycobacterium tuberculosis)
do stosowania śródskórnego
polisorbat 80 stabilizowany roztwór tuberkuliny oczyszczona Pochodna białkowa do badań tuberkulinowych u ludzi
opis Tubersolu
Tubersol® oczyszczona Pochodna białkowa (Mantoux) (PPD) (1) do badań śródskórnych Próba tuberkulinowa jest przygotowywana z dużej głównej partii tuberkuliny Connaught (ct68) (2) i jest Bezkomórkową oczyszczoną frakcją białkową otrzymaną z ludzkiego szczepu Mycobacterium tuberculosis hodowanego na wolne od białka podłoże syntetyczne i inaktywowane. (2) przyjęto stosowanie standardowego preparatu pochodzącego z jednej partii (CT68) w celu wyeliminowania różnic między partiami przez tego samego producenta. (2)
Tubersol jest przezroczystą, bezbarwną cieczą.
| Tubersol zawiera: | |
| oczyszczona pochodna białka M. tuberculosis | 5 tu na 0.1 mL |
| Polysorbate 80 | 0.0006% |
| Phenol | 0.22% to 0.35% w/v |
| in sterile isotonic phosphate buffered saline. | |
Before release, each successive lot is tested for potency in comparison with the US Standard Tuberculin PPD-S. (3)
niezależne badania przeprowadzone przez Amerykańską publiczną służbę zdrowia na ludziach ustaliły ilość Ct68 w stabilizowanym roztworze niezbędną (4) (5) (6) do uzyskania równoważności biologicznej z tuberkuliną PPD-s (w buforze fosforanowym bez polisorbatu 80) przy użyciu 5 jednostek tuberkuliny PPD-s usa (TU) jako normy.
Tubersol – Farmakologia kliniczna
mechanizm działania
uczulenie po zakażeniu prątkami występuje głównie w regionalnych węzłach chłonnych. Małe limfocyty (limfocyty T) namnażają się w odpowiedzi na bodziec antygenowy, dając początek specjalnie uwrażliwionym limfocytom. Po 3-8 tygodniach limfocyty te wchodzą do krwiobiegu i krążą przez lata. (7) późniejsza restymulacja tych uwrażliwionych limfocytów tym samym lub podobnym antygenem, taka jak śródskórne wstrzyknięcie Tubersolu, wywołuje lokalną reakcję za pośrednictwem tych komórek. (8)
charakterystyczne jest, że opóźnione reakcje nadwrażliwości na tuberkulinę zaczynają się od 5 do 6 godzin, są maksymalne od 48 do 72 godzin i ustępują w ciągu kilku dni. Wynikająca z tego odpowiedź immunologiczna polega na stwardnieniu spowodowanym naciekiem komórkowym i sporadycznie pęcherzykami i martwicą. Klinicznie opóźniona reakcja nadwrażliwości na tuberkulinę jest objawem wcześniejszego zakażenia gruźlicą M lub różnymi bakteriami niebędącymi gruźlicą. W większości przypadków uczulenie jest wywoływane przez naturalne zakażenie prątkami lub przez szczepienie szczepionką BCG.
wskazania i zastosowanie do Tubersol
Tubersol tuberkulina oczyszczona Pochodna białka (Mantoux), jest wskazana do wspomagania diagnozy zakażenia gruźlicą (TB) u osób ze zwiększonym ryzykiem rozwoju aktywnej choroby.
Centers for Disease Control and Prevention (CDC) opublikowało wytyczne dotyczące populacji, które skorzystałyby z tuberkulinowych testów skórnych (TST). Aktualne rekomendacje dostępne są pod adresem: http://www.cdc.gov/tb/publications/factsheets/testing.htm.
wcześniejsze szczepienie BCG nie jest przeciwwskazaniem do wykonania próby tuberkulinowej. Wyniki testów skórnych osób zaszczepionych BCG mogą być wykorzystane do potwierdzenia lub wykluczenia rozpoznania zakażenia gruźlicą. Jednakże, zatwierdzony przez FDA Test uwalniania interferonu gamma jest preferowany w stosunku do tuberkulinowego testu skórnego dla osób w wieku 5 lat i starszych, które były wcześniej szczepione BCG. (9)
przeciwwskazania
alergia na jakikolwiek składnik Tubersolu lub reakcja anafilaktyczna lub inna reakcja alergiczna na wcześniejsze badanie tuberkuliny PPD jest przeciwwskazaniem do stosowania Tubersolu. (Patrz opis i sposób dostawy.)
Tubersol nie powinien być podawany:
- osoby, u których wystąpiła ciężka reakcja (np. martwica, pęcherze, wstrząs anafilaktyczny lub owrzodzenia) na wcześniejszą TST,
- osoby z udokumentowaną aktywną gruźlicą lub z wyraźnym leczeniem zakażenia lub choroby gruźlicy w wywiadzie, (10)
- osoby z rozległymi oparzeniami lub wypryskiem.
Ostrzeżenia
nadwrażliwość
Po zastosowaniu Tubersolu mogą wystąpić reakcje alergiczne nawet u osób, u których w wywiadzie nie stwierdzono nadwrażliwości na składniki produktu. (11) wstrzyknięcie epinefryny (1:1000) i inne odpowiednie leki stosowane w celu opanowania natychmiastowych reakcji alergicznych muszą być natychmiast dostępne.
omdlenia
w związku z podawaniem leków do wstrzykiwań, w tym Tubersolu, mogą wystąpić omdlenia (omdlenia). Procedury powinny być stosowane, aby uniknąć upadku zranienia i przywrócić perfuzję mózgową po omdleniu.
środki ostrożności
ogólne
ograniczenia diagnostyczne
u niektórych osób mogą wystąpić fałszywie dodatnie lub fałszywie ujemne reakcje tuberkulinowej próby skórnej. (Zob. interpretacja testu.)
fałszywie dodatnie testy tuberkulinowe występują u osób zakażonych innymi mykobakteriami, w tym u szczepionych BCG.
nie u wszystkich osób zakażonych wystąpi opóźniona reakcja nadwrażliwości na próbę tuberkulinową.
opisano wiele czynników powodujących zmniejszenie zdolności do odpowiedzi na próbę tuberkulinową w obecności zakażenia tuberkulinowego. (Zob. interpretacja testu.)
informacje dla pacjentów
przed podaniem Tubersolu należy sprawdzić aktualny stan zdrowia pacjenta i historię choroby. Lekarz powinien sprawdzić historię szczepień pacjenta pod kątem możliwej wrażliwości na składniki Tubersolu.
świadczeniodawca powinien poinformować pacjenta o konieczności powrotu na czytanie testu. Samoczynny odczyt testu okazał się niedokładny i zawodny.
świadczeniodawca powinien dać pacjentowi stałą osobistą kartotekę. Ponadto ważne jest, aby pracownik służby zdrowia zapisywał historię badań w stałej dokumentacji medycznej każdego pacjenta. Ta stała dokumentacja biurowa powinna zawierać nazwę produktu, podaną datę, dawkę, producenta i numer partii, a także wynik testu w milimetrach stwardnienia (w tym, w stosownych przypadkach, 0 mm). Zgłaszanie wyników jedynie jako negatywnych lub pozytywnych nie jest zadowalające.
interakcje z lekami
reaktywność na test może być obniżona lub zahamowana u osób otrzymujących kortykosteroidy lub leki immunosupresyjne. (8)
reaktywność na Tubersol może być przejściowo obniżona przez niektóre żywe szczepionki wirusowe (odra, świnka, różyczka, polio doustne, żółta gorączka i ospa wietrzna). Jeśli niedawno podano pozajelitową szczepionkę z żywym atenuowanym wirusem, badanie tuberkulinowe należy opóźnić o > 1 miesiąc po szczepieniu. (8) (12) (zob. interpretacja testu.)
w przypadku konieczności przeprowadzenia badań przesiewowych tuberkulinowych jednocześnie ze szczepionką zawierającą odrę lub inną żywą, atenuowaną szczepionką pozajelitową, preferowanym rozwiązaniem jest jednoczesne podawanie Tubersolu i szczepionki w różnych miejscach.
rakotwórczość, mutageneza, upośledzenie płodności
nie oceniano działania rakotwórczego lub mutagennego Tubersolu ani upośledzenia płodności.
ciąża
nie przeprowadzono badań dotyczących wpływu Tubersolu na reprodukcję zwierząt. Nie wiadomo również, czy Bulwersol może powodować uszkodzenie płodu po podaniu kobiecie w ciąży lub może wpływać na zdolność reprodukcyjną. Tubersol należy podawać kobietom w ciąży tylko wtedy, gdy jest to wyraźnie konieczne.
matki karmiące
nie wiadomo, czy Tubersol przenika do mleka kobiecego. Ponieważ wiele leków przenika do mleka kobiecego, należy zachować ostrożność podczas podawania Tubersolu kobietom karmiącym piersią.
stosowanie u dzieci
nie ma przeciwwskazań do tuberkulinowego badania skóry niemowląt. Niemowlęta<w wieku 6 miesięcy zakażone M. tuberculosis mogą nie reagować na Tubersol. (Zob. interpretacja testu.
stosowanie w podeszłym wieku
badania kliniczne Tubersolu nie obejmowały wystarczającej liczby pacjentów w wieku 65 lat i starszych, aby określić, czy reagują oni inaczej niż młodsi pacjenci.
działania niepożądane
stwardnienie w miejscu wstrzyknięcia Tubersolu jest oczekiwaną reakcją na pozytywny wynik testu skórnego. (Zob. interpretacja testu.)
informacje dotyczące działań niepożądanych zostały zebrane na podstawie historycznych badań klinicznych i doświadczeń po wprowadzeniu Tubersolu do obrotu.
Zaburzenia ogólne i stany w miejscu podania
ból w miejscu wstrzyknięcia, świąd w miejscu wstrzyknięcia i dyskomfort w miejscu wstrzyknięcia. Rumień w miejscu wstrzyknięcia lub wysypka w miejscu wstrzyknięcia (bez stwardnienia) występujące w ciągu 12 godzin od wykonania badania. Reakcje te nie wskazują na zakażenie gruźlicą. Krwotok w miejscu wstrzyknięcia i krwiak w miejscu wstrzyknięcia do trzech dni po podaniu testu. Pęcherzyki w miejscu wstrzyknięcia, owrzodzenie w miejscu wstrzyknięcia lub martwica w miejscu wstrzyknięcia u osób bardzo wrażliwych. Blizna w miejscu wstrzyknięcia w wyniku silnie pozytywnych reakcji. Gorączka
zaburzenia układu immunologicznego
nadwrażliwość, w tym anafilaksja/reakcje anafilaktyczne, obrzęk naczynioruchowy, pokrzywka
zaburzenia układu oddechowego, klatki piersiowej i śródpiersia
Stridor, duszność
Zaburzenia skóry i tkanki podskórnej
wysypka, uogólniona wysypka
zaburzenia układu nerwowego
Presyncope, omdlenia (w tym omdlenia związane z ruchami toniczno-klonicznymi i innymi napadami drgawkowymi) czasami prowadzące do przejściowej utraty przytomności z urazem
zgłaszanie zdarzeń niepożądanych
w celu zgłoszenia podejrzewanych działań niepożądanych należy skontaktować się z działem nadzoru nad bezpieczeństwem farmakoterapii Departament, Sanofi Pasteur Inc., Discovery Drive, Swiftwater, PA 18370 lub zadzwoń 1-800-822-2463 (1-800-szczepionka) lub Food and Drug Administration (FDA) MEDWATCH Program na 1-800-332-1088 i www.fda.gov/medwatch.
Dawkowanie i podawanie Tubersolu
dawkowanie
Pięć (5) jednostek tuberkuliny (TU) na dawkę testową 0,1 mL jest standardową wytrzymałością stosowaną do testów śródskórnych (Mantoux).
sposób podawania
Tubersol jest wskazany wyłącznie do iniekcji śródskórnych. Nie wstrzykiwać dożylnie, domięśniowo ani podskórnie. W przypadku wstrzyknięcia podskórnego nie można interpretować testu.
przed użyciem należy sprawdzić, czy nie występują obce cząstki stałe i (lub) odbarwienie. Jeśli takie warunki istnieją, nie podawać produktu.
do każdego wstrzyknięcia należy użyć oddzielnej strzykawki i igły. (13)
do wykonania testu Mantoux zalecana jest następująca procedura:
- preferowanym miejscem badania jest aspekt volarny przedramienia. Unikaj miejsc na skórze, które są zaczerwienione lub opuchnięte. Unikaj widocznych żył.
- oczyść miejsce skóry odpowiednim środkiem bakteriobójczym i pozwól miejscu wyschnąć przed wstrzyknięciem antygenu.
- podawać dawkę testową (0,1 mL) Tubersolu za pomocą strzykawki o pojemności 1 mL, skalibrowanej w dziesiątych częściach i wyposażonej w krótką, 1/4 do 1/5 cala, igłę 26 lub 27 g.
- przetrzeć korek fiolki odpowiednim środkiem bakteriobójczym i pozostawić do wyschnięcia przed włożeniem igły. Następnie delikatnie wprowadzić igłę przez korek i pobrać 0, 1 mL Tubersolu do strzykawki. Unikać wstrzykiwania nadmiaru powietrza z usuwaniem każdej dawki, tak aby nie zwiększyć ciśnienia w fiolce i ewentualnie spowodować wyciek w miejscu wkłucia.
- wbić punkt igły w najbardziej powierzchowne warstwy skóry ze skosem igły skierowanym ku górze i podać dawkę w powolnym wstrzyknięciu śródskórnym. Jeśli wstrzyknięcie śródskórne zostanie wykonane prawidłowo, w miejscu igły pojawi się wyraźny blady pęcherzyk o średnicy około 10 mm (3/8″). Ten bąbel rozproszy się w ciągu kilku minut. Nie ubieraj witryny.
- po wstrzyknięciu w miejscu podania może pojawić się kropla krwi. Lekko osuszyć miejsce, aby usunąć krew, ale unikać wyciskania wstrzykniętego płynu do próby tuberkulinowej.
w przypadku nieprawidłowo wykonanego wstrzyknięcia (tj. braku pęcherzyka), należy powtórzyć test natychmiast w innym miejscu, co najmniej 2 cale od pierwszego miejsca i okrążyć drugie miejsce wstrzyknięcia, wskazując, że jest to miejsce, które należy odczytać.
poinformuj pacjenta o konieczności powrotu na czytanie testu przez przeszkolonego pracownika służby zdrowia. Samodzielne czytanie może być niedokładne i jest zdecydowanie odradzane.
interpretacja testu
test skórny powinien być odczytany przez przeszkolonego pracownika służby zdrowia 48 do 72 godzin po podaniu Tubersolu. Czułość testu skórnego jest wskazywana wyłącznie przez stwardnienie; nie należy mierzyć zaczerwienienia.
zmierz średnicę stwardnienia poprzecznie do długiej osi przedramienia i zapisz pomiar w milimetrach (w tym 0 mm). (8) końcówka długopisu, delikatnie popchnięta pod kątem 45° w kierunku miejsca wstrzyknięcia, zatrzyma się na krawędzi stwardnienia.
również odnotuj obecność i rozmiar (jeśli występuje) martwicy i obrzęku, chociaż nie są one używane w interpretacji testu.
reakcje dodatnie
reaktywność tuberkulinowa może wskazywać na utajone zakażenie, wcześniejsze zakażenie i/lub chorobę z M. tuberculosis i niekoniecznie wskazuje na obecność czynnej choroby tuberkulinowej. Osoby wykazujące pozytywne reakcje tuberkulinowe powinny być uznane za pozytywne zgodnie z aktualnymi wytycznymi dotyczącymi zdrowia publicznego i skierowane do dalszej oceny medycznej. (8) (10) powtarzane badania osób niezakażonych nie uczulają ich na Tubersol. (7) (8) (10)
znaczenie pomiarów stwardnienia w diagnozowaniu utajonego zakażenia TB należy wziąć pod uwagę w kontekście historii choroby pacjenta i ryzyka rozwoju czynnej choroby TB, jak wskazano w tabeli 1. (10)
| reakcja ≥5 mm stwardnienia | reakcja ≥10 mm stwardnienia | reakcja ≥15 mm stwardnienia | ||
|---|---|---|---|---|
| * ryzyko wystąpienia gruźlicy u pacjentów leczonych kortykosteroidami zwiększa się wraz z większą dawką i dłuższym czasem trwania. † W przypadku osób o niskim ryzyku i poddawanych badaniom na początku zatrudnienia reakcję stwardnienia ≥15 mm uważa się za pozytywną. | ||||
| osoby zakażone HIV | osoby zakażone HIV | td> | nowi imigranci (tj. w ciągu ostatnich 5 lat) z krajów o wysokim wskaźniku rozpowszechnienia osoby zażywające narkotyki dożylnie mieszkańcy lub pracownicy następujących grup wysokiego ryzyka: więzienia i więzienia, domy opieki i inne długoterminowe obiekty dla osób starszych, szpitale i inne zakłady opieki zdrowotnej, obiekty mieszkalne dla pacjentów z zespołem nabytego niedoboru odporności (AIDS) i schroniska dla bezdomnych personel laboratorium Mykobakteriologicznego osoby z następującymi chorobami klinicznymi, które stawiają je w grupie wysokiego ryzyka: krzemica, cukrzyca, przewlekła niewydolność nerek, niektóre zaburzenia hematologiczne (np. białaczki i chłoniaki), inne specyficzne nowotwory złośliwe (np. dzieci w wieku poniżej 4 lat lub niemowlęta, dzieci i młodzież narażone na kontakt z Dorosłymi z grupy wysokiego ryzyka |
osoby bez czynników ryzyka gruźlicy |
konwersję TST definiuje się jako zwiększenie stwardnienia o ≥10 mm w ciągu 2 lat, niezależnie od wieku. (10)
należy wziąć pod uwagę możliwość, że czułość testu skórnego może być również spowodowana wcześniejszym kontaktem z atypowymi mykobakteriami lub wcześniejszym szczepieniem BCG. (8) (10)
reakcje negatywne
osoba, która nie wykazuje pozytywnej reakcji na 5 TU w pierwszym teście, ale podejrzewa się, że ma pozytywny wynik TB, może zostać ponownie zbadana przy użyciu 5 TU. (Patrz efekt boostera i testowanie dwuetapowe.) Każda osoba, która nie wykazuje pozytywnej reakcji na początkowe wstrzyknięcie 5 TU lub drugie badanie z 5 TU, może zostać uznana za tuberkulinową negatywną.
reakcje fałszywie dodatnie
fałszywie dodatnie reakcje tuberkulinowe mogą wystąpić u osób zakażonych innymi mykobakteriami, w tym u osób zaszczepionych BCG. (8) jednakże należy rozważyć rozpoznanie zakażenia M. tuberculosis i zastosowanie terapii zapobiegawczej u każdej osoby zaszczepionej BCG, u której wystąpiła dodatnia reakcja TST, zwłaszcza jeśli osoba ta była lub jest narażona na zwiększone ryzyko zakażenia gruźlicą. (Patrz wskazania i zastosowanie.) (14) (15)
fałszywie ujemne reakcje
nie u wszystkich zakażonych osób wystąpi opóźniona reakcja nadwrażliwości na próbę tuberkulinową.
u osób w podeszłym wieku lub u osób, które są badane po raz pierwszy, reakcje mogą rozwijać się powoli i mogą osiągać szczyt dopiero po 72 godzinach.
ponieważ wrażliwość na tuberkulinę może rozwinąć się do 8 tygodni po ekspozycji na M. tuberculosis (patrz mechanizm działania), osoby, u których wynik testu tuberkulinowego jest ujemny<8 tygodni po ewentualnej ekspozycji na gruźlicę, powinny zostać ponownie zbadane ≥8-10 tygodni po ostatniej znanej lub podejrzewanej ekspozycji. (16)
zmieniony stan immunologiczny
upośledzona lub atenuowana odporność komórkowa (CMI) może potencjalnie spowodować fałszywie ujemną reakcję tuberkulinową. Zgłaszano wiele czynników powodujących zmniejszenie zdolności do odpowiedzi na próbę tuberkulinową w obecności zakażenia tuberkulinowego, w tym zakażenia wirusowe (np. odra, świnka, ospa wietrzna i HIV), szczepienia przeciwko żywym wirusom (np., odra, świnka, różyczka, polio jamy ustnej i żółta gorączka), przytłaczająca gruźlica, inne infekcje bakteryjne, białaczka, sarkoidoza, zakażenia grzybicze, zaburzenia metaboliczne, Stany o niskim poziomie białka, choroby narządów limfatycznych, leki (kortykosteroidy i wiele innych środków immunosupresyjnych) i nowotwór lub stres. (8) (17) (18) TST należy odroczyć w przypadku pacjentów z poważnymi zakażeniami wirusowymi lub szczepieniami żywymi wirusami w ciągu ostatniego miesiąca. Osoby z przeziębieniem mogą zostać poddane badaniu tuberkulinowemu.
ponieważ wyniki TST u osób zakażonych HIV są mniej wiarygodne w miarę zmniejszania się liczby CD4, badania przesiewowe należy zakończyć jak najwcześniej po wystąpieniu zakażenia HIV. (18)
efekt wzmacniający i dwuetapowe badanie
Jeśli próby tuberkulinowe będą przeprowadzane w regularnych odstępach czasu, na przykład wśród pracowników służby zdrowia lub pracowników więziennictwa, należy przeprowadzić dwuetapowe badanie jako punkt odniesienia, aby uniknąć interpretacji efektu wzmacniającego jako konwersji tuberkuliny. Jeśli pierwsze badanie nie wykazało reakcji lub małej reakcji, drugie badanie należy wykonać jeden do czterech tygodni później. Oba testy powinny być odczytywane i rejestrowane w ciągu 48 do 72 godzin. Należy uznać, że u pacjentów, u których wykonano drugą próbę tuberkulinową (przypominającą) ≥10 mm, wystąpiło zakażenie gruźlicą w przeszłości. (14) (19)
osoby, które nie nasilają się po powtórzeniu testów w ciągu tygodnia, ale których reakcje tuberkulinowe zmieniają się na pozytywne po roku, należy uznać za nowo nabyte zakażenie gruźlicą i odpowiednio je opanować. (7)
W Jaki Sposób dostarczany jest Tubersol
Tubersol tuberkulina oczyszczona Pochodna białka (Mantoux), biorównoważna do 5 jednostek US (TU) PPD-s na dawkę testową (0.1 mL) jest dostarczany w:
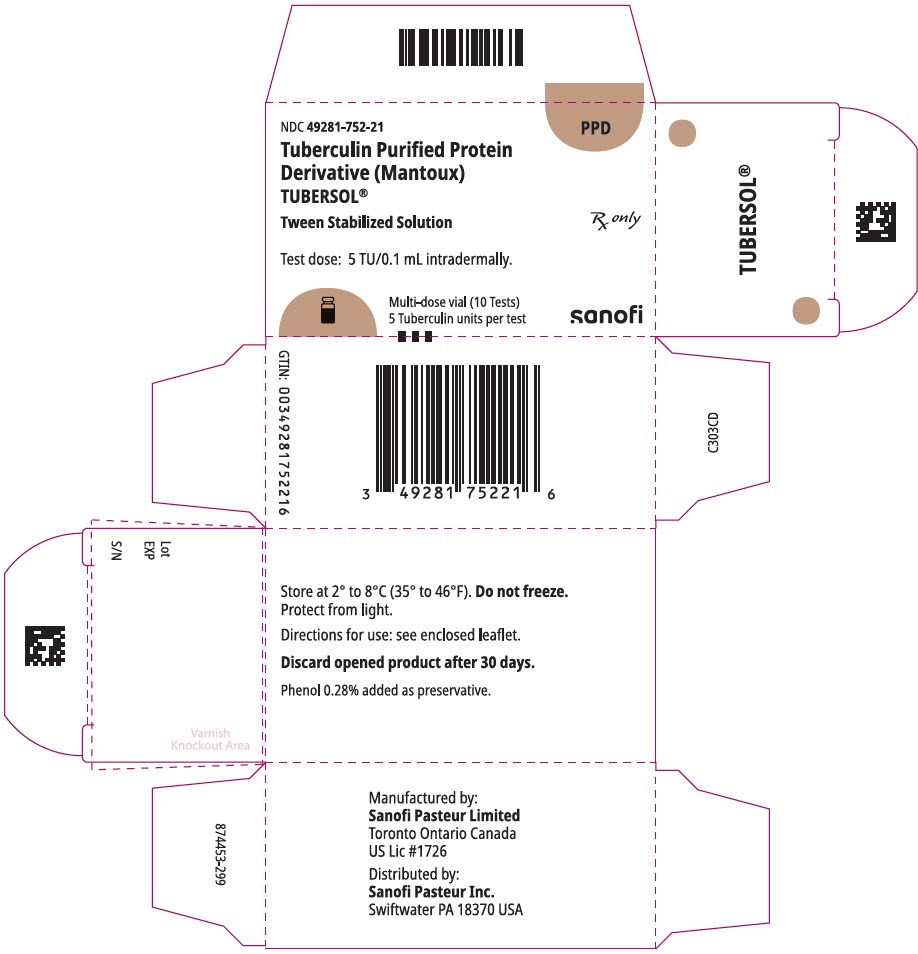
fiolce wielodawkowej o pojemności 1 mL (10 testów). NDC nr 49281-752-78; opakowanie zawierające 1 fiolkę, NDC nr 49281-752-21
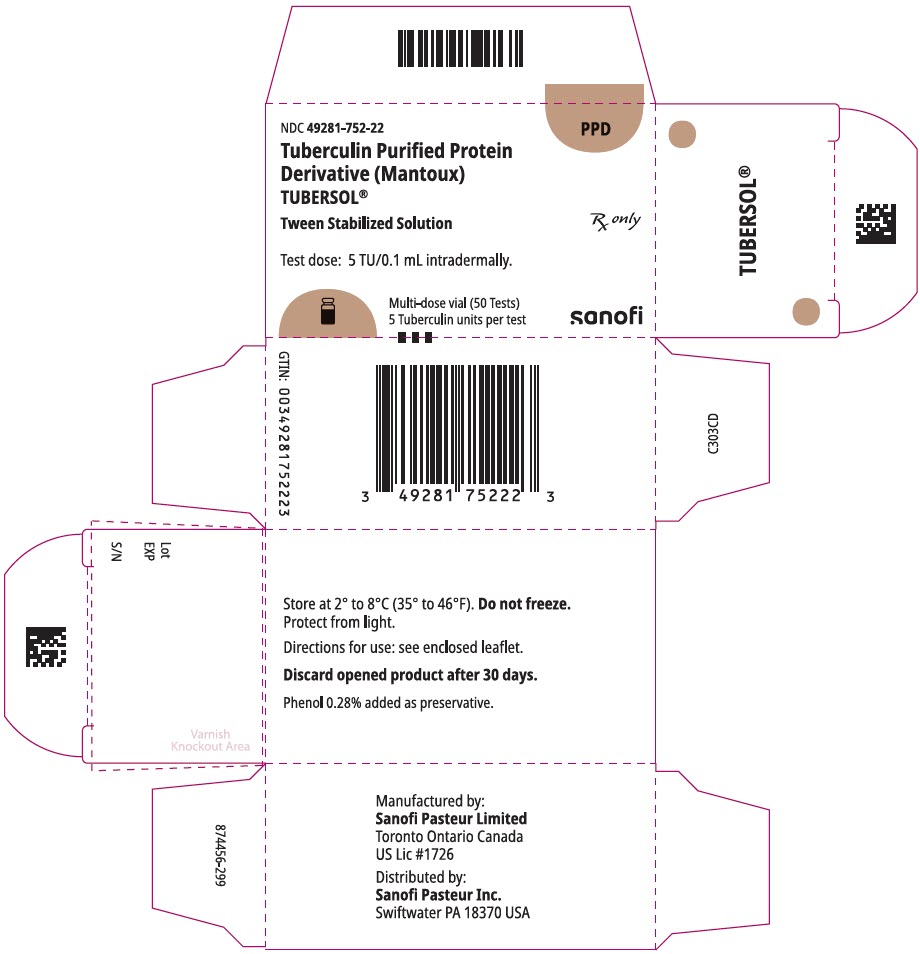
fiolka wielodawkowa 5 mL (50 testów). NDC nr 49281-752-98; opakowanie zawierające 1 fiolkę, NDC nr 49281-752-22
korek fiolki dla tego produktu nie zawiera naturalnej gumy lateksowej.
przechowywanie
Przechowywać w temperaturze od 2° C do 8°C (35° do 46°F). (20) Nie zamrażać. Produkt należy wyrzucić w przypadku zamrożenia.
chronić przed światłem. Tuberkuliny roztwory PPD mogą mieć niekorzystny wpływ na działanie światła. Produkt powinien być przechowywany w ciemności, z wyjątkiem sytuacji, gdy dawki są faktycznie pobierane z fiolki. (21)
fiolkę z Tubersolem, która była wprowadzana i używana przez 30 dni, należy wyrzucić. (22)
nie stosować po upływie terminu ważności.
1 Landi S. przygotowanie, Oczyszczanie i stabilizacja tuberkuliny. Appl Microbiol 1963;11: 408-412. 2 Landi S, et al. Przygotowanie i charakterystyka dużej partii tuberkuliny oczyszczonej pochodnej białkowej (PPD-CT68). Ann Scalvo.1980;22:889-907. 3 US Code of Federal Regulations, Title 21, Part 610, Subpart C-preparaty standardowe i limity siły działania. 4 Landi S, et al. Adsorpcja tuberkuliny PPD na powierzchniach szklanych i plastikowych. Bzdura. WHO 1966;35:593-602. 5 Landi S, et al. Dysproporcja siły działania pomiędzy stabilizowanymi i niestabilizowanymi rozcieńczonymi roztworami tuberkulinowymi. Am Rev Respir Dis 1971;104: 385-393. 6 Landi S, et al. Stabilność rozcieńczonych roztworów tuberkuliny oczyszczonej pochodnej białka. 1978;59: 121-133. 7 Menzies D. interpretacja powtarzanych prób tuberkulinowych. Am J Respir Crit Care Med 1999;159: 15-21. 8 American Thoracic Society: Diagnostic standards and classification of tuberculosis in adults and children. Am J Respir Crit Care Med 2000;161: 1376-1395. 9 CDC. Zaktualizowane wytyczne dotyczące stosowania testów uwalniania interferonu Gamma do wykrywania zakażenia Mycobacterium tuberculosis-Stany Zjednoczone, 2010. MMWR 2010; 59 (RR-5): 1-25. 10 CDC. Celowane próby tuberkulinowe i leczenie utajonego zakażenia gruźlicą. MMWR 2000;49(RR-6):23-5. 11 Froeschle JE, et al. Natychmiastowe reakcje nadwrażliwości po zastosowaniu tuberkulinowego testu skórnego. Clin Infect Dis 2002; 34: e12-13. 12 Brickman HF, et al. Czas prób tuberkulinowych w związku z immunizacją żywymi szczepionkami wirusowymi. Pediatrics: 1975; 55: 392-396. 13 CDC. Ogólne zalecenia dotyczące immunizacji: zalecenia Komitetu Doradczego ds. praktyk Immunizacyjnych (ACIP) i Amerykańskiej Akademii Lekarzy Rodzinnych (AAFP). MMWR 2002; 51 (RR-2): 1-36. 14 CDC. Guidelines for preventing the transmission of Mycobacterium tuberculosis in health-care settings, 2005. MMWR 2005;54(RR-17):1-141. 15 CDC. Rola szczepionki BCG w zapobieganiu i zwalczaniu gruźlicy w Stanach Zjednoczonych. Wspólne oświadczenie Komitetu Doradczego ds. eliminacji gruźlicy i Komitetu Doradczego ds. praktyk szczepień. MMWR 1996; 45(RR-4): 1-18. 16 CDC. Wytyczne dotyczące badania kontaktów osób z gruźlicą zakaźną: zalecenia Krajowego Stowarzyszenia kontrolerów gruźlicy i CDC. MMWR 2005;54(RR-15):1-37. 17 Mori i Shiozawa. Tłumienie nadwrażliwości tuberkulinowej wywołanej zakażeniem różyczką. Am Rev Respir Dis 1985; 886-888. 18 CDC. Wytyczne dotyczące zapobiegania i leczenia zakażeń oportunistycznych u zakażonych HIV dorosłych i młodzieży. Zalecenia CDC, National Institutes of Health i HIV Medicine Association of Infectious Diseases Society of America. MMWR 2009; 58 (RR-4): 1-207. 19 CDC. Zapobieganie i zwalczanie gruźlicy w zakładach karnych i aresztach: zalecenia CDC. MMWR 2006; 55 (RR-9): 1-44. 20 Landi S, et al. Stabilność rozcieńczonego roztworu oczyszczonej pochodnej tuberkuliny białkowej w ekstremalnych temperaturach. J Biol Stand 1981;9: 195-199. 21 Landi S, et al. Wpływ światła na oczyszczone roztwory pochodnych tuberkuliny. Am Rev Respir Dis 1975; 111: 52-61. 22 Landi S, et al. Wpływ utleniania na stabilność tuberkulinowej oczyszczonej pochodnej białkowej (PPD) w: International Symposium on Tuberculins and BCG Vaccine. Basel: International Association of Biological Standardization, 1983. Dev Biol Stand 1986;58:545-552.
produkcja:
Sanofi Pasteur Limited
Toronto Ontario Canada
Dystrybucja:
Sanofi Pasteur Inc.
Swiftwater PA 18370 USA
informacje o produkcie na dzień
listopad 2020
główny panel wyświetlacza – Etykieta fiolki 1 mL
tuberkulina oczyszczona
Pochodna białka
(Mantoux)
Tubersol®
fiolka wielodawkowa
1 mL (10 testów)
dawka testowa: 5 TU/0,1 mL ID.
chronić przed światłem.
produkt otwarty należy wyrzucić po 30 dniach.
tylko Rx
Sanofi Pasteur Limited
Data otwarcia

główny panel wyświetlacza – Pudełko tekturowe z fiolką 1 mL
NDC 49281-752-21
PPD
białko tuberkulinowe oczyszczone
Pochodna (Mantoux)
tubersol®
Tween stabilizowany roztwór
fiolka wielodawkowa 10 testów 5 tu
tylko RX
dawka testowa: 5 tu/0,1 ml śródskórnie.
Bio-odpowiednik 5 jednostek US (TU) PPD-s
SANOFI PASTEUR
główny panel wyświetlacza – Etykieta fiolki 5 mL
białko oczyszczone tuberkuliny
Pochodna (Mantoux)
Tubersol®
fiolka wielodawkowa 5 mL (50 testów)
dawka testowa: 5 tu/0,1 ml ID.
tylko Rx
chronić przed światłem.
produkt otwarty należy wyrzucić po 30 dniach.
Sanofi Pasteur Limited
data otwarcia

główny panel wyświetlacza – Pudełko tekturowe z fiolką 5 mL
NDC 49281-752-22
PPD
oczyszczone białko tuberkuliny
Pochodna (Mantoux)
Tubersol®
Tween stabilizowany roztwór
fiolka wielodawkowa 50 testów 5 tu
tylko RX
dawka testowa: 5 tu/0,1 ml śródskórnie.
Bio-equivalent to 5 US units (TU) of PPD-S
SANOFI PASTEUR
| Tubersol tuberculin purified protein derivative injection, solution |
|||||||||||||||||||
|
|||||||||||||||||||
|
|||||||||||||||||||
|
|||||||||||||||||||
|
|||||||||||||||||||
|
|||||||||||||||||||
|
|||||||||||||||||||
Labeler – Sanofi Pasteur Inc. (086723285)
| Establishment | |||
| Name | Address | ID/FEI | Operations |
| Sanofi Pasteur Limited | 208206623 | MANUFACTURE(49281-752) | |
więcej o Tubersolu (oczyszczona pochodna tuberkuliny)
- skutki uboczne
- karmienie piersią
- Informacje o dawkowaniu
- interakcje z lekami
- Cennik& kupony
- Klasa leku: biologiczne produkty diagnostyczne in vivo
zasoby konsumenckie
- zaawansowane Czytanie
profesjonalne zasoby
- informacje o przepisywaniu
inne marki aplisol
powiązane Przewodniki leczenia
- diagnostyka i badanie
oświadczenie Medyczne