Nome generico: tubercolina purificata proteina derivata
Forma di dosaggio: iniezione, soluzione
Medicamente recensito da Drugs.com. Ultimo aggiornamento il nov 1, 2020.
- Panoramica
- Effetti collaterali
- Dosaggio
- Professionale
- Interazioni
- Più
AHFS Categoria: 36:84
Rx solo
Diagnostica Antigene
(Aiuto nella diagnosi dell’infezione da Mycobacterium tuberculosis)
PER USO INTRADERMICO.
Polisorbato 80 Soluzione Stabilizzata di Tubercolina Derivato Proteico Purificato per Tubercolina Test sull’Uomo
Tubersol Descrizione
Tubersol® Tubercolina Derivato Proteico Purificato (Mantoux) (PPD) (1) intradermica test della tubercolina è preparato da un grande Master Batch Connaught Tubercolina (CT68) (2) e è una cella priva di proteina purificata frazione ottenuto da un ceppo di Mycobacterium tuberculosis coltivate su un mezzo sintetico privo di proteine e inattivato. (2) È stato adottato l’uso di un preparato standard derivato da un singolo lotto (CT68) al fine di eliminare la variazione da lotto a lotto da parte dello stesso produttore. (2)
Tubersol è un chiaro, liquido incolore.
| Tubersol contiene: | |
| proteina Purificata, derivati di M. tuberculosis | 5 TU per 0.1 mL |
| Polysorbate 80 | 0.0006% |
| Phenol | 0.22% to 0.35% w/v |
| in sterile isotonic phosphate buffered saline. | |
Before release, each successive lot is tested for potency in comparison with the US Standard Tuberculin PPD-S. (3)
Studi indipendenti condotti dall’US Public Health Service negli esseri umani hanno determinato la quantità di CT68 in soluzione stabilizzata necessaria (4) (5) (6) per produrre bio-equivalenza con Tubercolina PPD-S (in tampone fosfato senza polisorbato 80) utilizzando 5 unità statunitensi (TU) Tubercolina PPD-S come standard.
Tubersol – Farmacologia clinica
Meccanismo d’azione
La sensibilizzazione a seguito di infezione da micobatteri si verifica principalmente nei linfonodi regionali. Piccoli linfociti (linfociti T) proliferano in risposta allo stimolo antigenico per dare origine a linfociti specificamente sensibilizzati. Dopo 3-8 settimane, questi linfociti entrano nel flusso sanguigno e circolano per anni. (7) La successiva restimolazione di questi linfociti sensibilizzati con lo stesso o un antigene simile, come l’iniezione intradermica di Tubersol, evoca una reazione locale mediata da queste cellule. (8)
Tipicamente, le reazioni di ipersensibilità ritardata alla tubercolina iniziano da 5 a 6 ore, sono massime da 48 a 72 ore e diminuiscono in un periodo di giorni. La risposta immunitaria risultante consiste in indurimento dovuto all’infiltrazione cellulare e occasionalmente vescicolazione e necrosi. Clinicamente, una reazione di ipersensibilità ritardata alla tubercolina è una manifestazione di precedente infezione da tubercolosi M o una varietà di batteri non tubercolari. Nella maggior parte dei casi la sensibilizzazione è indotta dall’infezione micobatterica naturale o dalla vaccinazione con il vaccino BCG.
Indicazioni e utilizzo per Tubersol
Tubersol Tuberculin Purified Protein Derivative (Mantoux), è indicato per aiutare la diagnosi di infezione da tubercolosi (TB) in persone ad aumentato rischio di sviluppare malattie attive.
I Centri per il controllo e la prevenzione delle malattie (CDC) hanno pubblicato linee guida riguardanti le popolazioni che trarrebbero beneficio dal test cutaneo alla tubercolina (TST). È possibile accedere alle raccomandazioni correnti all’indirizzo: http://www.cdc.gov/tb/publications/factsheets/testing.htm.
La precedente vaccinazione BCG non è una controindicazione al test della tubercolina. I risultati dei test cutanei delle persone vaccinate BCG possono essere utilizzati per supportare o escludere la diagnosi di infezione da TB. Tuttavia, un test di rilascio di interferone gamma approvato dalla FDA è preferito rispetto al test cutaneo alla tubercolina per le persone di età pari o superiore a 5 anni che sono state precedentemente vaccinate con BCG. (9)
Controindicazioni
L’allergia a qualsiasi componente di Tubersol o una reazione allergica anafilattica o altra a un precedente test di tubercolina PPD è una controindicazione all’uso di Tubersol. (Vedi DESCRIZIONE e COME FORNITO.)
Tubersol non deve essere somministrato a:
- Persone che hanno avuto una reazione grave (ad es. necrosi, vesciche, shock anafilattico o ulcerazioni) a un TST precedente,
- Persone con tubercolosi attiva documentata o una chiara storia di trattamento per infezione o malattia da TBC, (10)
- Persone con ustioni estese o eczema.
Avvertenze
Ipersensibilità
In seguito all’uso di Tubersol possono verificarsi reazioni allergiche anche in soggetti senza precedenti di ipersensibilità ai componenti del prodotto. (11) Iniezione di epinefrina (1:1.000) e altri agenti appropriati utilizzati per il controllo delle reazioni allergiche immediate devono essere immediatamente disponibili.
Sincope
La sincope (svenimento) può verificarsi in associazione alla somministrazione di medicinali iniettabili, incluso Tubersol. Le procedure dovrebbero essere in atto per evitare lesioni da caduta e per ripristinare la perfusione cerebrale dopo sincope.
Precauzioni
Generale
Limitazioni diagnostiche
In alcuni individui possono verificarsi reazioni al test cutaneo alla tubercolina falsi positivi o falsi negativi. (Vedi Interpretazione del Test.)
Test di reazione alla tubercolina falsi positivi si verificano in individui che sono stati infettati con altri micobatteri, inclusa la vaccinazione con BCG.
Non tutte le persone infette avranno una reazione di ipersensibilità ritardata al test della tubercolina.
Molti fattori sono stati segnalati per causare una ridotta capacità di rispondere al test della tubercolina in presenza di infezione tubercolare. (Vedi Interpretazione del Test.)
Informazioni per i pazienti
Prima della somministrazione di Tubersol, lo stato di salute attuale del paziente e la storia medica devono essere rivisti. Il medico deve esaminare la storia di immunizzazione del paziente per la possibile sensibilità ai componenti di Tubersol.
L’operatore sanitario deve informare il paziente della necessità di tornare per la lettura del test. L’auto-lettura del test ha dimostrato di essere imprecisa e inaffidabile.
L’operatore sanitario deve fornire al paziente una registrazione personale permanente. Inoltre, è essenziale che l’operatore sanitario registri la storia dei test nella cartella clinica permanente di ciascun paziente. Questo registro permanente dell’ufficio deve contenere il nome del prodotto, la data indicata, la dose, il produttore e il numero di lotto, nonché il risultato del test in millimetri di indurimento (incluso 0 mm, se del caso). La segnalazione dei risultati solo come negativi o positivi non è soddisfacente.
Interazioni farmacologiche
La reattività al test può essere depressa o soppressa nelle persone che ricevono corticosteroidi o agenti immunosoppressivi. (8)
La reattività al Tubersol può essere temporaneamente depressa da alcuni vaccini a virus vivi (morbillo, parotite, rosolia, poliomielite orale, febbre gialla e varicella). Se è stato somministrato di recente un vaccino a virus vivo attenuato per via parenterale, il test della tubercolina deve essere ritardato per>1 mese dopo la vaccinazione. (8) (12) (Cfr.Interpretazione del Test.)
Quando lo screening della tubercolina è richiesto contemporaneamente a un vaccino contenente il morbillo o ad un altro vaccino a virus vivo attenuato per via parenterale, la somministrazione simultanea di Tubersol e del vaccino in siti separati è l’opzione preferita.
CARCINOGENESI, MUTAGENESI, COMPROMISSIONE DELLA FERTILITÀ
Tubersol non è stato valutato per i suoi potenziali cancerogeni o mutageni o compromissione della fertilità.
Gravidanza
Non sono stati condotti studi sulla riproduzione animale con Tubersol. Inoltre non è noto se Tubersol può causare danni fetali quando somministrato a una donna incinta o può influenzare la capacità di riproduzione. Tubersol deve essere somministrato a una donna incinta solo se chiaramente necessario.
Madri che allattano
Non è noto se Tubersol sia escreto nel latte materno. Poiché molti farmaci sono escreti nel latte umano, si deve prestare attenzione quando Tubersol viene somministrato a una donna che allatta.
Uso pediatrico
Non vi è alcuna controindicazione al test cutaneo alla tubercolina dei neonati. I neonati <di 6 mesi di età infettati da M. tuberculosis potrebbero non reagire a Tubersol. (Vedi Interpretazione del Test.)
Uso geriatrico
Gli studi clinici con Tubersol non hanno incluso un numero sufficiente di soggetti di età pari o superiore a 65 anni per determinare se rispondono in modo diverso rispetto ai soggetti più giovani.
Reazioni avverse
L’indurimento nel sito di iniezione di Tubersol è la reazione attesa per un test cutaneo positivo. (Vedi Interpretazione del Test.)
Le informazioni relative agli eventi avversi sono state ricavate da studi clinici storici e dall’esperienza post-marketing con Tubersol.
Disturbi generali e condizioni al sito di somministrazione
Dolore al sito di iniezione, prurito al sito di iniezione e fastidio al sito di iniezione. Eritema al sito di iniezione o eruzione cutanea al sito di iniezione (senza indurimento) che si verifica entro 12 ore dal test. Queste reazioni non indicano un’infezione da TB. Emorragia del sito di iniezione e ematoma del sito di iniezione fino a tre giorni dopo la somministrazione del test. Vescicole nel sito di iniezione, ulcera nel sito di iniezione o necrosi nel sito di iniezione in soggetti altamente sensibili. Cicatrice del sito di iniezione a seguito di reazioni fortemente positive. Piressia
disturbi del sistema Immunitario
Ipersensibilità, inclusa anafilassi/reazioni anafilattiche, angioedema, orticaria
Respiratorie, toraciche e mediastiniche
Stridore, dispnea
Pelle e del tessuto sottocutaneo
Eruzione cutanea, eruzione cutanea generalizzata
disturbi del sistema Nervoso
Presyncope, sincope (tra cui la sincope associata con tonico-cloniche movimenti e il sequestro di altri-come attività) a volte con conseguente perdita transitoria di coscienza con lesioni
Segnalazione di Eventi Avversi
Per segnalare le SOSPETTE REAZIONI AVVERSE, di contattare la Farmacovigilanza Dipartimento, Sanofi Pasteur Inc. Discovery Auto, Swiftwater, PA 18370 o chiamare 1-800-822-2463 (1-800-VACCINO) o Food and Drug Administration (FDA) MEDWATCH Programma a 1-800-332-1088 e www.fda.gov/medwatch.
Tubersol Dosaggio e Amministrazione
Dosaggio
Cinque (5) tubercolina unità (TU) per test dose di 0,1 mL è lo standard di resistenza utilizzato per via intradermica (Mantoux) test.
Modo di somministrazione
Tubersol è indicato solo per l’iniezione intradermica. Non iniettare per via endovenosa, intramuscolare o sottocutanea. Se si verifica un’iniezione sottocutanea, il test non può essere interpretato.
Controllare la presenza di particelle estranee e / o scolorimento prima dell’uso. Se queste condizioni esistono, non somministrare il prodotto.
Utilizzare una siringa e un ago separati per ogni iniezione. (13)
Per eseguire il test di Mantoux si consiglia la seguente procedura:
- Il sito preferito del test è l’aspetto volare dell’avambraccio. Evitare le aree sulla pelle che sono rosse o gonfie. Evitare le vene visibili.
- Pulire il sito della pelle con un germicida adatto e lasciare asciugare il sito prima dell’iniezione dell’antigene.
- Somministrare la dose di prova (0,1 ml) di Tubersol con una siringa da 1 mL calibrata in decimi e munita di un ago corto da un quarto a mezzo pollice da 26 o 27 gauge.
- Pulire il tappo del flaconcino con un germicida adatto e lasciare asciugare prima dell’inserimento dell’ago. Quindi inserire delicatamente l’ago attraverso il tappo e aspirare 0,1 mL di Tubersol nella siringa. Evitare l’iniezione di aria in eccesso con la rimozione di ogni dose in modo da non sovrapressurizzare il flaconcino e possibilmente causare infiltrazioni nel sito di puntura.
- Inserire la punta dell ‘ago negli strati più superficiali della pelle con lo smusso dell’ ago rivolto verso l ‘ alto e somministrare la dose mediante iniezione intradermica lenta. Se l’iniezione intradermica viene eseguita correttamente, un pallore chiaro preciso salirà alla punta dell’ago, di circa 10 mm (3/8″) di diametro. Questo bleb si disperderà in pochi minuti. Non vestire il sito.
- Dopo l ‘ iniezione può comparire una goccia di sangue nel sito di somministrazione. Tamponare leggermente il sito per rimuovere il sangue, ma evitare di spremere il fluido tubercolinico iniettato.
In caso di iniezione eseguita in modo improprio (cioè senza formazione di vesciche), ripetere immediatamente il test in un altro sito, ad almeno 2 pollici dal primo sito e circondare il secondo sito di iniezione come indicazione che questo è il sito da leggere.
Informare il paziente della necessità di tornare per la lettura del test da parte di un professionista sanitario addestrato. L’auto-lettura può essere imprecisa ed è fortemente scoraggiata.
Interpretazione del test
Il test cutaneo deve essere letto da un operatore sanitario qualificato 48-72 ore dopo la somministrazione di Tubersol. La sensibilità del test cutaneo è indicata solo dall’indurimento; il rossore non deve essere misurato.
Misurare il diametro dell’indurimento trasversalmente all’asse lungo dell’avambraccio e registrare la misurazione in millimetri (inclusi 0 mm). (8) La punta di una penna a sfera, spinta delicatamente con un angolo di 45° verso il sito di iniezione, si fermerà sul bordo dell’indurimento.
Anche registrare la presenza e la dimensione (se presente) di necrosi ed edema, anche se questi non sono utilizzati nell’interpretazione del test.
Reazioni positive
La reattività alla tubercolina può indicare infezione latente, infezione precedente e/o malattia con M. tuberculosis e non indica necessariamente la presenza di malattia tubercolare attiva. Le persone che mostrano reazioni tubercoliniche positive devono essere considerate positive dalle attuali linee guida di salute pubblica e rinviate per ulteriori valutazioni mediche. (8) (10) I test ripetuti su persone non infette non li sensibilizzano al Tubersol. (7) (8) (10)
Il significato delle misurazioni di indurimento nella diagnosi di infezione latente da TBC deve essere considerato in termini di anamnesi del paziente e del rischio di sviluppare una malattia attiva da TBC come indicato nella Tabella 1. (10)
| Reazione ≥5 mm di Indurimento | Reazione ≥10 mm di Indurimento | Reazione ≥15 mm di Indurimento |
|---|---|---|
| * Rischio di TB in pazienti trattati con corticosteroidi aumenta con la dose più alta e più lunga durata. † Per le persone che sono altrimenti a basso rischio e sono testate all’inizio del rapporto di lavoro, una reazione di indurimento ≥15 mm è considerata positiva. | ||
| persone HIV-positive contatti Recenti della tubercolosi (TB) caso di pazienti Fibrotico modifiche su di una radiografia del torace coerente con i precedenti TB Pazienti con trapianti di organi e di altri pazienti immunodepressi (che riceve l’equivalente di ≥15 mg/die di prednisone per 1 mese o più)* |
immigrati Recenti (cioè, entro gli ultimi 5 anni) da paesi ad alta prevalenza di tossicodipendenti Iniezione i Residenti o i dipendenti† delle seguenti operazioni ad alto rischio, si riuniscono impostazioni: prigioni e carceri, case di cura e altri a lungo termine, camere / strutture per anziani, ospedali e altre strutture sanitarie, strutture residenziali per pazienti con sindrome da immunodeficienza acquisita (AIDS) e rifugi per senzatetto il laboratorio di Micobatteriologia personale le Persone con le seguenti condizioni cliniche che a rischio: la silicosi, diabete mellito, insufficienza renale cronica, alcuni disturbi ematologici (ad esempio, le leucemie e i linfomi), altri specifici tumori maligni (ad es. carcinoma della testa o del collo e del polmone), la perdita di peso ≥10% del peso corporeo ideale, gastrectomia e bypass digiuno-ileale Bambini di età inferiore ai 4 anni di età, anche neonati, bambini, e gli adolescenti esposti per adulti ad alto rischio |
Persone con fattori di rischio per TB |
UN TST conversione è definita come un aumento ≥10 mm di indurimento entro un periodo di 2 anni, indipendentemente dall’età. (10)
Si deve considerare la possibilità che la sensibilità al test cutaneo possa essere dovuta anche ad un precedente contatto con micobatteri atipici o ad una precedente vaccinazione BCG. (8) (10)
Reazioni negative
Un individuo che non mostra una reazione positiva a 5 TU al primo test, ma è sospettato di essere positivo alla TB, può essere nuovamente testato con 5 TU. (Vedere Effetto booster e test in due fasi.) Qualsiasi individuo che non mostra una reazione positiva ad una prima iniezione di 5 TU, o ad un secondo test con 5 TU può essere considerato come tubercolina negativa.
Reazioni false positive
Reazioni false positive alla tubercolina possono verificarsi in individui che sono stati infettati con altri micobatteri, inclusa la vaccinazione con BCG. (8) Tuttavia, una diagnosi di infezione da M. tuberculosis e l’uso della terapia preventiva devono essere presi in considerazione per qualsiasi persona vaccinata con BCG che abbia una reazione TST positiva, specialmente se la persona è stata, o è, ad aumentato rischio di contrarre l’infezione da TB. (Vedere INDICAZIONI E UTILIZZO.) (14) (15)
Reazioni false negative
Non tutte le persone infette avranno una reazione di ipersensibilità ritardata al test della tubercolina.
In soggetti anziani o sottoposti a test per la prima volta, le reazioni possono svilupparsi lentamente e raggiungere il picco solo dopo 72 ore.
Poiché la sensibilità alla tubercolina può richiedere fino a 8 settimane per svilupparsi dopo l’esposizione a M. tuberculosis (vedere Meccanismo d’azione), le persone che hanno un test della tubercolina negativo<8 settimane dopo una possibile esposizione alla TB devono essere nuovamente testate ≥8-10 settimane dopo l’ultima esposizione nota o sospetta. (16)
Stato immunitario alterato
L’immunità cellulo-mediata compromessa o attenuata (CMI) può potenzialmente causare una reazione tubercolina falsa negativa. Molti fattori sono stati segnalati per causare una ridotta capacità di rispondere al test della tubercolina in presenza di infezione tubercolare, incluse infezioni virali (ad es. morbillo, parotite, varicella e HIV), vaccinazioni con virus vivi (ad es., morbillo, parotite, rosolia, poliomielite orale e febbre gialla), tubercolosi travolgente, altre infezioni batteriche, leucemia, sarcoidosi, infezioni fungine, alterazioni metaboliche, stati a basso contenuto proteico, malattie che colpiscono gli organi linfoidi, farmaci (corticosteroidi e molti altri agenti immunosoppressivi) e malignità o stress. (8) (17) (18) Un TST deve essere differito per i pazienti con infezioni virali importanti o vaccinazione con virus vivi nell’ultimo mese. Le persone con il comune raffreddore possono essere testate alla tubercolina.
Poiché i risultati di TST in individui con infezione da HIV sono meno affidabili in quanto i conteggi di CD4 diminuiscono, lo screening dovrebbe essere completato il prima possibile dopo che si verifica l’infezione da HIV. (18)
Effetto di richiamo e test in due fasi
Se il test della tubercolina sarà condotto a intervalli regolari, ad esempio tra operatori sanitari o carcerieri, il test in due fasi dovrebbe essere eseguito come linea di base per evitare di interpretare un effetto di richiamo come una conversione della tubercolina. Se il primo test non ha mostrato alcuna reazione o una piccola reazione, il secondo test deve essere eseguito da una a quattro settimane più tardi. Entrambi i test devono essere letti e registrati a 48-72 ore. Si deve considerare che i pazienti con una seconda risposta al test della tubercolina (booster) ≥10 mm hanno avuto in passato un’infezione da TBC. (14) (19)
Le persone che non aumentano quando vengono sottoposti a test ripetuti ad una settimana, ma le cui reazioni alla tubercolina diventano positive dopo un anno, devono essere considerate avere un’infezione da tubercolosi di nuova acquisizione e gestite di conseguenza. (7)
Come viene fornito Tubersol
Tubersol Tuberculin Purified Protein Derivative (Mantoux), bioequivalente a 5 unità US (TU) PPD-S per dose di prova (0.1 mL) viene fornito in:
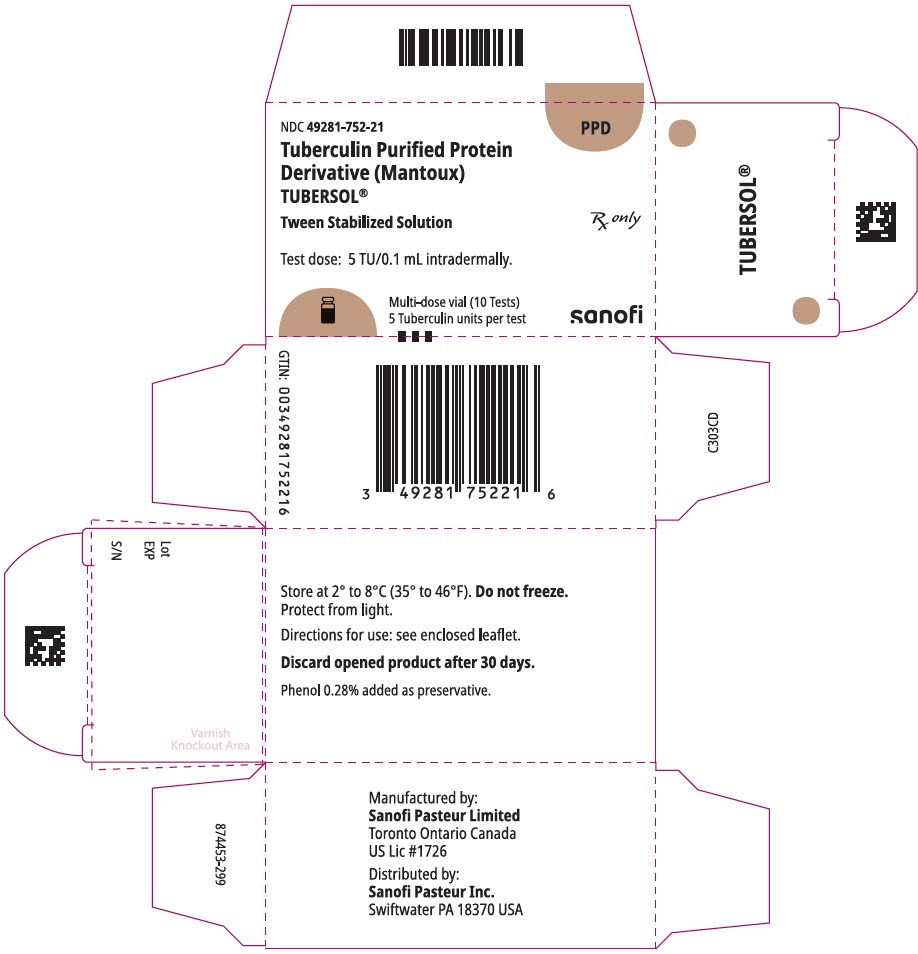
flaconcino multidose da 1 mL (10 test). N. NDC 49281-752-78; confezione da 1 flaconcino, N. NDC 49281-752-21
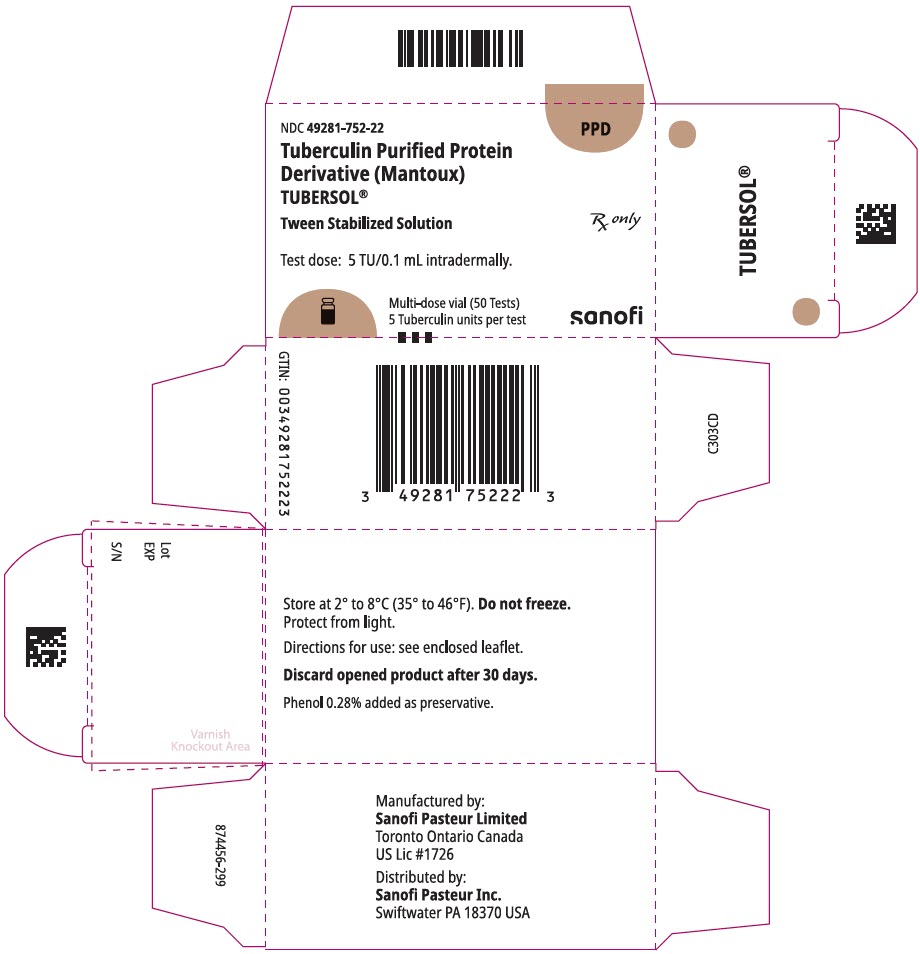
Flaconcino multidose da 5 ml (50 test). NDC No. 49281-752-98; confezione da 1 flaconcino, NDC No. 49281-752-22
Il tappo del flaconcino per questo prodotto non contiene lattice di gomma naturale.
STOCCAGGIO
Conservare a 2 ° a 8 ° C (35° a 46°F). (20) Non congelare. Eliminare il prodotto se esposto al congelamento.
Proteggere dalla luce. Le soluzioni di tubercolina PPD possono essere influenzate negativamente dall’esposizione alla luce. Il prodotto deve essere conservato al buio tranne quando le dosi vengono effettivamente prelevate dal flaconcino. (21)
Un flaconcino di Tubersol inserito e in uso per 30 giorni deve essere eliminato. (22)
Non utilizzare dopo la data di scadenza.
1 Landi S. Preparazione, purificazione e stabilità della tubercolina. Appl Microbiol 1963;11:408-412. 2 Landi S, et al. Preparazione e caratterizzazione di un grande lotto di derivato proteico purificato alla tubercolina (PPD-CT68). Ann Scalvo.1980;22:889-907. 3 Codice statunitense dei regolamenti federali, Titolo 21, Parte 610, Capitolo C-Preparazioni standard e limiti di potenza. 4 Landi S, et al. Adsorbimento della tubercolina PPD su superfici in vetro e plastica. Toro. CHI 1966;35: 593-602. 5 Landi S, et al. Disparità di potenza tra soluzioni diluite di tubercolina stabilizzate e non stabilizzate. Am Rev Respir Dis 1971;104: 385-393. 6 Landi S, et al. Stabilità di soluzioni diluite di derivato proteico purificato alla tubercolina. Tubercolo 1978; 59: 121-133. 7 Menzies D. Interpretazione di ripetuti test alla tubercolina. Am J Respir Crit Cura Med 1999;159:15-21. 8 American Thoracic Society: standard diagnostici e classificazione della tubercolosi negli adulti e nei bambini. Am J Respir Crit Cura Med 2000;161:1376-1395. 9 CDC. Linee guida aggiornate per l’utilizzo di test di rilascio di interferone gamma per rilevare l’infezione da Mycobacterium tuberculosis-Stati Uniti, 2010. MMWR 2010; 59 (RR-5): 1-25. 10 CDC. Test mirati alla tubercolina e trattamento dell’infezione da tubercolosi latente. MMWR 2000; 49 (RR-6): 23-5. 11 Froeschle JE, et al. Reazioni di ipersensibilità immediate dopo l’uso del test cutaneo alla tubercolina. Clin Infect Dis 2002;34:e12-13. 12 Brickman HF, et al. I tempi dei test alla tubercolina in relazione all’immunizzazione con vaccini virali vivi. Pediatria: 1975; 55: 392-396. 13 CDC. Raccomandazioni generali sull’immunizzazione: raccomandazioni del Comitato consultivo sulle pratiche di immunizzazione (ACIP) e dell’American Academy of Family Physicians (AAFP). MMWR 2002;51 (RR-2): 1-36. 14 CDC. Guidelines for preventing the transmission of Mycobacterium tuberculosis in health-care settings, 2005. 2005; 54 (RR-17): 1-141. 15 CDC. Il ruolo del vaccino BCG nella prevenzione e nel controllo della tubercolosi negli Stati Uniti. Una dichiarazione congiunta del Consiglio consultivo per l’eliminazione della tubercolosi e del Comitato consultivo per le pratiche di immunizzazione. MMWR 1996; 45 (RR-4): 1-18. 16 CDC. Linee guida per lo studio dei contatti di persone con tubercolosi infettiva: Raccomandazioni della National Tuberculosis Controllers Association e CDC. MMWR 2005; 54 (RR-15): 1-37. 17 Mori e Shiozawa. Soppressione dell’ipersensibilità alla tubercolina causata dall’infezione da rosolia. Am Rev Respir Dis 1985; 886-888. 18 CDC. Linee guida per la prevenzione e il trattamento delle infezioni opportunistiche negli adulti e negli adolescenti con infezione da HIV. Raccomandazioni del CDC, del National Institutes of Health e dell’HIV Medicine Association of Infectious Diseases Society of America. 2009; 58 (RR-4): 1-207. 19 CDC. Prevenzione e controllo della tubercolosi nelle strutture correttive e di detenzione: raccomandazioni del CDC. MMWR 2006; 55 (RR-9): 1-44. 20 Landi S, et al. Stabilità della soluzione diluita di derivato proteico purificato alla tubercolina a temperature estreme. J Biol Stand 1981; 9: 195-199. 21 Landi S, et al. Effetto della luce sulle soluzioni derivate proteiche purificate alla tubercolina. Am Rev Respir Dis 1975;111: 52-61. 22 Landi S, et al. Effetto dell’ossidazione sulla stabilità del derivato proteico purificato della tubercolina (PPD) In: Simposio internazionale sulle tubercoline e il vaccino BCG. Basilea: International Association of Biological Standardization, 1983. Dev Biol Stand 1986;58: 545-552.
Prodotto da:
Sanofi Pasteur Limited
Toronto Ontario Canada
Distribuito da:
Sanofi Pasteur Inc.
Swiftwater PA 18370 USA
Informazioni sul prodotto a partire da
novembre 2020
PANNELLO PRINCIPALE DEL DISPLAY-Etichetta del flaconcino da 1 ml
Tubercolina purificata
Derivato proteico
(Mantoux)
Tubersol®
Flaconcino multidose
1 mL (10 test)
Dose di prova: 5 TU/0,1 ml ID.
Proteggere dalla luce.
Scartare il prodotto aperto
dopo 30 giorni.
Rx solo
Sanofi Pasteur Limitata
la Data di apertura

le PRINCIPALI DISPLAY PANEL – 1 mL Fiala Cartone
NDC 49281-752-21
PPD
Tubercolina Proteina Purificata
Derivati (Mantoux)
Tubersol®
Interpolazione Soluzione Stabilizzata
Multi-dose vial 10 Test 5 UF
Rx solo
Prova la dose: 5 TU/0,1 mL per via intradermica.
Bio-equivalente a 5 unità US (TU) di PPD-S
SANOFI PASTEUR
DISPLAY PRINCIPALE – Etichetta del flaconcino da 5 ml
Proteina purificata tubercolina
Derivato (Mantoux)
Tubersol®
Flaconcino multidose
5 ml (50 test)
Dose di prova: 5 TU/0,1 mL ID.
Rx solo
Proteggere dalla luce.
Eliminare il prodotto aperto dopo 30 giorni.
Sanofi Pasteur Limitata
la Data di apertura

le PRINCIPALI PANNELLO del DISPLAY: 5 mL Fiala Cartone
NDC 49281-752-22
PPD
Tubercolina Proteina Purificata
Derivati (Mantoux)
Tubersol®
Interpolazione Soluzione Stabilizzata
Multi-dose vial 50 Test 5 UF
Rx solo
Prova la dose: 5 TU/0,1 mL per via intradermica.
Bio-equivalent to 5 US units (TU) of PPD-S
SANOFI PASTEUR
| Tubersol tuberculin purified protein derivative injection, solution |
|||||||||||||||||||
|
|||||||||||||||||||
|
|||||||||||||||||||
|
|||||||||||||||||||
|
|||||||||||||||||||
|
|||||||||||||||||||
|
|||||||||||||||||||
Labeler – Sanofi Pasteur Inc. (086723285)
| Establishment | |||
| Name | Address | ID/FEI | Operations |
| Sanofi Pasteur Limited | 208206623 | MANUFACTURE(49281-752) | |
di Più su Tubersol (tubercolina derivato proteico purificato)
- Effetti Collaterali
- l’Allattamento al seno
- il Dosaggio di Informazioni
- interazioni Farmacologiche
- Prezzi & Coupon
- classe di Droga: diagnostico in vivo biologici
risorse per i Consumatori
- Avanzate di Lettura
risorse Professionali
- la Prescrizione di Informazione;
Altre marche Aplisol
relativo trattamento guide
- Diagnosi e nella ricerca
Disclaimer medico