általános név: tuberkulin tisztított fehérje származék
adagolási forma: injekció, oldat
orvosilag felül Drugs.com. Utoljára frissítve: 2020. november 1.
- áttekintés
- mellékhatások
- adagolás
- szakmai
- interakciók
- több
AHFS Kategória: 36:84
Rx csak
Diagnosztikai Antigén
(Támogatás kimutatása fertőzés Mycobacterium tuberculosis)
AZ INTRADERMÁLIS HASZNÁLATA
Poliszorbát 80 Stabil Megoldás a Tuberkulin Tisztított Fehérje Származék a Tuberkulin Vizsgálat Emberben
Tubersol Leírás
Tubersol® Tuberkulin Tisztított Fehérje Származtatott (Mantoux) (PPD) (1) az intradermális tuberkulin vizsgálat készült a nagy Mester Tétel Connaught Tuberkulin (CT68) (2), valamint egy cell-mentes, tisztított fehérje frakció kapott egy emberi törzs, a Mycobacterium tuberculosis felnőtt egy proteinmentes szintetikus közeg és inaktivált. (2) Egyetlen tételből (CT68) származó szabványos készítmény alkalmazását fogadták el annak érdekében, hogy ugyanazon gyártó megszüntesse a tételenkénti eltéréseket. (2)
a Tubersol tiszta, színtelen folyadék.
| A Tubersol tartalmazza: | |
| M. tuberculosis tisztított fehérjeszármazéka | 5 tu / 0.1 mL |
| Polysorbate 80 | 0.0006% |
| Phenol | 0.22% to 0.35% w/v |
| in sterile isotonic phosphate buffered saline. | |
Before release, each successive lot is tested for potency in comparison with the US Standard Tuberculin PPD-S. (3)
az Egyesült Államok Népegészségügyi szolgálata által embereken végzett független vizsgálatok meghatározták a ct68 mennyiségét stabilizált oldatban, amely szükséges (4) (5) (6) a tuberkulin PPD-S (poliszorbát nélküli foszfátpufferben 80) bio-ekvivalenciájának előállításához, 5 amerikai egység (TU) tuberkulin PPD-s standardként.
Tubersol-Klinikai farmakológia
hatásmechanizmus
a mycobacteriumok fertőzését követő szenzibilizáció elsősorban a regionális nyirokcsomókban fordul elő. A kis limfociták (T-limfociták) az antigén stimulusra adott válaszként szaporodnak, hogy specifikusan érzékenyített limfocitákat hozzanak létre. 3-8 hét elteltével ezek a limfociták belépnek a véráramba, és évekig keringenek. (7) ezeknek a szenzibilizált limfocitáknak az azonos vagy hasonló antigénnel, például a Tubersol intradermális injekciójával történő későbbi restimulációja helyi reakciót vált ki, amelyet ezek a sejtek közvetítenek. (8)
jellemző, hogy a tuberkulinra adott késleltetett túlérzékenységi reakciók 5-6 óra múlva kezdődnek, a maximális hatás 48-72 óra, és néhány nap alatt elmúlnak. A kapott immunválasz a sejt beszivárgásából, esetenként vesikulációból és nekrózisból eredő indurációból áll. Klinikailag a tuberkulinnal szembeni késleltetett túlérzékenységi reakció az M tuberculosis vagy számos nem tuberkulózis baktérium korábbi fertőzésének megnyilvánulása. A legtöbb esetben a szenzibilizációt természetes Mycobacterium fertőzés vagy BCG vakcinával történő vakcinázás okozza.
A Tubersol
Tubersol Tuberculin tisztított Fehérjeszármazék (Mantoux) indikációi és alkalmazása a tuberkulózis fertőzés (TB) diagnosztizálásának elősegítésére javallott olyan személyeknél, akiknél fokozott az aktív betegség kialakulásának kockázata.
A Centers for disease Control and Prevention (CDC) közzétett információkról lakosságot, hogy előnyös lenne a tuberkulin testing (TST). A jelenlegi ajánlások a következő címen érhetők el: http://www.cdc.gov/tb/publications/factsheets/testing.htm.
a korábbi BCG vakcinázás nem ellenjavallat a tuberkulin teszteléshez. A BCG vakcinázott személyek bőrvizsgálati eredményei felhasználhatók a TB-fertőzés diagnózisának támogatására vagy kizárására. Az FDA által jóváhagyott interferon gamma-felszabadulási vizsgálat azonban előnyös a tuberkulin bőrteszttel szemben azoknál az 5 éves vagy annál idősebb személyeknél, akiket korábban BCG-vel vakcináztak. (9)
ellenjavallatok
allergia a Tubersol bármely összetevőjére, vagy anafilaxiás vagy más allergiás reakció a tuberkulin PPD korábbi tesztjére, ellenjavallt a Tubersol alkalmazására. (Lásd a leírást és a mellékelt leírást.)
Tubersol nem adható:
- a Személyek, akik egy súlyos reakció (pl., nekrózis, hólyagosodás, anafilaxiás sokk vagy fekélyek), hogy egy korábbi TST,
- Személyek dokumentált aktív tuberkulózis, vagy egy tiszta történelem kezelés a TBC-fertőzés vagy betegség, (10)
- Személyek kiterjedt égés vagy ekcéma.
Figyelmeztetések
Túlérzékenység
Allergiás reakciók fordulhatnak elő alábbi használata Tubersol még a személyek nem a kórtörténetében túlérzékenység a termék összetevői. (11) epinefrin injekció (1:1000) és az azonnali allergiás reakciók kezelésére használt egyéb megfelelő szereknek azonnal rendelkezésre kell állniuk.
Syncope
Syncope (ájulás) fordulhat elő injektálható gyógyszerek, köztük a Tubersol adagolásával összefüggésben. Eljárásokat kell alkalmazni a leeső sérülések elkerülése és az agyi perfúzió syncope utáni helyreállítása érdekében.
óvintézkedések
Általános
diagnosztikai korlátozások
hamis pozitív vagy hamis negatív tuberkulin bőrteszt reakciók fordulhatnak elő egyes személyeknél. (Lásd a vizsgálat értelmezését.)
hamis pozitív tuberkulinreakciós tesztek fordulnak elő más mycobacteriumokkal fertőzött személyeknél, beleértve a BCG-vel történő vakcinázást is.
nem minden fertőzött személy kap késleltetett túlérzékenységi reakciót egy tuberkulin tesztre.
számos tényezőről számoltak be, amelyek a tuberkulin tesztre való reagálás csökkent képességét okozták tuberkulózisos fertőzés jelenlétében. (Lásd a vizsgálat értelmezését.)
A Tubersol alkalmazása előtt a beteg aktuális egészségi állapotát és kórtörténetét felül kell vizsgálni. Az orvosnak felül kell vizsgálnia a beteg immunizációs előzményeit a Tubersol összetevőivel szembeni esetleges érzékenység érdekében.
az egészségügyi szolgáltatónak tájékoztatnia kell a beteget arról, hogy vissza kell térnie a vizsgálat olvasásához. A teszt önolvasása pontatlannak és megbízhatatlannak bizonyult.
az egészségügyi szolgáltatónak állandó személyes nyilvántartást kell adnia a betegnek. Ezenkívül elengedhetetlen, hogy az egészségügyi szakember rögzítse a vizsgálati előzményeket az egyes betegek állandó orvosi nyilvántartásában. Ennek az állandó irodai nyilvántartásnak tartalmaznia kell a termék nevét, a megadott dátumot, az adagot, a gyártót és a tételszámot, valamint a vizsgálati eredményt milliméterben (adott esetben 0 mm-rel). Az eredmények jelentése csak negatív vagy pozitív nem kielégítő.
Gyógyszerkölcsönhatások
a teszt reaktivitása kortikoszteroidokat vagy immunszuppresszív szereket kapó személyeknél depressziós lehet vagy elnyomható. (8)
egyes élő vírusvakcinák (kanyaró, mumpsz, rubeola, Oralis polio, sárgaláz és varicella) átmenetileg csökkenthetik a Tubersol reaktivitását. Ha a közelmúltban parenterális élő attenuált vírus vakcinát adtak be, a tuberkulinvizsgálatot el kell halasztani a >1 hónappal az oltás után. (8) (12) (lásd a vizsgálat értelmezését.)
Ha a tuberkulin szűrésre kanyaró tartalmú vakcinával vagy más parenterális élő, attenuált vírus vakcinával egyidejűleg van szükség, a Tubersol és a vakcina egyidejű alkalmazása külön helyeken az előnyben részesített lehetőség.
karcinogenezis, MUTAGENESIS, FERTILITÁSROMLÁS
a Tubersolt nem értékelték karcinogén vagy mutagén potenciáljának vagy a fertilitás károsodásának szempontjából.
terhesség
állatkísérleteket nem végeztek Tubersollal. Nem ismert, hogy a Tubersol magzati károsodást okozhat-e, ha terhes nőnek adják be, vagy befolyásolhatja a reprodukciós képességet. A Tubersol csak akkor adható terhes nőnek, ha egyértelműen szükséges.
szoptató anyák
nem ismert, hogy a Tubersol kiválasztódik-e az anyatejbe. Mivel sok gyógyszer kiválasztódik az anyatejbe, óvatosan kell eljárni, ha a Tubersolt szoptató nőnek adják be.
gyermekgyógyászati alkalmazás
nincs ellenjavallat a csecsemők tuberkulin bőrvizsgálatára. Az M. tuberkulózissal fertőzött, <6 hónapos csecsemők nem reagálhatnak a Tubersolra. (Lásd a vizsgálat értelmezését.)
máj -, epebetegségek
Klinikai vizsgálatok Tubersol nem tartalmaz elegendő számú alanyok 65 éven felüli meghatározni, hogy másként reagálnak a fiatalabb betegek.
mellékhatások
a Tubersol injekció beadásának helyén fellépő Induráció a pozitív bőrvizsgálat várható reakciója. (Lásd a vizsgálat értelmezését.)
a nemkívánatos eseményekre vonatkozó információkat a Tubersol-lal végzett korábbi klinikai vizsgálatokból és a forgalomba hozatalt követő tapasztalatokból állították össze.
általános tünetek, az alkalmazás helyén fellépő reakciók
fájdalom, viszketés és kellemetlen érzés az injekció beadásának helyén. Az injekció beadásának helyén fellépő erythema vagy bőrkiütés (induráció nélkül) a vizsgálatot követő 12 órán belül jelentkezik. Ezek a reakciók nem utalnak TB-fertőzésre. Vérzés az injekció beadásának helyén és hematoma az injekció beadását követő három napon belül. Az injekció beadásának helyén kialakuló hólyagok, az injekció beadásának helyén kialakuló fekély vagy az injekció beadásának helyén kialakuló nekrózis nagyon érzékeny személyeknél. Az injekció beadásának helyén erősen pozitív reakciók következtében fellépő heg. Láz
immunrendszeri betegségek
Túlérzékenység, beleértve az anafilaxia/anafilaxiás reakciók, angioödéma, csalánkiütés
Légúti, mellkasi gyakori
Stridor, nehézlégzés
izomrendszer
Kiütés, generalizált kiütés
Idegrendszeri betegségek
Presyncope, syncope (beleértve a syncope kapcsolódó tónusos-klónusos mozgása, valamint egyéb roham-mint tevékenység) néha, ami átmeneti eszméletvesztés sérülés
jelentése Mellékhatások
A jelentés FELTÉTELEZETT mellékhatásról, lépjen kapcsolatba a Farmakovigilancia Tanszék, Sanofi Pasteur Inc., Discovery Drive, Swiftwater, PA 18370 vagy hívja 1-800-822-2463 (1-800-vakcina) vagy Food and Drug Administration (FDA) MEDWATCH Program 1-800-332-1088 és www.fda.gov/medwatch.
Tubersol Adagolás és alkalmazás
adagolás
öt (5) tuberkulin egység (TU) tesztadagonként 0, 1 mL az intradermális (Mantoux) vizsgálat standard hatáserőssége.
az alkalmazás módja
a Tubersol csak intradermális injekcióra javallt. Ne adja be intravénásan, intramuszkulárisan vagy szubkután. Subcutan injekció beadása esetén a vizsgálat nem értelmezhető.
használat előtt ellenőrizze, hogy nem tartalmaz-e idegen részecskéket és/vagy elszíneződött-e. Ha ezek a feltételek fennállnak, ne alkalmazza a terméket.
minden injekcióhoz használjon külön fecskendőt és tűt. (13)
a Mantoux-teszt elvégzéséhez a következő eljárás ajánlott:
- a vizsgálat előnyös helye az alkar volar aspektusa. Kerülje a vörös vagy duzzadt bőrfelületeket. Kerülje a látható vénákat.
- tisztítsa meg a bőrfelületet megfelelő csíraölő szerrel, és hagyja megszáradni a helyet az antigén beadása előtt.
- adja be a Tubersol vizsgálati adagját (0, 1 mL) egy tizedbe kalibrált 1 mL-es fecskendővel, amelyet egy rövid, egynegyed-fél hüvelyk, 26 vagy 27 gauge tűvel láttak el.
- törölje le az injekciós üveg dugóját megfelelő csíraölő szerrel, és hagyja megszáradni a tű behelyezése előtt. Ezután óvatosan szúrja át a tűt a dugón, és szívjon fel 0,1 mL Tubersolt a fecskendőbe. Kerülje a felesleges levegő befecskendezését az egyes adagok eltávolításával, hogy ne nyomja túl az injekciós üveget, és esetleg szivárgást okozzon a lyukasztás helyén.
- helyezze a tű pontját a bőr felszínesebb rétegeibe úgy, hogy a tű ferdén felfelé mutasson, és lassú intradermális injekcióval adja be az adagot. Ha az intradermális injekciót megfelelően hajtják végre,a tű pontján egy határozott halvány bleb emelkedik, körülbelül 10 mm (3/8″) átmérőjű. Ez a bleb perceken belül eloszlik. Ne Öltöztesd fel az oldalt.
- az injekció beadásának helyén egy csepp vér jelenhet meg. A vér eltávolításához enyhén törölje le a helyet, de ne szorítsa ki az injektált tuberkulin tesztfolyadékot.
nem megfelelően elvégzett injekció (azaz nem alakult ki bleb) esetén azonnal ismételje meg a vizsgálatot egy másik helyen, legalább 2 hüvelyk távolságra az első helytől, és körözze meg a második beadási helyet, jelezve, hogy ez az olvasandó hely.
tájékoztassa a beteget arról, hogy egy képzett egészségügyi szakembernek vissza kell térnie a teszt olvasásához. Az önolvasás pontatlan lehet, és erősen elriasztja.
A vizsgálat értelmezése
a bőrvizsgálatot egy képzett egészségügyi szakembernek kell elolvasnia 48-72 órával a Tubersol beadása után. A bőrteszt érzékenységét csak induráció jelzi; a vörösséget nem szabad mérni.
mérje meg az induráció átmérőjét keresztirányban az alkar hosszú tengelyére, és rögzítse a mérést milliméterben (beleértve a 0 mm-t is). (8) a golyóstoll hegye, amelyet óvatosan 45° – os szögben az injekció beadásának helye felé tolnak, megáll az induráció szélén.
a nekrózis és az ödéma jelenlétét és méretét (ha jelen van) is rögzíti, bár ezeket nem használják a vizsgálat értelmezésében.
pozitív reakciók
a tuberkulin reaktivitás látens fertőzésre, korábbi M. tuberculosis fertőzésre és/vagy betegségre utalhat, és nem feltétlenül jelzi az aktív tuberkulózisos betegség jelenlétét. A pozitív tuberkulinreakciókat mutató személyeket a jelenlegi közegészségügyi iránymutatások pozitívnak kell tekinteni, és további orvosi értékelésre kell utalni. (8) (10) a nem fertőzött személyek ismételt vizsgálata nem érzékenyíti őket a Tubersolra. (7) (8) (10)
az indurációs mérések jelentőségét a latens TB-fertőzés diagnosztizálásában figyelembe kell venni a beteg kórtörténetében és az aktív tbc-betegség kialakulásának kockázatával kapcsolatban, az 1.táblázat szerint. (10)
| Reakció ≥5 mm Induratio | Reakció ≥10 mm Induratio | Reakció ≥15 mm Induratio |
|---|---|---|
| * fennáll a TB-val kezelt betegeknél kortikoszteroidok növeli a nagyobb adagot, továbbá hosszabb ideig. † Azoknál a személyeknél, akik egyébként alacsony kockázatnak vannak kitéve, és a foglalkoztatás kezdetén tesztelik őket, a ≥15 mm-es indurációs reakció pozitívnak tekinthető. | ||
| HIV-pozitív személyek Utolsó kapcsolatok a tuberkulózis (TBC) esetében a betegek Fibrotikus változások, a mellkasi röntgenfelvétel összhangban előtt a TB Betegek szervátültetés, illetve egyéb immunszupprimált betegek (fogadó egyenértékű, legalább 15 mg/nap, a prednizon 1 hónap vagy több)* |
Utolsó bevándorlók (azaz, az elmúlt 5 év) a magas előfordulási országok Injekciós kábítószer-használók a Lakók vagy dolgozók† a következő magas kockázatú összejön beállítások: börtönök és börtönök, Idősek otthona és egyéb hosszú távú létesítmények idősek, kórházak és egyéb egészségügyi létesítmények, bentlakásos létesítmények szerzett immunhiányos szindrómában (AIDS) szenvedő betegek és hajléktalanszállók számára Mycobacteriology laboratóriumi személyzet olyan személyek, akiknél a következő klinikai állapotok veszélyeztetik őket: szilikózis, diabetes mellitus, krónikus veseelégtelenség, egyes hematológiai rendellenességek (pl. leukémia és Lymphoma), egyéb specifikus rosszindulatú daganatok (pl., carcinoma a fej vagy a nyak -, tüdő), a fogyás, a legalább 10% – a, ideális testsúly, gasztrektómia, valamint jejunoileal bypass fiatalabb Gyermekeknek 4 éves korban, vagy a csecsemők, gyermekek, pedig a serdülők kitéve a felnőttek magas kockázatú |
Személyek nem kockázati tényezők a TB |
A TST átalakítás meghatározott növekedése a legalább 10 mm induratio belül a 2 éves időszak, kortól függetlenül. (10)
figyelembe kell venni annak lehetőségét, hogy a bőrteszt érzékenysége az atípusos mycobacteriumokkal való korábbi érintkezés vagy a korábbi BCG vakcinázás miatt is fennállhat. (8) (10)
negatív reakciók
az a személy, aki az első vizsgálat során nem mutatott pozitív reakciót az 5 TU-ra, de gyanítható, hogy TB-pozitív, 5 TU-val megismételhető. (Lásd Booster Effect és kétlépcsős tesztelés.) Minden olyan személy, aki nem mutat pozitív reakciót az 5 TU kezdeti injekciójára, vagy egy második, 5 TU-val végzett vizsgálat tuberkulin negatívnak tekinthető.
hamis pozitív reakciók
hamis pozitív tuberkulin reakciók fordulhatnak elő más mycobacteriumokkal fertőzött személyeknél, beleértve a BCG-vel történő vakcinázást is. (8) az M. tuberculosis fertőzés diagnózisát és a megelőző terápia alkalmazását azonban minden olyan BCG-vel oltott személy esetében figyelembe kell venni, aki pozitív TST-reakcióval rendelkezik, különösen akkor, ha a személy fokozott kockázatot jelent a TB-fertőzés megszerzésére. (Lásd jelzések és használat.) (14) (15)
hamis negatív reakciók
nem minden fertőzött személy kap késleltetett túlérzékenységi reakciót tuberkulin tesztre.
idős vagy első alkalommal vizsgált betegeknél a reakciók lassan alakulhatnak ki, és csak 72 óra elteltével alakulhatnak ki.
mivel a tuberkulin-érzékenység az M. tuberculosis-expozíciót követően akár 8 hétig is eltarthat (lásd hatásmechanizmus), a <a lehetséges TB-expozíciót követő 8.hetet követően az utolsó ismert vagy feltételezett expozíciót követően ≥8-10 héttel újra kell vizsgálni. (16)
megváltozott immunállapot
károsodott vagy attenuált sejtmediált immunitás (CMI) hamis negatív tuberkulin reakciót okozhat. Számos tényező számoltak be, hogy csökkent képessége a tuberkulin próba jelenlétében gümőkóros fertőzés, beleértve a vírusos fertőzések (pl. morbilli, mumpsz, bárányhimlő, illetve HIV), élő vírust oltások (pl., kanyaró, mumpsz, rubeola, orális gyermekbénulás és sárgaláz), elsöprő tuberkulózis, egyéb bakteriális fertőzések, leukémia, sarcoidosis, gombás fertőzések, metabolikus rendellenességek, alacsony fehérjetartalmú állapotok, a nyirokszerveket érintő betegségek, gyógyszerek (kortikoszteroidok és sok más immunszuppresszív szer), valamint rosszindulatú vagy stressz. (8) (17) (18) a TST-t el kell halasztani az elmúlt hónapban súlyos vírusfertőzésben vagy élő vírus elleni védőoltásban szenvedő betegek esetében. A közönséges hidegben szenvedő személyek tuberkulin tesztelhetők.
mivel a TST eredménye a HIV-fertőzött egyéneknél kevésbé megbízható, mivel a CD4-szám csökken, a szűrést a HIV-fertőzés bekövetkezése után a lehető leghamarabb be kell fejezni. (18)
emlékeztető hatás és kétlépcsős vizsgálat
Ha a tuberkulinvizsgálatot rendszeres időközönként végzik el, például az egészségügyi dolgozók vagy a börtönmunkások körében, kétlépcsős vizsgálatot kell végezni kiindulásként annak elkerülése érdekében, hogy az emlékeztető hatást tuberkulin-átalakításként értelmezzék. Ha az első vizsgálat nem mutatott reakciót vagy kis reakciót, akkor a második vizsgálatot egy-négy héttel később kell elvégezni. Mindkét vizsgálatot 48-72 órán át kell olvasni és rögzíteni. Azoknál a betegeknél, akiknél a tuberkulinpróba (emlékeztető) ≥10 mm-es válaszreakciója volt, úgy kell tekinteni, hogy korábban TB-fertőzést tapasztaltak. (14) (19)
azokat a személyeket, akik egy héten belül ismételt vizsgálatok során nem fokozódnak, de akiknek a tuberkulinreakciója egy év után pozitívra változik, újonnan szerzett tuberkulózisfertőzésnek kell tekinteni, és ennek megfelelően kezelik őket. (7)
hogyan kerül forgalomba a Tubersol
Tubersol tuberkulin tisztított Fehérjeszármazék (Mantoux), bioekvivalens 5 US egységre (TU) PPD-s vizsgálati dózisonként (0.1 mL) a következő injekciós üvegben kerül forgalomba:
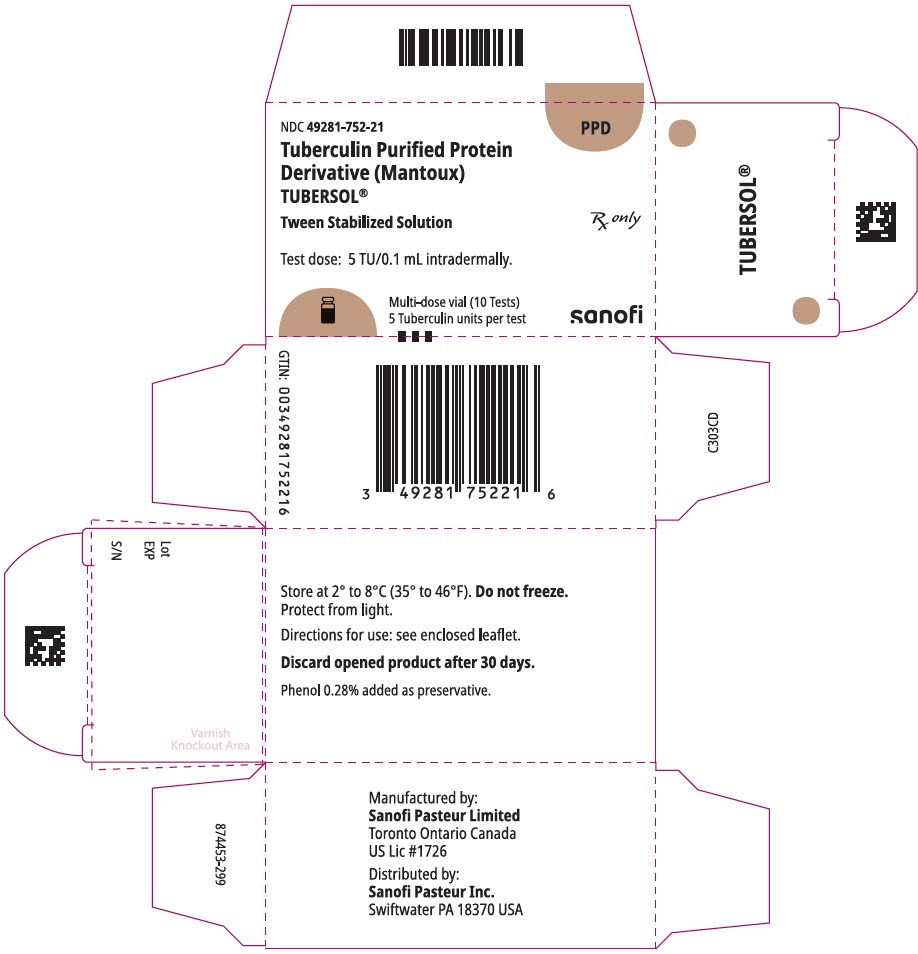
1 mL többadagos injekciós üveg (10 vizsgálat). NDC no. 49281-752-78; csomag 1 injekciós üveg, NDC no. 49281-752-21
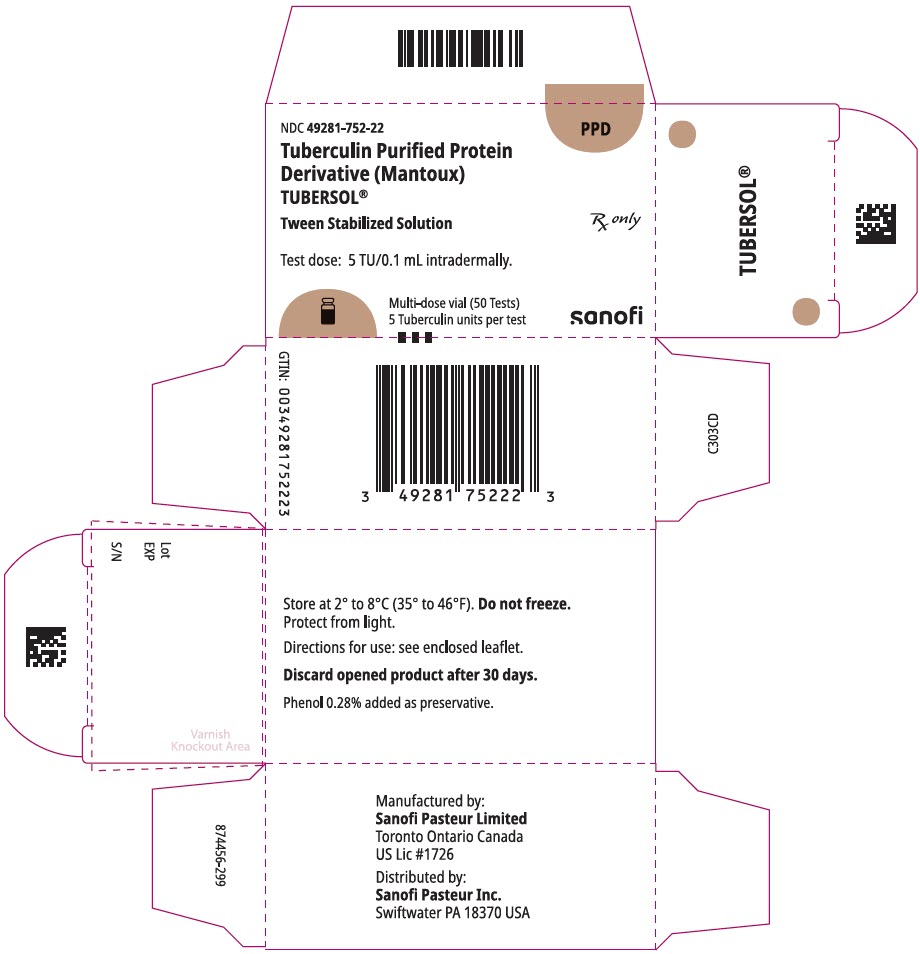
5 mL többadagos injekciós üveg (50 teszt). NDC no. 49281-752-98; csomag 1 injekciós üveg, NDC no. 49281-752-22
az injekciós üveg dugója ehhez a termékhez nem tartalmaz természetes latex gumit.
Tárolás
tárolandó 2° – tól 8°C-ig (35° – tól 46°F-ig). (20) nem fagyasztható. Ha fagyasztásnak van kitéve, dobja ki a terméket.
védje a fényt. A tuberkulin PPD oldatokat hátrányosan befolyásolhatja a fénynek való kitettség. A készítményt sötétben kell tárolni, kivéve, ha az adagokat ténylegesen kivonják az injekciós üvegből. (21)
a Tubersol 30 napig bevitt és használatban lévő injekciós üveget meg kell semmisíteni. (22)
ne használja a lejárati idő után.
1 Landi S. készítmény, tisztítás és stabilitása tuberkulin. Appl 1963;11: 408-412. 2 Landi S, et al. Nagy mennyiségű tuberkulin tisztított fehérjeszármazék (PPD-CT68) előkészítése és jellemzése. Ann Scalvo.1980;22:889-907. 3 us Code of Federal Regulations, Title 21, Part 610, alrész C-Standard preparations and limits of potencia. 4 Landi S, et al. A tuberkulin PPD üveg-és műanyag felületekre történő adszorpciója. Bika. Ki 1966;35:593-602. 5 Landi S, et al. A stabilizált és nem stabilizált híg tuberkulin oldatok közötti hatásosság különbsége. Am Rev Respir Dis 1971; 104: 385-393. 6 Landi S, et al. A tuberkulin tisztított fehérjeszármazék hígított oldatainak stabilitása. 1978;59:121-133. 7 Menzies D. ismételt tuberkulin tesztek értelmezése. Am J Respir Crit Care Med 1999;159: 15-21. 8 American Thoracic Society: Diagnostic standards and classification of tuberculosis in adults and children. Am J Respir Crit Care Med 2000;161: 1376-1395. 9 CDC. Frissített iránymutatások a Mycobacterium tuberculosis fertőzés kimutatására szolgáló Interferon Gamma-felszabadulási vizsgálatok alkalmazására – Egyesült Államok, 2010. MMWR 2010; 59 (RR-5): 1-25. 10 CDC. Célzott tuberkulinvizsgálat és látens tuberkulózis fertőzés kezelése. MMWR 2000;49 (RR-6): 23-5. 11 Froeschle JE, et al. Azonnali túlérzékenységi reakciók a tuberkulin bőrvizsgálata után. Clinic 2002; 34: e12-13. 12 Brickman HF, et al. A tuberkulin tesztek időzítése az élő vírus vakcinákkal történő immunizálással kapcsolatban. Gyermekgyógyászat: 1975; 55: 392-396. 13 CDC. Az immunizálásra vonatkozó általános ajánlások: az Immunizációs gyakorlatok Tanácsadó Bizottságának (ACIP) és az amerikai Családorvosok Akadémiájának (AAFP) ajánlásai. MMWR 2002; 51 (RR-2): 1-36. 14 CDC. Iránymutatások a Mycobacterium tuberculosis átvitelének megelőzésére az egészségügyi ellátásban, 2005. MMWR 2005;54 (RR-17): 1-141. 15 CDC. A BCG vakcina szerepe az Egyesült Államokban a tuberkulózis megelőzésében és szabályozásában. A tuberkulózis megszüntetésével foglalkozó tanácsadó testület és az immunizálási gyakorlatokkal foglalkozó tanácsadó bizottság együttes nyilatkozata. MMWR 1996; 45 (RR-4): 1-18. 16 CDC. A fertőző tuberkulózisban szenvedő személyek kapcsolatainak vizsgálatára vonatkozó iránymutatások: a Nemzeti Tuberkulóziskezelők Szövetsége és a CDC ajánlásai. MMWR 2005;54 (RR-15): 1-37. 17 Mori és Shiozawa. A rubeola fertőzés által okozott tuberkulin túlérzékenység elnyomása. Am Rev Respir Dis 1985; 886-888. 18 CDC. Iránymutatások az opportunista fertőzések megelőzésére és kezelésére HIV-fertőzött felnőtteknél és serdülőknél. Ajánlások a CDC, a National Institutes of Health, valamint a HIV Medicine Association of Infectious Diseases Society of America. MMWR 2009; 58 (RR-4): 1-207. 19 CDC. A tuberkulózis megelőzése és ellenőrzése a büntetés-végrehajtási intézményekben: a CDC ajánlásai. MMWR 2006;55 (RR-9): 1-44. 20 Landi S, et al. A tuberkulin tisztított fehérjeszármazék hígított oldatának stabilitása szélsőséges hőmérsékleten. J Biol Stand 1981; 9: 195-199. 21 Landi S, et al. A fény hatása a tuberkulin tisztított fehérje-származékos oldatokra. Am Rev Respir Dis 1975;111:52-61. 22 Landi S, et al. Az oxidáció hatása a tuberkulin tisztított fehérjeszármazék (PPD) stabilitására in: International Symposium on Tuberculins and BCG Vaccine. Basel: International Association of Biological Standardization, 1983. Dev Biol Stand 1986;58: 545-552.
gyártó:
Sanofi Pasteur Limited
Toronto Ontario Canada
forgalmazó:
Sanofi Pasteur Inc.
Swiftwater PA 18370 USA
termékinformációk a
November 2020
fő kijelző PANEL – 1 mL injekciós üveg címke
tuberkulin tisztított
Fehérjeszármazék
(Mantoux)
Tubersol®
többadagos injekciós üveg
1 mL (10 teszt)
vizsgálati adag: 5 TU / 0, 1 mL ID.
védje a fényt.
A megnyitott
terméket 30 nap elteltével dobja ki.
csak RX
Sanofi Pasteur Limited
megnyitott Dátum

fő kijelzőpanel – 1 mL injekciós üveg doboz
NDC 49281-752-21
PPD
tuberkulin tisztított fehérje
származék (Mantoux)
tubersol®
tween stabilizált oldat
többadagos injekciós üveg 10 teszt 5 tu
csak RX
vizsgálati adag: 5 tu/0, 1 ml intradermálisan.
Bio-egyenértékű 5 US egység (TU) PPD-S
SANOFI PASTEUR
fő kijelzőpanel – 5 mL injekciós üveg címke
tuberkulin tisztított fehérje
származék (Mantoux)
Tubersol®
többadagos injekciós üveg
5 mL (50 teszt)
vizsgálati adag: 5 tu/0, 1 ml ID.
csak RX
védje a fénytől.
30 nap elteltével dobja ki a megnyitott terméket.
Sanofi Pasteur Limited
megnyitott Dátum

fő kijelzőpanel – 5 mL injekciós üveg doboz
NDC 49281-752-22
PPD
tuberkulin tisztított fehérje
származék (Mantoux)
Tubersol®
tween stabilizált oldat
többadagos injekciós üveg 50 teszt 5 tu
csak RX
vizsgálati adag: 5 tu/0, 1 ml intradermálisan.
Bio-equivalent to 5 US units (TU) of PPD-S
SANOFI PASTEUR
| Tubersol tuberculin purified protein derivative injection, solution |
|||||||||||||||||||
|
|||||||||||||||||||
|
|||||||||||||||||||
|
|||||||||||||||||||
|
|||||||||||||||||||
|
|||||||||||||||||||
|
|||||||||||||||||||
Labeler – Sanofi Pasteur Inc. (086723285)
| Establishment | |||
| Name | Address | ID/FEI | Operations |
| Sanofi Pasteur Limited | 208206623 | MANUFACTURE(49281-752) | |
További információk a Tubersol (tuberkulin tisztított fehérje-származék)
- Mellékhatások
- a Szoptatás
- Adagolási Információ
- Gyógyszerkölcsönhatások
- Árképzési & Kuponok
- a Kábítószer-osztály: in vivo diagnosztikai biologicals
a Fogyasztói források
- Speciális Olvasási
Szakmai források
- Felírása Információk
Egyéb márkák Aplisol
Kapcsolódó kezelési útmutatók
- Diagnózis Vizsgálat
Orvosi Nyilatkozat