generisk navn: tuberculin oprenset proteinderivat
doseringsform: injektion, opløsning
medicinsk gennemgået af Drugs.com. sidst opdateret den 1. November 2020.
- oversigt
- bivirkninger
- dosering
- professionel
- interaktioner
- mere
AHFS Kategori: 36:84
kun
diagnostisk Antigen
(hjælp til påvisning af infektion med Mycobacterium tuberculosis)
til INTRADERMAL anvendelse
polysorbat 80 stabiliseret opløsning af Tuberculin oprenset Proteinderivat til tuberkulintest hos mennesker
Tubersol beskrivelse
Tubersol tuberkulinprøvning fremstilles ud fra et stort masterbatch Connaught tuberculin (ct68) (2) og er en cellefri oprenset proteinfraktion opnået fra en human stamme af Mycobacterium tuberculosis dyrket på en proteinfrit syntetisk medium og inaktiveret. (2) anvendelse af et standardpræparat afledt af et enkelt parti (CT68) er blevet vedtaget for at eliminere variation fra batch til batch af den samme fabrikant. (2)
Tubersol er en klar, farveløs væske.
| Tubersol indeholder: | |
| oprenset proteinderivat af M. tuberkulose | 5 tu per 0.1 mL |
| Polysorbate 80 | 0.0006% |
| Phenol | 0.22% to 0.35% w/v |
| in sterile isotonic phosphate buffered saline. | |
Before release, each successive lot is tested for potency in comparison with the US Standard Tuberculin PPD-S. (3)
uafhængige undersøgelser foretaget af US Public Health Service hos mennesker har bestemt mængden af CT68 i stabiliseret opløsning nødvendig (4) (5) (6) for at producere bioækvivalens med Tuberculin PPD-s (i fosfatbuffer uden polysorbat 80) ved hjælp af 5 amerikanske enheder (TU) Tuberculin PPD-s som standard.
Tubersol – Klinisk Farmakologi
virkningsmekanisme
sensibiliseringen efter infektion med mykobakterier forekommer primært i de regionale lymfeknuder. Små lymfocytter (T-lymfocytter) prolifererer som reaktion på den antigene stimulus for at give anledning til specifikt sensibiliserede lymfocytter. Efter 3-8 uger kommer disse lymfocytter ind i blodstrømmen og cirkulerer i årevis. (7) efterfølgende restimulering af disse sensibiliserede lymfocytter med det samme eller et lignende antigen, såsom den intradermale injektion af Tubersol, fremkalder en lokal reaktion medieret af disse celler. (8)
karakteristisk begynder forsinkede overfølsomhedsreaktioner over for tuberkulin efter 5 til 6 timer, er maksimale efter 48 Til 72 timer og aftager over en periode på dage. Det resulterende immunrespons består af induration på grund af celleinfiltration og lejlighedsvis vesikulation og nekrose. Klinisk er en forsinket overfølsomhedsreaktion over for tuberkulin en manifestation af tidligere infektion med M tuberculosis eller en række ikke-tuberkulosebakterier. I de fleste tilfælde induceres sensibilisering ved naturlig mycobakteriel infektion eller ved vaccination med BCG-Vaccine.
indikationer og anvendelse for Tubersol
Tubersol Tuberculin oprenset Proteinderivat, er indiceret til at hjælpe diagnose af tuberkulose infektion (TB) hos personer med øget risiko for at udvikle aktiv sygdom.centrene for sygdomsbekæmpelse og Forebyggelse (CDC) har offentliggjort retningslinjer for populationer, der ville have gavn af tuberkulin hudtest (TST). Aktuelle anbefalinger kan fås på: http://www.cdc.gov/tb/publications/factsheets/testing.htm.
tidligere BCG-vaccination er ikke kontraindikation for tuberkulinprøvning. HUDTESTRESULTATERNE fra BCG-vaccinerede personer kan bruges til at understøtte eller udelukke diagnosen TB-infektion. Imidlertid foretrækkes en FDA-godkendt interferon gamma release assay frem for tuberkulin hudtest for personer 5 år og ældre, der tidligere var vaccineret med BCG. (9)
kontraindikationer
allergi over for enhver komponent i Tubersol eller en anafylaktisk eller anden allergisk reaktion på en tidligere test af tuberculin PPD er en kontraindikation for brugen af Tubersol. (Se beskrivelse og hvordan leveret.)
Tubersol bør ikke administreres til:
- personer, der har haft en alvorlig reaktion (f.eks. nekrose, blærer, anafylaktisk chok eller ulcerationer) på en tidligere TST,
- personer med dokumenteret aktiv tuberkulose eller en klar historie med behandling for TB-infektion eller sygdom, (10)
- personer med omfattende forbrændinger eller eksem.
advarsler
overfølsomhed
allergiske reaktioner kan forekomme efter brug af Tubersol selv hos personer uden tidligere overfølsomhed over for produktkomponenterne. (11) epinephrin injektion (1:1.000) og andre egnede midler, der anvendes til bekæmpelse af øjeblikkelige allergiske reaktioner, skal være umiddelbart tilgængelige.
synkope
synkope (besvimelse) kan forekomme i forbindelse med administration af injicerbare lægemidler, herunder Tubersol. Procedurer bør være på plads for at undgå faldende skade og for at genoprette cerebral perfusion efter synkope.
forholdsregler
generelle
diagnostiske begrænsninger
falske positive eller falske negative tuberkulinhudtestreaktioner kan forekomme hos nogle individer. (Se fortolkning af testen .)
falske positive tuberkulinreaktionstest forekommer hos personer, der er blevet inficeret med andre mykobakterier, herunder vaccination med BCG.
ikke alle inficerede personer vil have en forsinket overfølsomhedsreaktion på en tuberkulinprøve.
mange faktorer er rapporteret at forårsage en nedsat evne til at reagere på tuberkulinprøven i nærvær af tuberkuløs infektion. (Se fortolkning af testen .)
Information til patienter
før administration af Tubersol skal patientens aktuelle sundhedsstatus og medicinske historie gennemgås. Lægen bør gennemgå patientens immuniseringshistorie for mulig følsomhed over for komponenter i Tubersol.
sundhedsudbyderen skal informere patienten om behovet for at vende tilbage til læsning af testen. Selvlæsning af testen har vist sig at være unøjagtig og upålidelig.
sundhedsudbyderen skal give patienten en permanent personlig registrering. Derudover er det vigtigt, at sundhedspersonalet registrerer testhistorikken i den permanente medicinske journal for hver patient. Denne permanente kontorpost skal indeholde navnet på produktet, den angivne dato, dosis, producent og lotnummer samt testresultatet i millimeter induration (inklusive 0 mm, hvis det er relevant). Rapportering af resultater Kun som negativ eller positiv er ikke tilfredsstillende.
lægemiddelinteraktioner
reaktivitet over for testen kan være deprimeret eller undertrykt hos personer, der får kortikosteroider eller immunsuppressive midler. (8)
reaktivitet over for Tubersol kan være midlertidigt deprimeret af visse levende virusvacciner (mæslinger, fåresyge, røde hunde, oral polio, gul feber og varicella). Hvis en parenteral levende svækket virusvaccine er blevet administreret for nylig, bør tuberkulinprøvning udsættes for >1 måned efter vaccination. (8) (12) (Se fortolkning af prøven.)
Når tuberkulinscreening er påkrævet samtidig med en mæslingsholdig vaccine eller anden parenteral levende svækket virusvaccine, er samtidig administration af Tubersol og vaccinen på separate steder den foretrukne mulighed.
carcinogenese, mutagenese, nedsat fertilitet
Tubersol er ikke blevet evalueret for dets carcinogene eller mutagene potentialer eller nedsat fertilitet.
graviditet
reproduktionsstudier af dyr er ikke udført med Tubersol. Det vides heller ikke, om Tubersol kan forårsage fosterskader, når det administreres til en gravid kvinde eller kan påvirke reproduktionskapaciteten. Tubersol bør kun gives til en gravid kvinde, hvis det er klart nødvendigt.
ammende mødre
Det vides ikke, om Tubersol udskilles i modermælk. Da mange lægemidler udskilles i modermælk, skal der udvises forsigtighed, når Tubersol administreres til en ammende kvinde.
pædiatrisk brug
der er ingen kontraindikation for tuberkulinhudtest af spædbørn. Spædbørn <6 måneder, der er inficeret med M. tuberculosis, reagerer muligvis ikke på Tubersol. (Se fortolkning af testen .)
geriatrisk anvendelse
kliniske studier af Tubersol omfattede ikke tilstrækkeligt antal forsøgspersoner i alderen 65 år og derover til at afgøre, om de reagerer forskelligt fra yngre forsøgspersoner.
bivirkninger
Induration på Tubersol injektionsstedet er den forventede reaktion for en positiv hudtest. (Se fortolkning af testen .)
oplysningerne vedrørende bivirkninger er indsamlet fra historiske kliniske studier og erfaring efter markedsføring med Tubersol.
Almene symptomer og reaktioner på administrationsstedet
smerter på injektionsstedet, kløe på injektionsstedet og ubehag på injektionsstedet. Erytem på injektionsstedet eller udslæt på injektionsstedet (uden induration) forekommer inden for 12 timer efter testning. Disse reaktioner indikerer ikke TB-infektion. Blødning på injektionsstedet og hæmatom på injektionsstedet op til tre dage efter indgivelsen af testen. Vesikler på injektionsstedet, sår på injektionsstedet eller nekrose på injektionsstedet hos meget følsomme personer. Ar på injektionsstedet som et resultat af stærkt positive reaktioner. Pyreksi
immunsystemet
overfølsomhed, herunder anafylaksi/anafylaktiske reaktioner, angioødem, urticaria
respiratoriske, thorakale og mediastinale lidelser
Stridor, dyspnø
hud og subkutane væv
udslæt, generaliseret udslæt
nervesystemet
Presyncope, synkope (inklusive synkope forbundet med tonisk-kloniske bevægelser og anden anfaldslignende aktivitet), der undertiden resulterer i forbigående bevidsthedstab med skade
rapportering af bivirkninger
kontakt lægemiddelovervågningen for at rapportere formodede bivirkninger Afdeling, Sanofi Pasteur Inc. 18370 eller ring 1-800-822-2463 (1-800-VACCINE) eller Food and Drug Administration (FDA) MEDUR Program på 1-800-332-1088 og www.fda.gov/medwatch.
Tubersol Dosering og Administration
dosering
fem (5) tuberkulinenheder (TU) pr.
indgivelsesmåde
Tubersol er kun indiceret til intradermal injektion. Injicer ikke intravenøst, intramuskulært eller subkutant. Hvis subkutan injektion forekommer, kan testen ikke fortolkes.
Undersøg for fremmede partikler og / eller misfarvning før brug. Hvis disse betingelser eksisterer, må du ikke administrere produktet.
brug en separat sprøjte og kanyle til hver injektion. (13)
følgende procedure anbefales til udførelse af Mantu-testen:
- det foretrukne sted for testen er det Volare aspekt af underarmen. Undgå områder på huden, der er røde eller hævede. Undgå synlige vener.
- rengør hudstedet med et egnet bakteriedræbende middel, og lad stedet tørre inden injektion af antigenet.
- Administrer testdosis (0, 1 mL) Tubersol med en 1 mL sprøjte kalibreret i tiendedele og udstyret med en kort, en fjerdedel til en halv tomme, 26 eller 27 gauge nål.
- tør hætteglassets prop af med et egnet bakteriedræbende middel, og lad det tørre, før nålen indsættes. Indsæt derefter nålen forsigtigt gennem proppen og træk 0,1 mL Tubersol ind i sprøjten. Undgå injektion af overskydende luft ved fjernelse af hver dosis for ikke at overtrykke hætteglasset og muligvis forårsage udsivning på punkteringsstedet.
- Indsæt nålens punkt i de mest overfladiske lag af huden med nålefasningen pegende opad og indgiv dosis ved langsom intradermal injektion. Hvis den intradermale injektion udføres korrekt, vil en bestemt bleg bleb stige ved nålepunktet, omkring 10 mm (3/8″) i diameter. Denne bleb spredes inden for få minutter. Klæd ikke stedet.
- der kan forekomme en dråbe blod på indgivelsesstedet efter injektion. Blot stedet let for at fjerne blodet, men undgå at klemme ud den injicerede tuberkulinprøvevæske.
i tilfælde af en ukorrekt udført injektion (dvs.ingen bleb dannet), gentag testen straks på et andet sted, mindst 2 inches fra det første sted og cirkel det andet injektionssted som en indikation af, at dette er det sted, der skal læses.
Informer patienten om behovet for at vende tilbage til læsning af testen af en uddannet sundhedsperson. Selvlæsning kan være unøjagtig og frarådes kraftigt.
fortolkning af testen
hudtesten skal læses af en uddannet sundhedsperson 48 Til 72 timer efter administration af Tubersol. Hudtestfølsomhed er kun indikeret ved induration; rødme bør ikke måles.
mål indurationens diameter på tværs af underarmens lange akse og registrer målingen i millimeter (inklusive 0 mm). (8) spidsen af en kuglepen, der forsigtigt skubbes i en vinkel på 45 liter mod injektionsstedet, stopper ved kanten af induration.
registrerer også tilstedeværelse og størrelse (hvis til stede) af nekrose og ødem, selvom disse ikke anvendes i fortolkningen af testen.
Positive reaktioner
Tuberkulinreaktivitet kan indikere latent infektion, tidligere infektion og / eller sygdom med M. tuberculosis og indikerer ikke nødvendigvis tilstedeværelsen af aktiv tuberkuløs sygdom. Personer, der viser positive tuberkulinreaktioner, bør betragtes som positive i henhold til gældende retningslinjer for Folkesundhed og henvises til yderligere medicinsk evaluering. (8) (10) gentagen testning af uinficerede personer sensibiliserer dem ikke for Tubersol. (7) (8) (10)
betydningen af indurationsmålinger ved diagnosticering af latent TB-infektion skal overvejes med hensyn til patientens historie og risikoen for at udvikle aktiv TB-sygdom som angivet i tabel 1. (10)
| reaktion 5 mm Induration | reaktion 10 mm Induration | reaktion på 15 mm induration |
|---|---|---|
| * risiko for TB hos patienter behandlet med kortikosteroider øges med højere dosis og længere varighed. For personer, der ellers har lav risiko og testes i starten af ansættelsen, betragtes en reaktion på 15 mm induration som positiv. | ||
| HIV-positive personer nylige kontakter af tuberkulose (TB) tilfælde patienter fibrotiske ændringer på brystet røntgenbillede i overensstemmelse med tidligere TB patienter med organtransplantationer og andre immunsupprimerede patienter (modtager ækvivalenten med 15 mg/d prednison i 1 måned eller mere)* |
nylige indvandrere (dvs. inden for de sidste 5 år) fra lande med høj prævalens injektionsmisbrugere beboere eller ansatte i de følgende højrisikosamlingsindstillinger: fængsler og fængsler, plejehjem og andre langtidsfaciliteter for ældre, hospitaler og andre sundhedsfaciliteter, boligfaciliteter til patienter med erhvervet immundefektsyndrom (AIDS) og hjemløse krisecentre Mycobacteriology laboratory personale personer med følgende kliniske tilstande, der sætter dem i høj risiko: silikose, diabetes mellitus, kronisk nyresvigt, nogle hæmatologiske lidelser (f. eks. leukæmier og lymfomer), andre specifikke maligniteter (f. eks. 10% af den ideelle kropsvægt, gastrektomi og jejunoileal bypass børn yngre end 4 år eller spædbørn, børn og unge udsat for voksne med høj risiko |
personer uden risikofaktorer for TB |
en TST-konvertering defineres som en stigning på 10 mm induration inden for en 2-årig periode, uanset alder. (10)
muligheden bør overvejes, at hudtestfølsomheden også kan skyldes en tidligere kontakt med atypiske mykobakterier eller tidligere BCG-vaccination. (8) (10)
Negative reaktioner
en person, der ikke viser en positiv reaktion på 5 TU ved den første test, men mistænkes for at være TB-positiv, kan testes igen med 5 TU. (Se Booster effekt og to-trins test.) Enhver person, der ikke viser en positiv reaktion på en indledende injektion af 5 TU eller en anden test med 5 TU, kan betragtes som tuberkulinnegativ.
falske positive reaktioner
falske positive tuberkulinreaktioner kan forekomme hos personer, der er blevet inficeret med andre mykobakterier, herunder vaccination med BCG. (8) en diagnose af M. tuberculosis-infektion og brugen af forebyggende terapi bør dog overvejes for enhver BCG-vaccineret person, der har en positiv TST-reaktion, især hvis personen har været eller har øget risiko for at få TB-infektion. (Se indikationer og anvendelse.) (14) (15)
falske Negative reaktioner
ikke alle inficerede personer vil have en forsinket overfølsomhedsreaktion over for en tuberkulinprøve.
hos dem, der er ældre eller dem, der testes for første gang, kan reaktionerne udvikle sig langsomt og måske ikke toppe før efter 72 timer.
da tuberkulinfølsomhed kan tage op til 8 uger at udvikle sig efter eksponering for M. tuberculosis (se virkningsmekanisme), skal personer, der har en negativ tuberkulinprøve < 8 uger efter mulig TB-eksponering, testes igen 8-10 uger efter den sidst kendte eller mistænkte eksponering. (16)
ændret immunstatus
nedsat eller svækket cellemedieret immunitet (CMI) kan potentielt forårsage en falsk negativ tuberkulinreaktion. Mange faktorer er rapporteret at forårsage en nedsat evne til at reagere på tuberkulinprøven i nærvær af tuberkuløs infektion inklusive virusinfektioner (f. eks. mæslinger, fåresyge, skoldkopper og HIV), levende virusvaccinationer (f. eks. oral polio og gul feber), overvældende tuberkulose, andre bakterielle infektioner, leukæmi, sarkoidose, svampeinfektioner, metaboliske derangements, lavproteintilstande, sygdomme, der påvirker lymfoide organer, lægemidler (kortikosteroider og mange andre immunsuppressive midler) og malignitet eller stress. (8) (17) (18) en TST bør udsættes for patienter med større virusinfektioner eller levende virusvaccination i den sidste måned. Personer med forkølelse kan testes for tuberkulin.
da TST resulterer i HIV-inficerede individer er mindre pålidelige, da CD4-tællingerne falder, bør screening afsluttes så tidligt som muligt efter HIV-infektion opstår. (18)
Boostereffekt og Totrinstest
Hvis tuberkulinprøvning udføres med regelmæssige intervaller, f.eks. blandt sundhedspersonale eller fængselsarbejdere, bør totrinstest udføres som en basislinje for at undgå at fortolke en boostereffekt som en tuberkulinkonvertering. Hvis den første test enten ikke viste nogen reaktion eller en lille reaktion, skal den anden test udføres en til fire uger senere. Begge test skal læses og registreres efter 48 Til 72 timer. Patienter med en anden tuberkulinprøve (booster) respons på 10 mm skal anses for at have oplevet tidligere TB-infektion. (14) (19)
personer, der ikke stiger, når de får gentagne tests efter en uge, men hvis tuberkulinreaktioner ændres til positive efter et år, bør anses for at have nyerhvervet tuberkuloseinfektion og håndteres i overensstemmelse hermed. (7)
hvordan leveres Tubersol
Tubersol Tuberculin oprenset Proteinderivat, bioækvivalent til 5 us-enheder (tu) PPD-s pr.testdosis (0.1 mL) leveres i:
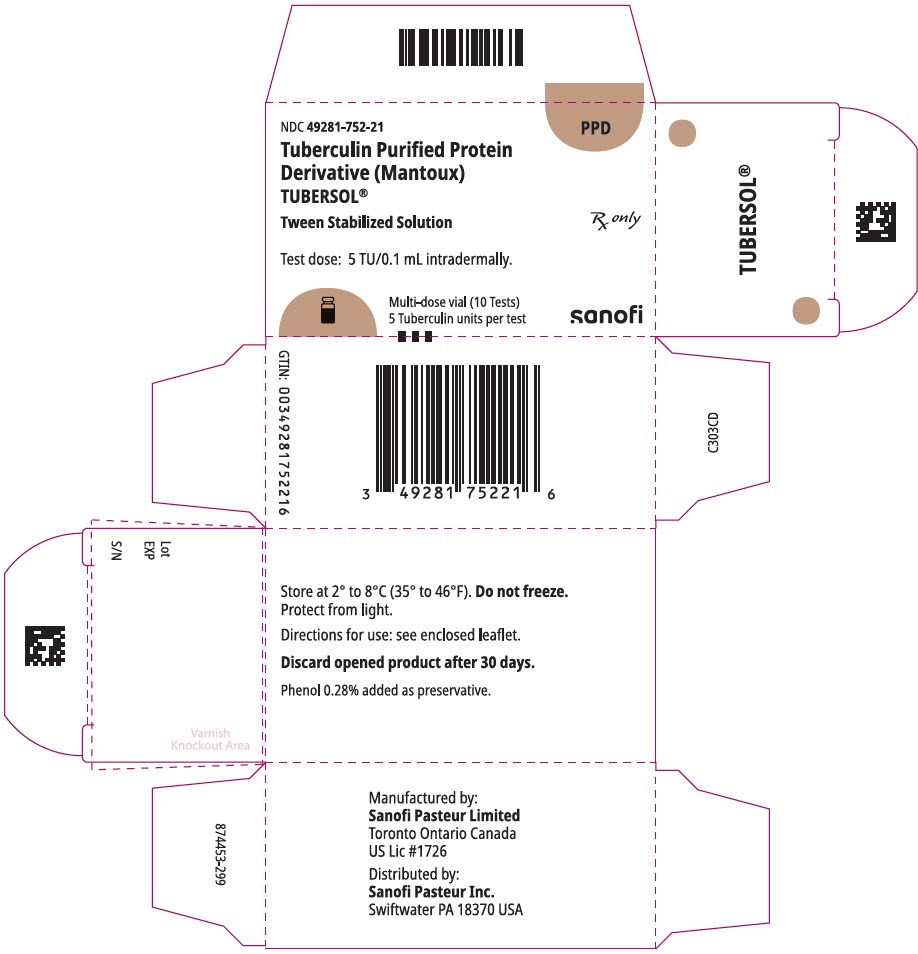
1 mL flerdosis hætteglas (10 test). 49281-752-78; pakke med 1 hætteglas, NDC-nummer 49281-752-21
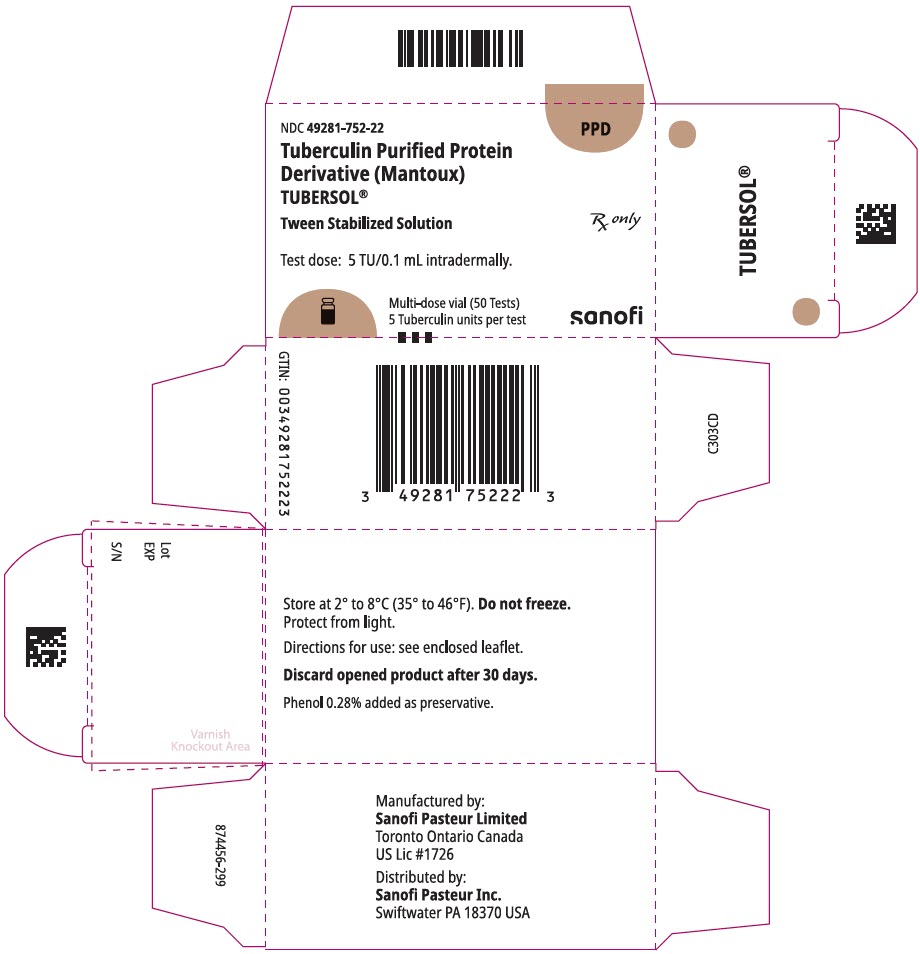
5 mL flerdosis hætteglas (50 Test). 49281-752-98; pakke med 1 hætteglas, NDC nummer 49281-752-22
hætteglassets prop til dette produkt indeholder ikke naturlig gummi.
opbevaring
opbevares ved 2 liter til 8 liter C (35 liter til 46 liter F). (20) må ikke nedfryses. Bortskaf produktet, hvis det udsættes for frysning.
Beskyt mod lys. Tuberkulin PPD-opløsninger kan påvirkes negativt af udsættelse for lys. Produktet skal opbevares i mørke, undtagen når doserne faktisk trækkes ud af hætteglasset. (21)
et hætteglas med Tubersol, som er indtastet og i brug i 30 dage, skal kasseres. (22)
må ikke anvendes efter udløbsdatoen.
1 Landi S. forberedelse, oprensning og stabilitet af tuberkulin. Appl Microbiol 1963; 11: 408-412. 2 Landi S, et al. Fremstilling og karakterisering af et stort parti af tuberculin oprenset proteinderivat (PPD-CT68). Ann Scalvo.1980;22:889-907. 3 US Code of Federal Regulations, Afsnit 21, Del 610, Subpart C – standardpræparater og grænser for styrke. 4 Landi S, et al. Adsorption af tuberkulin PPD til glas-og plastoverflader. Bull. Hvem 1966; 35:593-602. 5 Landi S, et al. Forskel på styrke mellem stabiliserede og ikke-stabiliserede fortyndede tuberkulinopløsninger. Am Rev Respir Dis 1971; 104: 385-393. 6 Landi S, et al. Stabilitet af fortyndede opløsninger af tuberculin oprenset proteinderivat. Tuberkel 1978; 59: 121-133. 7 Mensier D. fortolkning af gentagne tuberkulinprøver. Am J Respir Crit Care Med 1999; 159: 15-21. 8 American Thoracic Society: diagnostiske standarder og klassificering af tuberkulose hos voksne og børn. Am J Respir Crit Pleje Med 2000; 161:1376-1395. 9 CDC. Opdaterede retningslinjer for brug af Interferon Gamma Release Assays til påvisning af Mycobacterium tuberculosis infektion – USA, 2010. 2010; 59 (RR-5): 1-25. 10 CDC. Målrettet tuberkulinprøvning og behandling af latent tuberkuloseinfektion. 2000; 49 (RR-6):23-5. 11 Froeschle JE, et al. Umiddelbare overfølsomhedsreaktioner efter brug af tuberkulin hudtest. Clin inficere Dis 2002; 34:e12-13. 12 Brickman HF, et al. Tidspunktet for tuberkulinprøver i forhold til immunisering med levende virale vacciner. Pædiatri: 1975; 55: 392-396. 13 CDC. Generelle anbefalinger om immunisering: anbefalinger fra Det Rådgivende Udvalg for Immuniseringspraksis (ACIP) og American Academy of Family Physicians (AAFP). 2002; 51 (RR-2): 1-36. 14 CDC. Retningslinjer for forebyggelse af overførsel af Mycobacterium tuberculosis i sundhedsvæsenet, 2005. 2005; 54 (RR-17): 1-141. 15 CDC. BCG-vaccinens rolle i forebyggelse og bekæmpelse af tuberkulose i USA. En fælles erklæring fra Det Rådgivende Råd for eliminering af tuberkulose og Det Rådgivende Udvalg for Immuniseringspraksis. 1996; 45 (RR-4): 1-18. 16 CDC. Retningslinjer for undersøgelse af kontakter af personer med infektiøs tuberkulose: anbefalinger fra National Tuberculosis Controllers Association og CDC. 2005; 54 (RR-15): 1-37. 17 Mori og Shiosaja. Suppression af tuberkulin overfølsomhed forårsaget af rubella infektion. Am Rev Respir Dis 1985; 886-888. 18 CDC. Retningslinjer for forebyggelse og behandling af opportunistiske infektioner hos HIV-inficerede voksne og unge. Anbefalinger fra CDC, National Institutes of Health og HIV Medicine Association of Infectious Diseases Society of America. 2009; 58 (RR-4): 1-207. 19 CDC. Forebyggelse og bekæmpelse af tuberkulose i korrigerende og tilbageholdelsesfaciliteter: anbefalinger fra CDC. 2006; 55 (RR-9): 1-44. 20 Landi S, et al. Stabilitet af fortyndet opløsning af tuberkulin oprenset proteinderivat ved ekstreme temperaturer. J Biol Stand 1981;9:195-199. 21 Landi s, et al. Virkning af lys på tuberkulin oprensede proteinderivatopløsninger. Am Rev Respir Dis 1975; 111: 52-61. 22 Landi s, et al. Virkningen af iltning på stabiliteten af tuberculin oprenset proteinderivat (PPD) i: International Symposium on Tuberculins and BCG Vaccine. Basel: Den Internationale Sammenslutning af biologisk standardisering, 1983. Dev Biol Stand 1986; 58: 545-552.
fremstillet af:
Sanofi Pasteur Limited
Toronto Ontario Canada
distribueret af:
Sanofi Pasteur Inc.18370 USA
produktinformation pr.
November 2020
HOVEDDISPLAYPANEL-1 mL hætteglas etiket
Tuberculin oprenset
Proteinderivat
(Mantou)
Tubersol list
flerdosis hætteglas
1 mL (10 Test)
testdosis: 5 TU / 0,1 mL ID.
Beskyt mod lys.
kasseres åbnet
produkt efter 30 dage.
kun
Sanofi Pasteur Limited
dato åbnet

PRINCIPAL displaypanel – 1 mL hætteglas karton
NDC 49281-752-21
PPD
Tuberculin oprenset Protein
derivat)
tubersol Lira
mellem stabiliseret opløsning
flerdosis hætteglas 10 test 5 tu
kun
testdosis: 5 tu / 0,1 ml intradermalt.
Bio-svarende til 5 amerikanske enheder (TU) af PPD-S
SANOFI PASTEUR
PRINCIPAL DISPLAY PANEL – 5 mL hætteglas etiket
Tuberculin oprenset Protein
derivat (Mantou)
Tubersol)
testdosis: 5 tu/0,1 ml id.
kun
Beskyt mod lys.
bortskaf det åbnede produkt efter 30 dage.
Sanofi Pasteur Limited
dato åbnet

PRINCIPAL displaypanel – 5 mL hætteglas karton
NDC 49281-752-22
PPD
Tuberculin oprenset Protein
derivat (Mantou)
Tubersol p>
mellem stabiliseret opløsning
flerdosis hætteglas 50 Test 5 tu
kun
testdosis: 5 tu/0,1 ml intradermalt.
Bio-equivalent to 5 US units (TU) of PPD-S
SANOFI PASTEUR
| Tubersol tuberculin purified protein derivative injection, solution |
|||||||||||||||||||
|
|||||||||||||||||||
|
|||||||||||||||||||
|
|||||||||||||||||||
|
|||||||||||||||||||
|
|||||||||||||||||||
|
|||||||||||||||||||
Labeler – Sanofi Pasteur Inc. (086723285)
| Establishment | |||
| Name | Address | ID/FEI | Operations |
| Sanofi Pasteur Limited | 208206623 | MANUFACTURE(49281-752) | |
mere om Tubersol (tuberculin oprenset proteinderivat)
- bivirkninger
- amning
- doseringsinformation
- lægemiddelinteraktioner
- prissætning& kuponer
- lægemiddelklasse: in vivo diagnostiske biologiske stoffer
forbrugerressourcer
- avanceret læsning
professionelle ressourcer
- ordineringsinformation
andre mærker aplisol
relaterede behandlingsvejledninger
- diagnose og undersøgelse
medicinsk ansvarsfraskrivelse