Generic Name: tuberkulinový purifikovaný proteinový derivát
Léková Forma: injekce, roztok
Lékařsky přezkoumány Drugs.com. Naposledy aktualizován 1 Listopad, v roce 2020.
- Přehled
- Nežádoucí Účinky
- Dávkování
- Odborné
- Interakce
- Další
AHFS Kategorii: 36:84
Rx pouze
Diagnostické Antigen
(Pomoc při odhalování infekce Mycobacterium tuberculosis)
PRO INTRADERMÁLNÍ POUŽITÍ
Polysorbát 80 Stabilizovaný Roztok Tuberkulinový Purifikovaný Proteinový Derivát pro tuberkulinaci v Lidech
Tubersol Popis
Tubersol® Tuberkulinový Purifikovaný Proteinový Derivát (Mantoux) (PPD) (1) pro intradermální tuberkulinaci je připravena z velké Master Batch Connaught Tuberkulin (CT68) (2) a je buňka-zdarma purifikované proteinové frakce získané z lidského kmene Mycobacterium tuberculosis pěstované na syntetické médium bez bílkovin a inaktivované. (2) použití standardního přípravku získaného z jedné šarže (CT68) bylo přijato, aby se vyloučila změna šarže na šarži stejným výrobcem. (2)
Tubersol je čirá, bezbarvá kapalina.
| Tubersol obsahuje: | |
| Purifikovaný proteinový derivát M. tuberculosis | 5 TU za 0.1 mL |
| Polysorbate 80 | 0.0006% |
| Phenol | 0.22% to 0.35% w/v |
| in sterile isotonic phosphate buffered saline. | |
Before release, each successive lot is tested for potency in comparison with the US Standard Tuberculin PPD-S. (3)
Nezávislé studie, prováděné v USA Veřejného Zdravotnictví na člověka určuje množství CT68 v stabilizovala řešení nutné (4) (5) (6) k produkci bio-ekvivalence s Tuberkulinem PPD-S (ve fosfátovém pufru bez polysorbát 80) pomocí 5 US jednotek (TU) Tuberkulinu PPD-S jako standard.
Tubersol – Klinická Farmakologie
Mechanismus účinku
senzibilizace tyto infekce mykobakterií dochází především v regionálních lymfatických uzlin. Malé lymfocyty (T lymfocyty) proliferují v reakci na antigenní stimul za vzniku specificky senzibilizovaných lymfocytů. Po 3-8 týdnech tyto lymfocyty vstupují do krevního oběhu a cirkulují roky. (7) následná restimulace těchto senzibilizovaných lymfocytů stejným nebo podobným antigenem, jako je intradermální injekce Tubersolu, vyvolává lokální reakci zprostředkovanou těmito buňkami. (8)
je Příznačné, zpožděné reakce přecitlivělosti na tuberkulin začít v 5 až 6 hodin, maximální na 48 až 72 hodin a odezní během pár dní. Výsledná imunitní odpověď spočívá v induraci v důsledku buněčné infiltrace a příležitostně vezikulace a nekrózy. Klinicky je zpožděná reakce přecitlivělosti na tuberkulin projevem předchozí infekce tuberkulózou M nebo různými bakteriemi bez tuberkulózy. Ve většině případů je senzibilizace vyvolána přirozenou mykobakteriální infekcí nebo očkováním BCG vakcínou.
Indikace a Využití pro Tubersol
Tubersol Tuberkulinový Purifikovaný Proteinový Derivát (Mantoux), je určen na pomoc diagnostiku tuberkulózy (TBC) u osob, u nichž je zvýšené riziko vzniku aktivního onemocnění.
Centra pro Kontrolu a Prevenci Nemocí (CDC) zveřejnila pokyny týkající se populace, které by měly prospěch z tuberkulinový kožní test (TST). Aktuální doporučení jsou přístupná na adrese: http://www.cdc.gov/tb/publications/factsheets/testing.htm.
předchozí BCG očkování není kontraindikací tuberkulinového testování. Výsledky kožních testů očkovaných osob BCG lze použít k podpoře nebo vyloučení diagnózy infekce TBC. Test uvolňování interferonu gama schválený FDA je však upřednostňován před tuberkulinovým kožním testem u osob ve věku 5 let a starších, které byly dříve očkovány BCG. (9)
Kontraindikace
Alergie na jakoukoliv složku Tubersol nebo anafylaktické nebo jiné alergické reakci na předchozí test tuberkulinem PPD je kontraindikací pro použití Tubersol. (Viz popis a způsob dodání.)
Tubersol by neměl být podáván:
- Osoby, které mají závažné reakce (např. nekrózy, puchýře, anafylaktický šok nebo ulcerace) na předchozí TST,
- Osoby s prokázanou aktivní tuberkulózy nebo vymazat historii léčby TBC infekce nebo onemocnění, (10)
- Osoby s rozsáhlými popáleninami nebo ekzém.
upozornění
hypersenzitivita
po použití Tubersolu se mohou objevit alergické reakce i u osob bez anamnézy přecitlivělosti na složky přípravku. (11) injekce epinefrinu (1:1 000) a další vhodné látky používané ke kontrole okamžitých alergických reakcí musí být okamžitě k dispozici.
synkopa
synkopa (mdloby) se může objevit v souvislosti s podáváním injekčních léků, včetně Tubersolu. Postupy by měly být zavedeny, aby se zabránilo pádu zranění a obnovit mozkovou perfuzi po synkopě.
bezpečnostní opatření
Obecné
diagnostická omezení
u některých jedinců se mohou objevit falešně pozitivní nebo falešně negativní tuberkulinové kožní testy. (Viz výklad zkoušky.)
falešně pozitivní testy tuberkulinové reakce se vyskytují u jedinců, kteří byli infikováni jinými mykobakteriemi, včetně očkování BCG.
ne všechny infikované osoby budou mít zpožděnou reakci přecitlivělosti na tuberkulinový test.
Mnoho faktorů byly hlášeny způsobit sníženou schopnost reagovat na tuberkulinový test v přítomnosti tuberkulózní infekce. (Viz výklad zkoušky.
informace pro pacienty
před podáním Tubersolu by měl být přezkoumán současný zdravotní stav pacienta a jeho anamnéza. Lékař by měl zkontrolovat historii imunizace pacienta z hlediska možné citlivosti na složky Tubersolu.
poskytovatel zdravotní péče by měl pacienta informovat o nutnosti vrátit se ke čtení testu. Ukázalo se, že vlastní čtení testu je nepřesné a nespolehlivé.
poskytovatel zdravotní péče by měl pacientovi poskytnout trvalý osobní záznam. Kromě toho je nezbytné, aby zdravotnický pracovník zaznamenal historii testování v trvalém lékařském záznamu každého pacienta. Tento trvalý záznam v kanceláři by měl obsahovat název přípravku, uvedené datum, dávku, výrobce a číslo šarže, jakož i Výsledek zkoušky v milimetrech indurace (případně včetně 0 mm). Vykazování výsledků pouze jako negativních nebo pozitivních není uspokojivé.
lékové interakce
reaktivita na test může být depresivní nebo potlačená u osob, které dostávají kortikosteroidy nebo imunosupresivní látky. (8)
reaktivita na Tubersol může být dočasně snížena některými živými virovými vakcínami (spalničky, příušnice, zarděnky, perorální polio, žlutá zimnice a plané neštovice). Pokud parenterální oslabené živé virové vakcíny byly podávány v poslední době, tuberkulinaci by mělo být odloženo na >1 měsíc po očkování. (8) (12) (viz výklad zkoušky.)
Pokud je vyžadován tuberkulinový screening současně s vakcínou obsahující spalničky nebo jinou parenterální živou atenuovanou virovou vakcínou, je preferovanou možností současné podávání Tubersolu a vakcíny na různých místech.
karcinogeneze, mutageneze, zhoršení FERTILITY
Tubersol nebyl hodnocen z hlediska jeho kancerogenního nebo mutagenního potenciálu nebo poškození fertility.
těhotenství
reprodukční studie na zvířatech nebyly s Tubersolem provedeny. Není také známo, zda Tubersol může při podávání těhotné ženě způsobit poškození plodu nebo může ovlivnit reprodukční kapacitu. Tubersol by měl být podáván těhotné ženě pouze v případě potřeby.
kojící matky
není známo, zda se Tubersol vylučuje do mateřského mléka. Protože se mnoho léků vylučuje do lidského mléka, je třeba při podávání Tubersolu kojící ženě postupovat opatrně.
pediatrické použití
neexistuje žádná kontraindikace k tuberkulinovému kožnímu testování kojenců. Kojenci <ve věku 6 měsíců, kteří jsou infikováni m. tuberculosis, nemusí reagovat na tuberkulózu. (Viz výklad zkoušky.)
Geriatrické Použití
Klinické studie Tubersol nezahrnovaly dostatečný počet subjektů ve věku 65 a více let ke stanovení, zda reagují odlišně než mladší subjekty.
nežádoucí účinky
indurace v místě vpichu Tubersolu je očekávanou reakcí na pozitivní kožní test. (Viz výklad zkoušky.
informace týkající se nežádoucích účinků byly shromážděny z historických klinických studií a zkušeností Po uvedení přípravku na trh s Tubersolem.
celkové poruchy a reakce v místě aplikace
bolest v místě vpichu, svědění v místě vpichu a nepohodlí v místě vpichu. Erytém v místě vpichu nebo vyrážka v místě vpichu (bez indurace) vyskytující se do 12 hodin po testování. Tyto reakce nenaznačují infekci TBC. Krvácení v místě vpichu a hematom v místě vpichu do tří dnů po podání testu. Vezikuly v místě vpichu, vřed v místě vpichu nebo nekróza v místě vpichu u vysoce citlivých osob. Jizva v místě vpichu v důsledku silně pozitivních reakcí. Pyrexie
poruchy Imunitního systému
Přecitlivělosti, včetně anafylaxe/anafylaktické reakce, angioedém, kopřivka
Respirační, hrudní a mediastinální poruchy
Stridor, dušnost
poruchy Kůže a podkožní tkáně
Vyrážka, generalizovaná vyrážka
poruchy Nervového systému
Presynkopa, synkopa (včetně synkopy spojené s tonicko-klonickými pohyby a jiné záchvatu) někdy vede k tranzitorní ztráta vědomí s poraněním
Hlášení Nežádoucích Událostí
, Aby hlásili PODEZŘENÍ na NEŽÁDOUCÍ ÚČINKY, obraťte se na Farmakovigilanci Oddělení, Sanofi Pasteur Inc. Discovery Drive, Swiftwater, PA 18370 nebo zavolejte 1-800-822-2463 (1-800-VAKCÍNA) nebo Food and Drug Administration (FDA), MEDWATCH Program na 1-800-332-1088 a www.fda.gov/medwatch.
Tubersol Dávkování a způsob Podání
Dávkování
Pět (5) tuberkulinových jednotek (TU) na zkušební dávka 0,1 mL se standardní sílu používá pro intradermální (Mantoux) testování.
způsob podání
Tubersol je indikován pouze pro intradermální injekci. Nepodávejte intravenózně, intramuskulárně nebo subkutánně. Pokud dojde k subkutánní injekci, test nelze interpretovat.
před použitím zkontrolujte přítomnost cizích částic a/nebo změnu barvy. Pokud tyto podmínky existují, nepodávejte přípravek.
pro každou injekci použijte samostatnou injekční stříkačku a jehlu. (13)
pro provedení testu Mantoux se doporučuje následující postup:
- preferovaným místem testu je volar aspekt předloktí. Vyvarujte se oblastí na kůži, které jsou červené nebo oteklé. Vyhněte se viditelným žilám.
- očistěte místo kůže vhodným germicidem a před injekcí antigenu nechte místo zaschnout.
- Spravovat testovací dávka (0,1 mL) Tubersol s 1 mL stříkačku kalibrovanou v desetinách a vybaveno krátké, one-quarter k jednomu-polovina palce, 26 nebo 27 jehlu.
- utřete zátku injekční lahvičky vhodným germicidem a před zavedením jehly nechte zaschnout. Poté jehlu jemně protáhněte zátkou a do stříkačky natáhněte 0, 1 mL Tubersolu. Vyvarujte se vstřikování přebytečného vzduchu s odstraněním každé dávky, aby nedošlo k nadměrnému natlakování injekční lahvičky a možnému prosakování v místě vpichu.
- Vložit špičku jehly do povrchní vrstvy kůže s jehlou zkosení směřující vzhůru a aplikujte dávku pomalu intradermální injekce. Pokud je intradermální injekce provedena správně, v bodě jehly vzroste určitý bledý bleb o průměru asi 10 mm (3/8″). Tento bleb se rozptýlí během několika minut. Neoblékněte web.
- po injekci se může v místě aplikace objevit kapka krve. Místo lehce osušte, abyste odstranili krev, ale vyhněte se vytlačování injikované tuberkulinové testovací tekutiny.
V případě nesprávně provedené vstřikování (tj, žádný puchýřek tvořil), opakujte test ihned na jiném místě, alespoň 2 palce od první stránky a kruh druhém místě vpichu injekce jako náznak, že toto je místo pro čtení.
informujte pacienta o nutnosti vrátit se ke čtení testu vyškoleným zdravotnickým pracovníkem. Vlastní čtení může být nepřesné a je silně odrazováno.
interpretace testu
kožní test by měl přečíst vyškolený zdravotnický pracovník 48 až 72 hodin po podání Tubersolu. Citlivost kožního testu je indikována pouze indurací; zarudnutí by se nemělo měřit.
změřte průměr indurace příčně k dlouhé ose předloktí a zaznamenejte měření v milimetrech (včetně 0 mm). (8) špička kuličkového pera, jemně tlačená pod úhlem 45° směrem k místu vpichu, se zastaví na okraji indurace.
také zaznamenávají přítomnost a velikost (pokud jsou přítomny) nekrózy a edému, i když se při interpretaci testu nepoužívají.
Pozitivní Reakce
Tuberkulínovou reaktivitou může znamenat, latentní infekce, předchozí infekcí a/nebo nemocí, s M. tuberculosis a nemusí nutně signalizovat přítomnost aktivní tuberkulózní onemocnění. Osoby vykazující pozitivní tuberkulinové reakce by měly být podle současných pokynů pro veřejné zdraví považovány za pozitivní a měly by být předány k dalšímu lékařskému vyšetření. (8) (10) opakované testování neinfikovaných osob je senzibilizuje na Tubersol. (7) (8) (10)
význam zatvrdnutí měření v diagnostice latentní TB infekci, musí být považovány z hlediska historie pacienta a riziko rozvoje aktivní TBC, jak je uvedeno v Tabulce 1. (10)
| Reakce ≥5 mm Indurace | Reakce ≥10 mm Indurace | Reakce ≥15 mm Indurace |
|---|---|---|
| * Riziko TBC u pacientů léčených kortikosteroidy se zvyšuje s vyšší dávkou a delší trvání. † U osob, které jsou jinak vystaveny nízkému riziku a jsou testovány na začátku zaměstnání, je reakce indurace ≥15 mm považována za pozitivní. | ||
| HIV-pozitivních osob Poslední kontakty tuberkulózy (TBC) u pacientů Fibrotické změny na rentgenovém snímku v souladu s předchozí TB Pacientů s transplantací orgánů a jiných imunosuprimovaných pacientů (příjem ekvivalent ≥15 mg/d prednisonu po dobu 1 měsíce nebo více)* |
Nedávných přistěhovalců (tj. během posledních 5 let) ze střední prevalencí injekčních uživatelů drog Obyvatelé nebo zaměstnanci† těchto vysoce rizikových scházet nastavení: věznicích a věznicích, domovech důchodců a jiných dlouhodobých zařízení pro seniory, nemocnic a dalších zdravotnických zařízení, rezidenční zařízení pro pacienty se syndromem získané imunodeficience (AIDS) a bezdomovce Mycobacteriology laboratorní pracovníci Osoby s následujícími klinickými stavy, které místo je na vysoké riziko: silikóza, diabetes mellitus, chronické renální selhání, některé hematologické poruchy (např. leukémie a lymfomy), další specifické malignity (např., karcinom hlavy a krku a plic), úbytek tělesné hmotnosti ≥10% ideální tělesné hmotnosti, gastrektomie a jejunoileal bypass Děti mladší než 4 let věku nebo děti, děti, a mladiství vystaveni dospělí ve vysokém riziku |
Osoby bez rizikových faktorů pro TB |
TST konverze je definována jako zvýšení o ≥10 mm indurace v rámci 2-leté období, bez ohledu na věk. (10)
je třeba vzít v úvahu možnost, že citlivost kožního testu může být také způsobena předchozím kontaktem s atypickými mykobakteriemi nebo předchozím očkováním BCG. (8) (10)
negativní reakce
jedinec, který při prvním testu nevykazuje pozitivní reakci na 5 TU, ale je podezřelý z pozitivní TBC, může být znovu testován s 5 TU. (Viz posilovací efekt a dvoufázové testování.) Každý jedinec, který nevykazuje pozitivní reakci na počáteční injekci 5 TU nebo druhý test s 5 TU, může být považován za tuberkulin negativní.
falešně pozitivní reakce
falešně pozitivní tuberkulinové reakce se mohou objevit u jedinců infikovaných jinými mykobakteriemi, včetně očkování BCG. (8) Nicméně, diagnóza infekce M. tuberculosis a použití preventivní terapie by měla být považována pro všechny očkovaných BCG člověk, který má pozitivní TST reakce, a to zejména, zda osoba byla nebo je, zvýšené riziko získání infekce TBC. (Viz indikace a použití.) (14) (15)
falešně negativní reakce
ne všechny infikované osoby budou mít zpožděnou hypersenzitivní reakci na tuberkulinový test.
u starších pacientů nebo u těch, kteří jsou testováni poprvé, se reakce mohou vyvinout pomalu a mohou vyvrcholit až po 72 hodinách.
Od tuberkulinový citlivosti může trvat až 8 týdnů vyvíjet po expozici M. tuberculosis (viz Mechanismus Působení), osoby, které mají negativní tuberkulinový test <8 týdnů po možné expozice TB by měla být znovu testovány ≥8-10 týdnů po poslední známé nebo podezření na expozici. (16)
Změněné Imunitní Stav
Poškozenou nebo oslabenou buněčnou imunitu (CMI) může potenciálně způsobit falešně negativní tuberkulinovou reakci. Mnoho faktorů byly hlášeny způsobit sníženou schopnost reagovat na tuberkulinový test v přítomnosti tuberkulózní infekce, včetně virových infekcí (např, spalničky, příušnice, plané neštovice a HIV), virus live očkování (např. tuberkulóza, jiné bakteriální infekce, leukémie, sarkoidóza, plísňové infekce, metabolické poruchy, stavy s nízkým obsahem bílkovin, nemoci postihující lymfoidní orgány, léky (kortikosteroidy a mnoho dalších imunosupresiv) a malignita nebo stres. (8) (17) (18) TST by měla být odložena u pacientů s velkými virovými infekcemi nebo očkováním živými viry v uplynulém měsíci. Osoby s běžnou zimou mohou být testovány na tuberkulin.
protože výsledky TST u jedinců infikovaných HIV jsou méně spolehlivé, protože počet CD4 klesá, screening by měl být dokončen co nejdříve po výskytu infekce HIV. (18)
Booster Efekt a Dvou-Krok Testování
Pokud tuberkulinový testování se bude provádět v pravidelných intervalech, například u zdravotnických pracovníků nebo vězení pracovníků, dva-krok testování by mělo být provedeno jako základní, aby se zabránilo interpretaci posilovací účinek jako tuberkulinový konverze. Pokud první test neprokázal žádnou reakci nebo malou reakci, měl by být druhý test proveden o jeden až čtyři týdny později. Oba testy by měly být přečteny a zaznamenány po 48 až 72 hodinách. U pacientů s druhou odpovědí na tuberkulinový test (posilovací) ≥10 mm je třeba mít za to, že v minulosti prodělali infekci TBC. (14) (19)
Osoby, které nemají podporu, když vzhledem k opakování zkoušky v jeden týden, ale jejichž tuberkulinovou reakcí změní na pozitivní po jednom roce, by měly být považovány za nově získané infekce tuberkulózy a řízena odpovídajícím způsobem. (7)
jak se Tubersol dodává
Tubersol tuberkulin purifikovaný proteinový derivát (Mantoux), bioekvivalentní s 5 US jednotkami (tu) PPD-S na zkušební dávku (0 .1 mL) se dodává v:
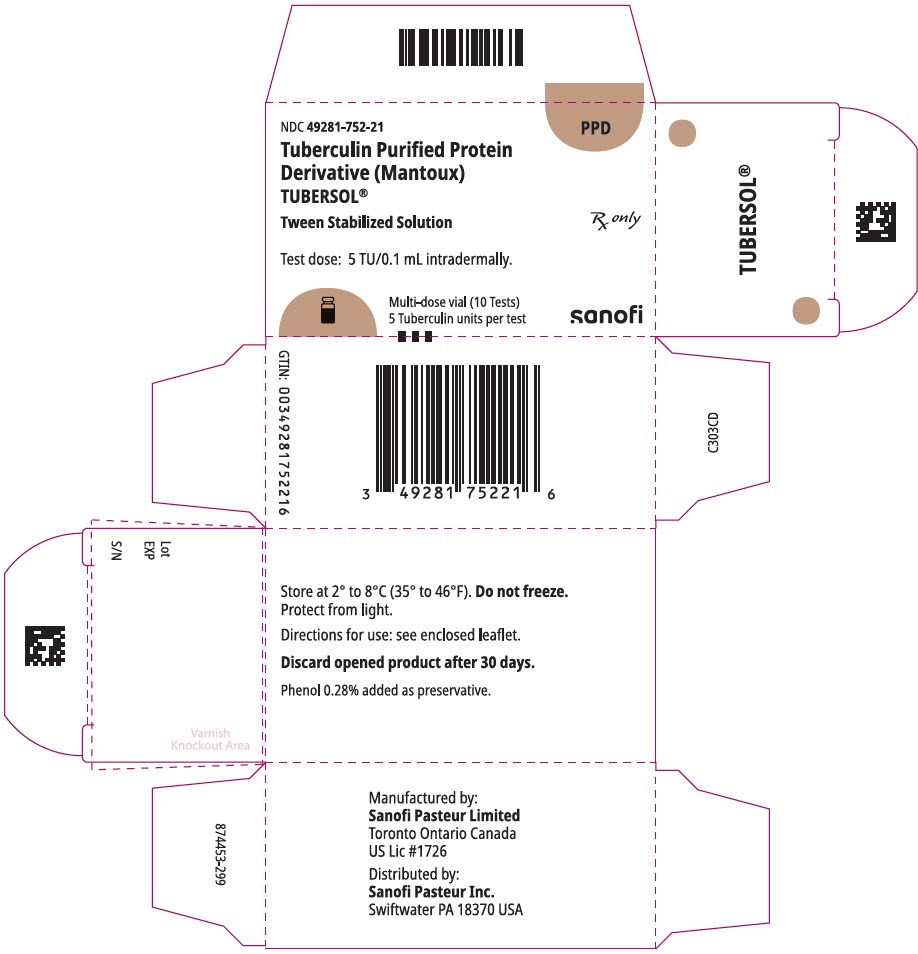
1 mL vícedávkové injekční lahvičce (10 testů). NDC č. 49281-752-78; balení po 1 injekční lahvičce, NDC č. 49281-752-21
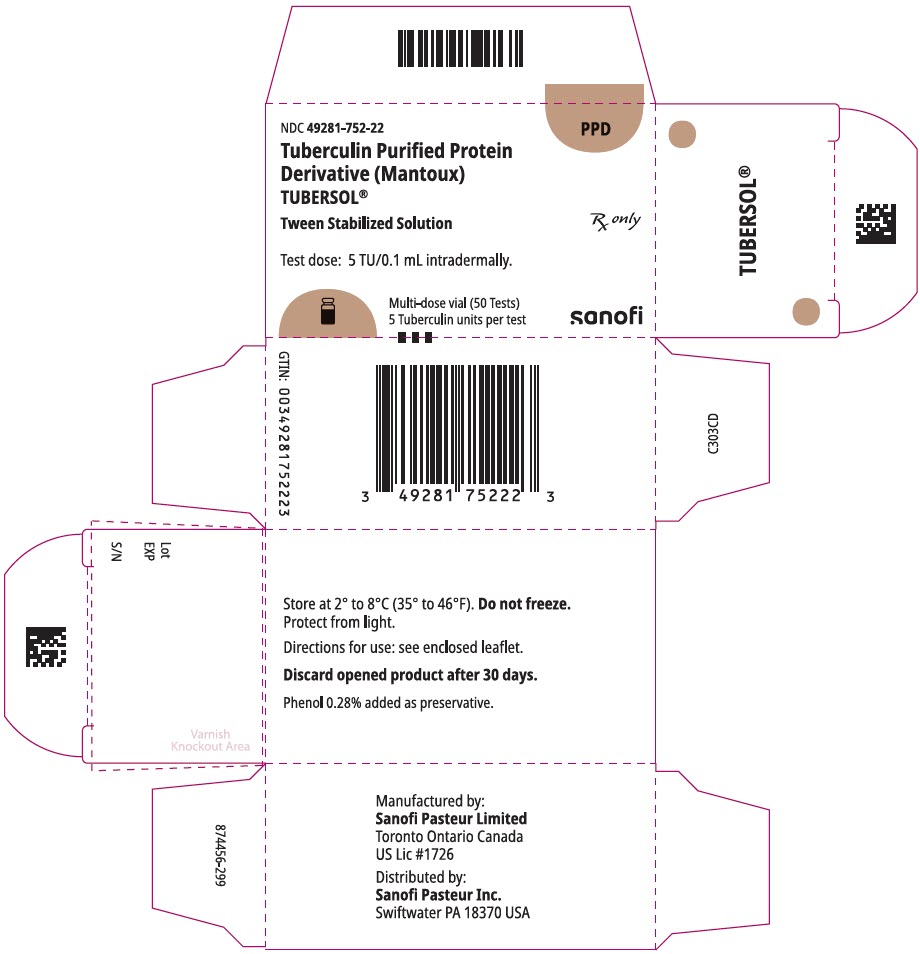
5 mL vícedávkové injekční lahvičky (50 testů). NDC č. 49281-752-98; balení po 1 lahvičce, NDC č. 49281-752-22
zátka injekční lahvičky pro tento produkt neobsahuje přírodní latexovou gumu.
uchovávání
uchovávejte při 2° až 8°C (35° až 46 ° F). (20) Chraňte před mrazem. Pokud je produkt vystaven mrazu, zlikvidujte jej.
Chraňte před světlem. Roztoky tuberkulinu PPD mohou být nepříznivě ovlivněny vystavením světlu. Přípravek by měl být uchováván ve tmě, s výjimkou případů, kdy jsou dávky skutečně odebírány z injekční lahvičky. (21)
injekční lahvička Tubersolu, která byla vložena a používána po dobu 30 dnů, by měla být zlikvidována. (22)
nepoužívejte po uplynutí doby použitelnosti.
1 Landi s. příprava, čištění a stabilita tuberkulinu. Appl Microbiol 1963; 11:408-412. 2 Landi S, et al. Příprava a charakterizace velké šarže tuberkulinového purifikovaného proteinového derivátu (PPD-CT68). Ann Scalvová.1980;22:889-907. 3 Americký kodex federálních předpisů, Hlava 21, část 610, Hlava C-standardní přípravky a limity účinnosti. 4 Landi S, et al. Adsorpce tuberkulinu PPD na skleněné a plastové povrchy. Býk. Kdo 1966; 35: 593-602. 5 Landi S, et al. Rozdíly účinnosti mezi stabilizovanými a nestabilizovanými zředěnými roztoky tuberkulinu. Am Rev Respir Dis 1971; 104: 385-393. 6 Landi S, et al. Stabilita zředěných roztoků tuberkulinového purifikovaného proteinového derivátu. Tubercle 1978; 59: 121-133. 7 Menzies D. interpretace opakovaných tuberkulinových testů. Am J Respir Crit Care Med 1999; 159: 15-21. 8 Americká hrudní společnost: diagnostické standardy a klasifikace tuberkulózy u dospělých a dětí. Am J Respir Crit Care Med 2000; 161: 1376-1395. 9 CDC. Aktualizované pokyny pro použití testů uvolňování interferonu gama k detekci infekce Mycobacterium tuberculosis-Spojené státy, 2010 . MMWR 2010; 59 (RR-5): 1-25. 10 CDC. Cílené tuberkulinové testování a léčba latentní infekce tuberkulózy. MMWR 2000; 49 (RR-6): 23-5. 11 Froeschle JE, et al. Okamžité reakce přecitlivělosti po použití tuberkulinových kožních testů. Clintonová, 34: e12-13. 12 Brickman HF, et al. Načasování tuberkulinových testů ve vztahu k imunizaci živými virovými vakcínami. Pediatrie: 1975; 55: 392-396. 13 CDC. Obecná doporučení na očkování: doporučení Poradního Výboru pro Imunizační Postupy (ACIP) a Americké Akademie Rodinných Lékařů (AAFP). MMWR 2002; 51 (RR-2): 1-36. 14 CDC. Pokyny pro prevenci přenosu Mycobacterium tuberculosis ve zdravotnických zařízeních, 2005. MMWR 2005; 54 (RR-17): 1-141. 15 CDC. Role BCG vakcíny v prevenci a kontrole tuberkulózy ve Spojených státech. Společné prohlášení poradního sboru pro odstranění tuberkulózy a poradního výboru pro imunizační postupy. MMWR 1996; 45 (RR-4): 1-18. 16 CDC. Pokyny pro vyšetřování kontaktů osob s infekční tuberkulózou: doporučení Národní asociace kontrolorů tuberkulózy a CDC. MMWR 2005; 54 (RR-15): 1-37. 17 Mori a Shiozawa. Potlačení tuberkulinové přecitlivělosti způsobené infekcí zarděnkami. Am Rev Respir Dis 1985; 886-888. 18 CDC. Pokyny pro prevenci a léčbu oportunních infekcí u dospělých a dospívajících infikovaných HIV. Doporučení CDC, National Institutes of Health a HIV Medicine Association of Infectious Diseases Society of America. MMWR 2009; 58 (RR-4): 1-207. 19. Prevence a kontrola tuberkulózy v nápravných a zadržovacích zařízeních: doporučení CDC. MMWR 2006; 55 (RR-9): 1-44. 20 Landi S, et al. Stabilita zředěného roztoku tuberkulinového purifikovaného proteinového derivátu při extrémních teplotách. J Biol Stand 1981; 9: 195-199. 21 Landi S, et al. Vliv světla na roztoky purifikovaných proteinových derivátů tuberkulinu. Am Rev Respir Dis 1975; 111: 52-61. 22 Landi S, et al. Vliv oxidace na stabilitu tuberkulinový purifikovaný proteinový derivát (PPD) In: Mezinárodní Symposium o Tuberkulinu a BCG Vakcíny. Basilej: Mezinárodní asociace biologické normalizace, 1983. Dev Biol Stojan 1986; 58: 545-552.
výrobce:
Sanofi Pasteur Limited
Toronto Ontario Canada
distribuováno:
Sanofi Pasteur Inc.
Swiftwater, PA 18370 USA
Informace o Produktu jako
v listopadu roku 2020
HLAVNÍ DISPLEJ – 1 mL Lahvičce
Tuberkulinový Purifikovaný
Proteinový Derivát
(Mantoux)
Tubersol®
Multi-lahvička
1 mL (10 Testů)
Testovací dávka: 5 ÚT/0,1 mL ID.
Chraňte před světlem.
zlikvidujte otevřený
produkt po 30 dnech.
Rx pouze
Sanofi Pasteur Limited
Datum otevřel

HLAVNÍ DISPLEJ – 1 mL Krabička obsahující injekční Lahvičku
NDC 49281-752-21
PPD
Tuberkulinový Purifikovaný Proteinový
Derivace (Mantoux)
Tubersol®
Tween Stabilizovaný Roztok
Multi-lahvička 10 Testů 5 TU
Rx pouze
Testovací dávka: 5 ÚT/0,1 mL intradermálně.
Bio-ekvivalent 5 US jednotek (TU) PPD-S
SANOFI PASTEUR
HLAVNÍ DISPLEJ – 5 mL na Štítku Lahvičky
Tuberkulinový Purifikovaný Proteinový
Derivace (Mantoux)
Tubersol®
Multi-lahvička
5 mL (50 Testů)
Testovací dávka: 5 ÚT/0,1 mL ID.
Rx pouze
Chraňte před světlem.
otevřený produkt zlikvidujte po 30 dnech.
Sanofi Pasteur Limited
Datum otevřel

HLAVNÍ DISPLEJ – 5 mL injekční Lahvička Krabička
NDC 49281-752-22
PPD
Tuberkulinový Purifikovaný Proteinový
Derivace (Mantoux)
Tubersol®
Tween Stabilizovaný Roztok
Multi-lahvička 50 Testů 5 TU
Rx pouze
Testovací dávka: 5 ÚT/0,1 mL intradermálně.
Bio-equivalent to 5 US units (TU) of PPD-S
SANOFI PASTEUR
| Tubersol tuberculin purified protein derivative injection, solution |
|||||||||||||||||||
|
|||||||||||||||||||
|
|||||||||||||||||||
|
|||||||||||||||||||
|
|||||||||||||||||||
|
|||||||||||||||||||
|
|||||||||||||||||||
Labeler – Sanofi Pasteur Inc. (086723285)
| Establishment | |||
| Name | Address | ID/FEI | Operations |
| Sanofi Pasteur Limited | 208206623 | MANUFACTURE(49281-752) | |
Více o Tubersol (tuberkulinový purifikovaný proteinový derivát)
- Nežádoucí Účinky
- Kojení
- Dávkování Informací
- lékové Interakce
- Ceny & Kupóny
- třída Lék: in vivo diagnostických biologicals
Spotřebitelské zdroje
- Pokročilé Čtení
Odborné zdroje
- Předepisování Informace
Jiných značek Aplisol
Související léčba vodítka
- Diagnostika a Šetření
Medical Disclaimer