Nombre genérico: derivado de proteína purificada de tuberculina
Forma de dosificación: inyección,solución
Revisado médicamente por Drugs.com. Última actualización el 1 de noviembre de 2020.
- Visión general
- Efectos Secundarios
- Dosis
- Profesional
- Interacciones
- Más
SAIA Categoría: 36:84
Solo Rx
Antígeno diagnóstico
(Ayuda en la detección de infecciones por Mycobacterium tuberculosis)
PARA uso Intradérmico
Solución Estabilizada de Polisorbato 80 de Derivado de Proteína Purificada de Tuberculina para Pruebas de Tuberculina en Humanos
Descripción del Tubérculo
Derivado de Proteína Purificada de Tuberculina de Tubersol® (Mantoux) (PPD) (1) para la prueba de la tuberculina se prepara a partir de un lote maestro grande de tuberculina Connaught (CT68) (2) y es una fracción de proteína purificada libre de células obtenida de una cepa humana de Mycobacterium tuberculosis cultivada en un medio sintético sin proteínas e inactivado. (2) Se ha adoptado el uso de un preparado estándar derivado de un solo lote (CT68) para eliminar la variación de lote a lote por parte del mismo fabricante. (2)
El tubérculo es un líquido transparente e incoloro.
| Tubersol contiene: | |
| derivado de proteína Purificada de M. tuberculosis | 5 MA por 0.1 mL |
| Polysorbate 80 | 0.0006% |
| Phenol | 0.22% to 0.35% w/v |
| in sterile isotonic phosphate buffered saline. | |
Before release, each successive lot is tested for potency in comparison with the US Standard Tuberculin PPD-S. (3)
Estudios independientes realizados por el Servicio de Salud Pública de los Estados Unidos en seres humanos han determinado la cantidad de CT68 en solución estabilizada necesaria (4) (5) (6) para producir bio-equivalencia con tuberculina PPD-S (en tampón de fosfato sin polisorbato 80) utilizando 5 unidades estadounidenses (TU) de tuberculina PPD-S como estándar.
Farmacología clínica del tubérculo
Mecanismo de acción
La sensibilización tras la infección por micobacterias se produce principalmente en los ganglios linfáticos regionales. Los linfocitos pequeños (linfocitos T) proliferan en respuesta al estímulo antigénico para dar lugar a linfocitos específicamente sensibilizados. Después de 3 a 8 semanas, estos linfocitos ingresan al torrente sanguíneo y circulan durante años. (7) La reestimulación posterior de estos linfocitos sensibilizados con el mismo antígeno o un antígeno similar, como la inyección intradérmica de tubérculos, provoca una reacción local mediada por estas células. (8)
Característicamente, las reacciones de hipersensibilidad retardada a la tuberculina comienzan a las 5 a 6 horas, son máximas a las 48 a 72 horas y desaparecen durante un período de días. La respuesta inmune resultante consiste en induración debido a la infiltración celular y ocasionalmente vesiculación y necrosis. Clínicamente, una reacción de hipersensibilidad retardada a la tuberculina es una manifestación de infección previa con tuberculosis M o una variedad de bacterias no tuberculosas. En la mayoría de los casos, la sensibilización es inducida por infección micobacteriana natural o por vacunación con vacuna BCG.
Indicaciones y uso de Tubérculos
El derivado Proteico Purificado de Tuberculina de Tubérculo (Mantoux), está indicado para ayudar al diagnóstico de la infección por tuberculosis (TB) en personas con mayor riesgo de desarrollar una enfermedad activa.
Los Centros para el Control y la Prevención de Enfermedades (CDC, por sus siglas en inglés) han publicado pautas con respecto a las poblaciones que se beneficiarían de la prueba cutánea de la tuberculina (TST, por sus siglas en inglés). Se puede acceder a las recomendaciones actuales en: http://www.cdc.gov/tb/publications/factsheets/testing.htm.
La vacunación previa con BCG no es una contraindicación para la prueba de tuberculina. Los resultados de las pruebas cutáneas de las personas vacunadas con BCG se pueden utilizar para apoyar o excluir el diagnóstico de infección de tuberculosis. Sin embargo, se prefiere un ensayo de liberación de interferón gamma aprobado por la FDA en lugar de la prueba cutánea de tuberculina para personas de 5 años de edad y mayores que fueron vacunadas previamente con BCG. (9)
Contraindicaciones
La alergia a cualquier componente del tubérculo o una reacción anafiláctica u otra reacción alérgica a una prueba previa de tuberculina PPD es una contraindicación para el uso del tubérculo. (Ver DESCRIPCIÓN y CÓMO SE SUMINISTRA.)
El tubérculo no debe administrarse a:
- Personas que han tenido una reacción grave (por ejemplo, necrosis, ampollas, shock anafiláctico o ulceraciones) a una PT previa,
- Personas con tuberculosis activa documentada o antecedentes claros de tratamiento para infección o enfermedad de tuberculosis, (10)
- Personas con quemaduras extensas o eccema.
Advertencias
Hipersensibilidad
Pueden producirse reacciones alérgicas tras el uso de Tubérculos, incluso en personas sin antecedentes de hipersensibilidad a los componentes del producto. (11) Inyección de epinefrina (1:1.000) y otros agentes apropiados utilizados para el control de reacciones alérgicas inmediatas deben estar disponibles inmediatamente.
Síncope
El síncope (desmayo) puede producirse en asociación con la administración de medicamentos inyectables, incluido el tubérculo. Los procedimientos deben estar en su lugar para evitar lesiones por caídas y para restaurar la perfusión cerebral después del síncope.
Precauciones
General
Limitaciones diagnósticas
En algunos individuos pueden ocurrir reacciones de prueba cutánea de tuberculina con falsos positivos o falsos negativos. (Consulte Interpretación del examen.
Se producen pruebas de reacción a la tuberculina con falsos positivos en individuos que han sido infectados con otras micobacterias, incluida la vacunación con BCG.
No todas las personas infectadas tendrán una reacción de hipersensibilidad retardada a la prueba de tuberculina.
Se ha informado que muchos factores causan una disminución de la capacidad de respuesta a la prueba de tuberculina en presencia de infección tuberculosa. (Consulte Interpretación del examen.)
Información para pacientes
Antes de la administración de Tubersol, se debe revisar el estado de salud actual del paciente y su historia clínica. El médico debe revisar el historial de vacunación del paciente para detectar la posible sensibilidad a los componentes del tubérculo.
El proveedor de atención médica debe informar al paciente de la necesidad de regresar para la lectura de la prueba. Se ha demostrado que la lectura automática de la prueba es inexacta y poco fiable.
El proveedor de atención médica debe proporcionar al paciente un registro personal permanente. Además, es esencial que el profesional de la salud registre el historial de pruebas en el registro médico permanente de cada paciente. Este registro permanente de oficina debe contener el nombre del producto, la fecha, la dosis, el fabricante y el número de lote, así como el resultado del ensayo en milímetros de induración (incluidos 0 mm, si procede). Informar de los resultados solo como negativos o positivos no es satisfactorio.
Interacciones medicamentosas
La reactividad a la prueba puede estar deprimida o suprimida en personas que reciben corticosteroides o agentes inmunosupresores. (8)
La reactividad al tubérculo puede disminuir temporalmente debido a ciertas vacunas con virus vivos (sarampión, parotiditis, rubéola, poliomielitis oral, fiebre amarilla y varicela). Si se ha administrado recientemente una vacuna parenteral de virus vivos atenuados, la prueba de tuberculina debe retrasarse para > 1 mes después de la vacunación. (8) (12) (Véase Interpretación de la prueba.)
Cuando se requiera el cribado de la tuberculina al mismo tiempo que una vacuna que contenga sarampión u otra vacuna parenteral de virus vivos atenuados, la administración simultánea de Tubersol y la vacuna en sitios separados es la opción preferida.
CARCINOGÉNESIS, MUTAGÉNESIS, ALTERACIÓN DE LA FERTILIDAD
No se ha evaluado el potencial carcinogénico o mutagénico del tubérculo ni su alteración de la fertilidad.
Embarazo
No se han realizado estudios de reproducción en animales con tubérculos. Tampoco se sabe si el tubersol puede causar daño fetal cuando se administra a una mujer embarazada o puede afectar la capacidad de reproducción. El tubersol se debe administrar a una mujer embarazada solo si es claramente necesario.
Madres lactantes
Se desconoce si el tubérculo se excreta en la leche materna. Debido a que muchos medicamentos se excretan en la leche materna, se debe tener precaución cuando se administra tubersol a una mujer lactante.
Uso pediátrico
No hay contraindicación para la prueba cutánea de tuberculina en bebés. Los bebés <de 6 meses de edad infectados con M. tuberculosis pueden no reaccionar al tubérculo. (Consulte Interpretación del examen.)
Uso geriátrico
Los ensayos clínicos de Tubersol no incluyeron un número suficiente de sujetos de 65 años o más para determinar si respondían de manera diferente a los sujetos más jóvenes.
Reacciones adversas
La induración en el lugar de inyección de tubersol es la reacción esperada para una prueba cutánea positiva. (Consulte Interpretación del examen.)
La información relativa a las reacciones adversas se ha recopilado a partir de estudios clínicos históricos y de la experiencia postcomercialización con Tubersol.
Trastornos generales y alteraciones en el lugar de administración
Dolor en el lugar de inyección, prurito en el lugar de inyección y molestias en el lugar de inyección. Eritema en el lugar de inyección o erupción en el lugar de inyección (sin induración) dentro de las 12 horas posteriores a la prueba. Estas reacciones no indican infección de tuberculosis. Hemorragia en el lugar de la inyección y hematoma en el lugar de la inyección hasta tres días después de la administración de la prueba. Vesículas en el lugar de inyección, úlcera en el lugar de inyección o necrosis en el lugar de inyección en personas muy sensibles. Cicatriz en el lugar de inyección como resultado de reacciones muy positivas. Pirexia
Trastornos del sistema inmunitario
Hipersensibilidad, incluyendo anafilaxia/reacciones anafilácticas, angioedema, urticaria
Trastornos respiratorios, torácicos y mediastínicos
Estridor, disnea
Trastornos de la piel y del tejido subcutáneo
Erupción cutánea, erupción generalizada
Trastornos del sistema nervioso
Presíncope, síncope (incluyendo síncope asociado con movimientos tónico-clónicos y otras actividades similares a convulsiones) que a veces provocan pérdida transitoria de la conciencia con lesión
Notificación de casos de Reacciones adversas
Para notificar SOSPECHAS DE REACCIONES ADVERSAS, póngase en contacto con la Farmacovigilancia Department, Sanofi Pasteur Inc., Discovery Drive, Swiftwater, PA 18370 o llame al 1-800-822-2463 (1-800-VACCINE) o al Programa MEDWATCH de la Administración de Alimentos y Medicamentos (FDA) al 1-800-332-1088 y www.fda.gov/medwatch.
Dosis y administración de tubérculos
Dosis
Cinco (5) unidades de tuberculina (TU) por dosis de prueba de 0,1 ml es la concentración estándar utilizada para la prueba intradérmica (Mantoux).
Forma de administración
El tubérculo está indicado únicamente para inyección intradérmica. No se inyecte por vía intravenosa, intramuscular o subcutánea. Si se produce una inyección subcutánea, el examen no se puede interpretar.
Inspeccionar la presencia de partículas extrañas y/o decoloración antes de su uso. Si se dan estas condiciones, no administre el producto.
Utilice una jeringa y una aguja separadas para cada inyección. (13)
Se recomienda el siguiente procedimiento para realizar la prueba de Mantoux:
- El sitio preferido de la prueba es el aspecto volar del antebrazo. Evite las áreas de la piel que estén rojas o hinchadas. Evite las venas visibles.
- Limpie el sitio de la piel con un germicida adecuado y deje que el sitio se seque antes de la inyección del antígeno.
- Administrar la dosis de prueba (0,1 ml) de tubérculo con una jeringa de 1 mL calibrada en décimas y provista de una aguja de calibre 26 o 27, de un cuarto a media pulgada, corta.
- Limpie el tapón del vial con un germicida adecuado y deje secar antes de insertar la aguja. A continuación, introduzca la aguja suavemente a través del tapón y extraiga 0,1 ml de tubérculo en la jeringa. Evite inyectar el exceso de aire con la eliminación de cada dosis para no sobre presurizar el vial y posiblemente causar filtraciones en el lugar de la punción.Insertar la punta de la aguja en las capas más superficiales de la piel con el bisel de la aguja apuntando hacia arriba y administrar la dosis mediante inyección intradérmica lenta. Si la inyección intradérmica se realiza correctamente, se elevará una gota clara en el punto de la aguja, de aproximadamente 10 mm (3/8″) de diámetro. Esta burbuja se dispersará en cuestión de minutos. No vistan el sitio.
- Puede aparecer una gota de sangre en el lugar de administración después de la inyección. Seque el sitio ligeramente para extraer la sangre, pero evite exprimir el líquido inyectado para la prueba de tuberculina.
En el caso de una inyección realizada incorrectamente (es decir, sin formación de burbujas), repita la prueba inmediatamente en otro lugar, al menos a 2 pulgadas del primer lugar y rodee el segundo lugar de inyección como indicación de que este es el lugar que debe leerse.
Informar al paciente de la necesidad de regresar para la lectura de la prueba por un profesional de la salud capacitado. La auto-lectura puede ser inexacta y está fuertemente desaconsejada.
Interpretación de la prueba
La prueba cutánea debe ser leída por un profesional de la salud capacitado de 48 a 72 horas después de la administración del tubérculo. La sensibilidad a la prueba cutánea se indica solo por induración; no se debe medir el enrojecimiento.
Medir el diámetro de la induración transversalmente al eje largo del antebrazo y registrar la medición en milímetros (incluidos 0 mm). (8) La punta de un bolígrafo, empujada suavemente en un ángulo de 45° hacia el lugar de inyección, se detendrá en el borde de la induración.
También registre la presencia y el tamaño (si está presente) de necrosis y edema, aunque estos no se utilizan en la interpretación de la prueba.
Reacciones positivas
La reactividad a la tuberculina puede indicar infección latente, infección previa y / o enfermedad con M. tuberculosis y no indica necesariamente la presencia de enfermedad tuberculosa activa. Las personas que presenten reacciones positivas a la tuberculina deben considerarse positivas según las directrices de salud pública actuales y ser remitidas para una evaluación médica adicional. (8) (10) Las pruebas repetidas a personas no infectadas no las sensibiliza al tubérculo. (7) (8) (10)
La importancia de las mediciones de induración en el diagnóstico de la infección de tuberculosis latente debe ser considerada en términos de la historia del paciente y el riesgo de desarrollar enfermedad de tuberculosis activa, como se indica en la Tabla 1. (10)
| Reacción ≥5 mm de Induración | Reacción ≥10 mm de Induración | Reacción ≥15 mm de Induración |
|---|---|---|
| * El riesgo de TB en pacientes tratados con corticosteroides aumenta con dosis más altas y mayor duración. † Para las personas que, por lo demás, tienen un riesgo bajo y se someten a pruebas al inicio del empleo, se considera positiva una reacción de induración ≥15 mm. | ||
| Personas VIH positivas Contactos recientes de pacientes con casos de tuberculosis (TB) Cambios fibróticos en la radiografía de tórax consistentes con TB previa Pacientes con trasplantes de órganos y otros pacientes inmunodeprimidos (que recibieron el equivalente de ≥15 mg/día de prednisona durante 1 mes o más)* |
Inmigrantes recientes (es decir, dentro de los últimos 5 años) de países de alta prevalencia Consumidores de drogas inyectables Residentes o empleados† de los siguientes entornos congregados de alto riesgo: prisiones y cárceles, hogares de ancianos y otras instalaciones a largo plazo para ancianos, hospitales y otras instalaciones de atención médica, instalaciones residenciales para pacientes con síndrome de inmunodeficiencia adquirida (SIDA) y refugios para personas sin hogar Personal de laboratorio de micobacteriología Personas con las siguientes afecciones clínicas que los colocan en alto riesgo: silicosis, diabetes mellitus, insuficiencia renal crónica, algunos trastornos hematológicos (por ejemplo, leucemias y linfomas), otras neoplasias malignas específicas (por ej. carcinoma de cabeza , cuello y pulmón), pérdida de peso ≥10% del peso corporal ideal, gastrectomía y derivación yeyunoileal Niños menores de 4 años o bebés, niños y adolescentes expuestos a adultos de alto riesgo |
Personas sin factores de riesgo de tuberculosis |
Una conversión TST se define como un aumento de ≥10 mm de induración en un período de 2 años, independientemente de la edad. (10)
Debe considerarse la posibilidad de que la sensibilidad de la prueba cutánea también pueda deberse a un contacto previo con micobacterias atípicas o a una vacunación previa con BCG. (8) (10)
Reacciones negativas
Un individuo que no muestra una reacción positiva a 5 TU en la primera prueba, pero se sospecha que es TB positiva, puede volver a realizarse la prueba con 5 TU. (Consulte Efecto de Refuerzo y Pruebas en Dos Pasos.) Cualquier individuo que no muestre una reacción positiva a una inyección inicial de 5 TU, o a una segunda prueba con 5 TU, puede considerarse como tuberculina negativa.
Reacciones falsas positivas
Las reacciones falsas positivas a la tuberculina pueden ocurrir en individuos que han sido infectados con otras micobacterias, incluida la vacunación con BCG. (8) Sin embargo, se debe considerar el diagnóstico de infección por M. tuberculosis y el uso de terapia preventiva para cualquier persona vacunada con BCG que tenga una reacción positiva a la PT, especialmente si la persona ha corrido o corre un mayor riesgo de contraer la infección de tuberculosis. (Ver INDICACIONES Y USO.) (14) (15)
Reacciones negativas falsas
No todas las personas infectadas tendrán una reacción de hipersensibilidad retardada a una prueba de tuberculina.
En las personas de edad avanzada o en las que se realizan pruebas por primera vez, las reacciones pueden desarrollarse lentamente y no alcanzar su punto máximo hasta después de 72 horas.
Dado que la sensibilidad a la tuberculina puede tardar hasta 8 semanas en desarrollarse después de la exposición a M. tuberculosis (ver Mecanismo de acción), las personas que tengan un resultado negativo en la prueba de tuberculina <8 semanas después de una posible exposición a la tuberculosis deben volver a hacerse la prueba ≥8-10 semanas después de la última exposición conocida o sospechada. (16)
Alteración del estado inmunitario
La inmunidad mediada por células deterioradas o atenuadas (IMC) puede causar potencialmente una reacción de tuberculina falsa negativa. Se han notificado muchos factores que causan una disminución de la capacidad de respuesta a la prueba de la tuberculina en presencia de infección tuberculosa, incluidas infecciones virales (p. ej., sarampión, paperas, varicela y VIH), vacunas con virus vivos (p. ej. sarampión, paperas, rubéola, polio oral y fiebre amarilla), tuberculosis abrumadora, otras infecciones bacterianas, leucemia, sarcoidosis, infecciones fúngicas, trastornos metabólicos, estados bajos en proteínas, enfermedades que afectan a los órganos linfoides, medicamentos (corticosteroides y muchos otros agentes inmunosupresores) y neoplasias malignas o estrés. (8) (17) (18) Debe aplazarse una PT para los pacientes con infecciones virales importantes o vacunación con virus vivos en el último mes. A las personas con resfriado común se les puede hacer la prueba de tuberculina.
Debido a que los resultados de la PT en individuos infectados por el VIH son menos confiables a medida que disminuyen los recuentos de CD4, los exámenes de detección se deben completar lo antes posible después de que se produzca la infección por el VIH. (18)
Efecto de refuerzo y pruebas en dos fases
Si la prueba de la tuberculina se realiza a intervalos regulares, por ejemplo entre trabajadores sanitarios o de prisiones, se debe realizar una prueba en dos fases como referencia para evitar interpretar un efecto de refuerzo como una conversión de la tuberculina. Si la primera prueba no mostró reacción o una reacción pequeña, la segunda prueba se debe realizar de una a cuatro semanas después. Ambas pruebas deben leerse y grabarse a las 48 a 72 horas. Se debe considerar que los pacientes con una segunda respuesta a la prueba de tuberculina (refuerzo) de ≥10 mm han experimentado infección de tuberculosis en el pasado. (14) (19)
Se debe considerar que las personas que no reciben dosis de refuerzo cuando se les hacen pruebas repetidas a la semana, pero cuyas reacciones a la tuberculina cambian a positivas al cabo de un año, tienen una infección tuberculosa recién adquirida y se les debe tratar en consecuencia. (7)
Cómo se suministra el Tubérculo
Derivado Proteico Purificado de Tuberculina de Tubérculo (Mantoux), bioequivalente a 5 unidades estadounidenses (TU) PPD-S por dosis de prueba (0.1 mL) se suministra en:
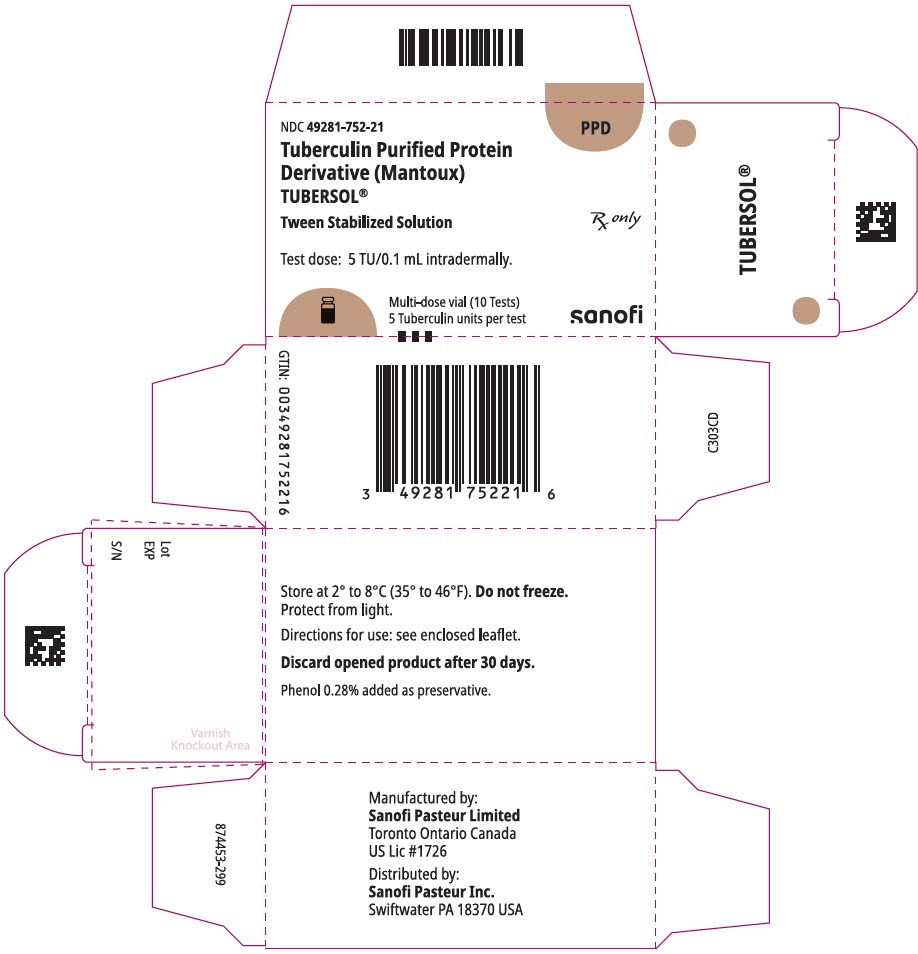
vial multidosis de 1 mL (10 pruebas). NDC No 49281-752-78; paquete de 1 vial, NDC No 49281-752-21
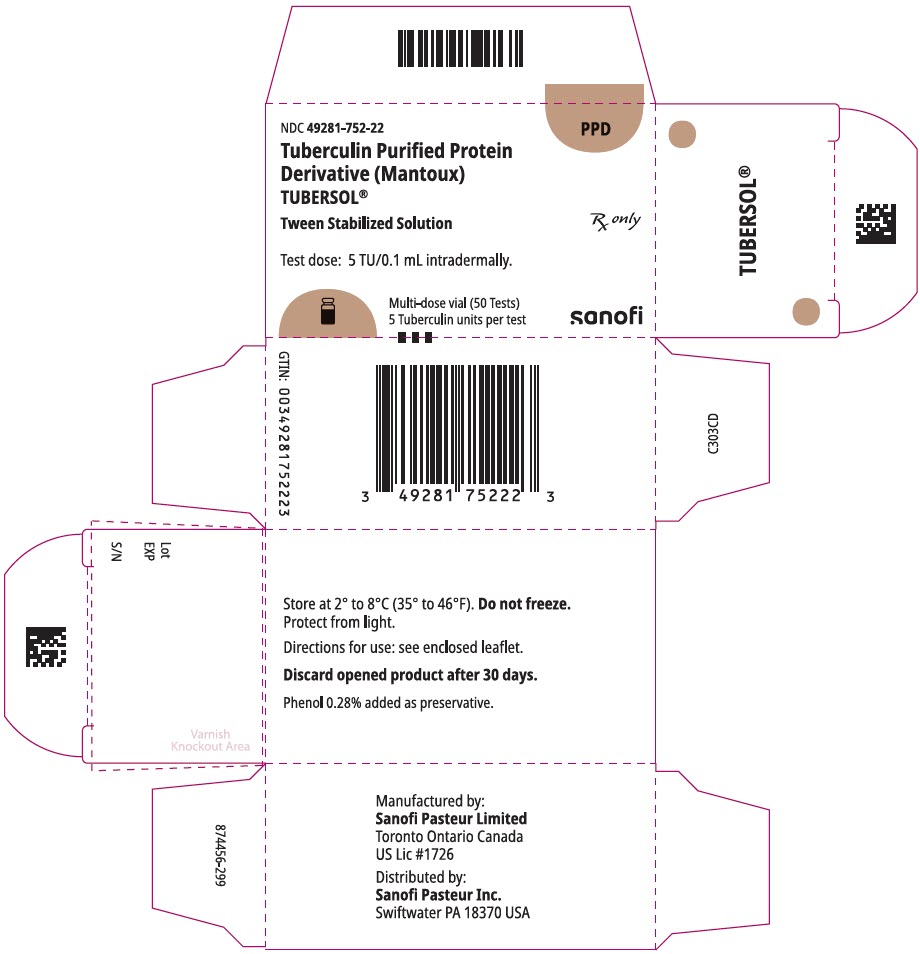
Vial multidosis de 5 mL (50 pruebas). NDC No. 49281-752-98; paquete de 1 vial, NDC No. 49281-752-22
El tapón del vial para este producto no contiene caucho de látex natural.
ALMACENAMIENTO
Conservar entre 2° y 8°C (de 35° a 46 ° F). (20) no congelar. Deseche el producto si se expone a la congelación.
Proteger de la luz. Las soluciones de tuberculina PPD pueden verse afectadas negativamente por la exposición a la luz. El producto debe conservarse en la oscuridad, excepto cuando se extraigan dosis del vial. (21)
Debe desecharse un vial de tubérculo que se haya introducido y esté en uso durante 30 días. (22)
No usar después de la fecha de caducidad.
1 Landi S. Preparación, purificación y estabilidad de la tuberculina. Appl Microbiol 1963; 11: 408-412. 2 Landi S, et al. Preparación y caracterización de un lote grande de derivado proteico purificado de tuberculina (PPD-CT68). Ann Scalvo.1980;22:889-907. 3 Código de Regulaciones Federales de los Estados Unidos, Título 21, Parte 610, Subparte C – Preparaciones estándar y límites de potencia. 4 Landi S, et al. Adsorción de tuberculina PPD a superficies de vidrio y plástico. Toro. WHO 1966; 35: 593-602. 5 Landi S, et al. Disparidad de potencia entre soluciones de tuberculina diluidas estabilizadas y no estabilizadas. Am Rev Respir Dis 1971;104:385-393. 6 Landi S, et al. Estabilidad de soluciones diluidas de derivado proteico purificado de tuberculina. Tubercle 1978; 59: 121-133. 7 Menzies D. Interpretación de las pruebas de tuberculina repetidas. Am J Respir Crit Care Med 1999; 159:15-21. 8 American Thoracic Society: Estándares de diagnóstico y clasificación de la tuberculosis en adultos y niños. Am J Respir Crit Care Med 2000; 161: 1376-1395. 9 CDC. Pautas Actualizadas para el Uso de Ensayos de Liberación de Interferón Gamma para Detectar la Infección por Mycobacterium tuberculosis – Estados Unidos, 2010. MMWR 2010; 59 (RR-5): 1-25. 10 CDC. Pruebas de tuberculina específicas y tratamiento de la infección tuberculosa latente. MMWR 2000; 49(RR-6): 23-5. 11 Froeschle JE, et al. Reacciones de hipersensibilidad inmediatas tras el uso de pruebas cutáneas de tuberculina. Clin Infect Dis 2002; 34: e12-13. 12 Brickman HF, et al. El calendario de las pruebas de tuberculina en relación con la inmunización con vacunas víricas vivas. Pediatrics: 1975; 55: 392-396. 13 CDC. Recomendaciones generales sobre inmunización: recomendaciones del Comité Asesor sobre Prácticas de Inmunización (ACIP) y de la Academia Americana de Médicos de Familia (AAFP). MMWR 2002; 51 (RR-2): 1-36. 14 CDC. Guidelines for preventing the transmission of Mycobacterium tuberculosis in health-care settings, 2005. MMWR 2005; 54 (RR-17): 1-141. 15 CDC. El papel de la vacuna BCG en la prevención y el control de la tuberculosis en los Estados Unidos. Declaración conjunta del Consejo Asesor para la Eliminación de la Tuberculosis y el Comité Asesor sobre Prácticas de Inmunización. MMWR 1996; 45 (RR-4): 1-18. 16 CDC. Guidelines for the Investigation of Contacts of Persons with Infectious Tuberculosis: Recommendations from the National Tuberculosis Controllers Association and CDC. MMWR 2005; 54(RR-15): 1-37. 17 Mori y Shiozawa. Supresión de la hipersensibilidad a la tuberculina causada por la infección por rubéola. Am Rev Respir Dis 1985; 886-888. 18 CDC. Directrices para la prevención y el tratamiento de las infecciones oportunistas en adultos y adolescentes infectados por el VIH. Recomendaciones de los CDC, los Institutos Nacionales de la Salud y la Sociedad Americana de Enfermedades Infecciosas de la Asociación de Medicina del VIH. MMWR 2009; 58 (RR-4): 1-207. 19 CDC. Prevention and control of tuberculosis in correctional and detention facilities: Recommendations from the CDC. MMWR 2006; 55(RR-9): 1-44. 20 Landi S, et al. Estabilidad de la solución diluida de derivado proteico purificado de tuberculina a temperaturas extremas. J Biol Stand 1981; 9: 195-199. 21 Landi S, et al. Efecto de la luz sobre las soluciones de derivados proteicos purificados de tuberculina. Am Rev Respir Dis 1975; 111: 52-61. 22 Landi S, et al. Effect of oxidation on the stability of tuberculin purified protein derivative (PPD) In: International Symposium on Tuberculins and BCG Vaccine. Basilea: Asociación Internacional de Normalización Biológica, 1983. Dev Biol Stand 1986; 58: 545-552.
Fabricado por:
Sanofi Pasteur Limited
Toronto Ontario Canada
Distribuido por:
Sanofi Pasteur Inc.
Swiftwater PA 18370 USA
Información del producto a partir de
Noviembre de 2020
PANEL DE VISUALIZACIÓN PRINCIPAL – Etiqueta del vial de 1 mL
Purificado de tuberculina
Derivado de proteína
(Mantoux)
Tubersol®
Vial multidosis
1 mL (10 Pruebas)
Dosis de prueba: 5 TU/0,1 ml ID.
Proteger de la luz.
Desechar el producto abierto después de 30 días.
Solo Rx
Sanofi Pasteur Limited
Fecha de apertura

PANEL DE VISUALIZACIÓN PRINCIPAL – Caja del vial de 1 mL
NDC 49281-752-21
PPD
Proteína purificada de tuberculina
Derivado (Mantoux)
Tubersol®
Solución Estabilizada por interpolación
Vial multidosis 10 Pruebas 5 TU
Rx solamente
Dosis de prueba: 5 TU/0,1 mL intradérmica.
Bio-equivalente a 5 unidades estadounidenses (TU) de PPD-S
SANOFI PASTEUR
PANEL DE VISUALIZACIÓN PRINCIPAL – Etiqueta del Vial de 5 mL
Proteína Purificada de Tuberculina
Derivado (Mantoux)
Tubersol®
Vial multidosis
5 mL (50 Pruebas)
Dosis de prueba: 5 TU/0,1 ml ID.
sólo Rx
Proteger de la luz.
Desechar el producto abierto después de 30 días.
Sanofi Pasteur Limited
Fecha de apertura

PANEL DE VISUALIZACIÓN PRINCIPAL – Caja del vial de 5 mL
NDC 49281-752-22
PPD
Proteína purificada de tuberculina
Derivado (Mantoux)
Tubersol®
Solución estabilizada con interpolación
Vial multidosis 50 Pruebas 5 TU
Rx solamente
Dosis de prueba: 5 TU / 0,1 mL por vía intradérmica.
Bio-equivalent to 5 US units (TU) of PPD-S
SANOFI PASTEUR
| Tubersol tuberculin purified protein derivative injection, solution |
|||||||||||||||||||
|
|||||||||||||||||||
|
|||||||||||||||||||
|
|||||||||||||||||||
|
|||||||||||||||||||
|
|||||||||||||||||||
|
|||||||||||||||||||
Labeler – Sanofi Pasteur Inc. (086723285)
| Establishment | |||
| Name | Address | ID/FEI | Operations |
| Sanofi Pasteur Limited | 208206623 | MANUFACTURE(49281-752) | |
Más información sobre el tubérculo (Derivado de proteína purificada de tuberculina)
- Efectos secundarios
- Lactancia materna
- Información de dosificación
- Interacciones con medicamentos
- Precios & Cupones
- Clase de medicamentos: Productos biológicos de diagnóstico in vivo
- Lectura avanzada
Recursos profesionales
- Información de prescripción
Otras marcas Aplisol
Guías de tratamiento relacionadas
- Diagnóstico e Investigación
Descargo de responsabilidad médico