Nom générique: dérivé protéique purifié à la tuberculine
Forme posologique: injection, solution
Revue médicale par Drugs.com . Dernière mise à jour le 1 novembre 2020.
- Aperçu
- Effets secondaires
- Posologie
- Professionnel
- Interactions
- Plus
Catégorie AHFS: 36:84
Rx uniquement
Antigène diagnostique
(Aide à la détection de l’infection par Mycobacterium tuberculosis)
POUR UTILISATION INTRADERMIQUE
Solution stabilisée de Polysorbate 80 de Dérivé Protéique Purifié à la Tuberculine pour le Test de la Tuberculine chez l’Homme
Description du Tubersol
Dérivé Protéique Purifié à la Tuberculine Tubersol® (Mantoux) (PPD) (1) pour la tuberculine intradermique l’essai est préparé à partir d’un grand lot maître de tuberculine Connaught (CT68) (2) et est une fraction protéique purifiée sans cellules obtenue à partir d’une souche humaine de Mycobacterium tuberculosis cultivée sur une milieu synthétique sans protéines et inactivé. (2) L’utilisation d’une préparation standard dérivée d’un seul lot (CT68) a été adoptée afin d’éliminer les variations de lot en lot par le même fabricant. (2)
Le tubersol est un liquide clair et incolore.
| Le tubercule contient: | |
| Dérivé protéique purifié de M. tuberculosis | 5 TU par 0.1 mL |
| Polysorbate 80 | 0.0006% |
| Phenol | 0.22% to 0.35% w/v |
| in sterile isotonic phosphate buffered saline. | |
Before release, each successive lot is tested for potency in comparison with the US Standard Tuberculin PPD-S. (3)
Des études indépendantes menées par le Service de santé publique des États-Unis chez l’homme ont déterminé la quantité de CT68 en solution stabilisée nécessaire (4) (5) (6) pour produire une bio-équivalence avec la tuberculine PPD-S (dans un tampon phosphate sans polysorbate 80) en utilisant 5 unités américaines (TU) Tuberculine PPD-S comme étalon.
Tubersol – Pharmacologie clinique
Mécanisme d’action
La sensibilisation à la suite d’une infection par des mycobactéries se produit principalement dans les ganglions lymphatiques régionaux. Les petits lymphocytes (lymphocytes T) prolifèrent en réponse au stimulus antigénique pour donner naissance à des lymphocytes spécifiquement sensibilisés. Après 3 à 8 semaines, ces lymphocytes pénètrent dans la circulation sanguine et circulent pendant des années. (7) La restimulation ultérieure de ces lymphocytes sensibilisés avec le même antigène ou un antigène similaire, telle que l’injection intradermique de Tubersol, évoque une réaction locale médiée par ces cellules. (8)
De manière caractéristique, les réactions d’hypersensibilité retardée à la tuberculine commencent à 5 à 6 heures, sont maximales à 48 à 72 heures et disparaissent sur une période de jours. La réponse immunitaire qui en résulte consiste en une induration due à une infiltration cellulaire et parfois à une vésiculation et à une nécrose. Cliniquement, une réaction d’hypersensibilité retardée à la tuberculine est une manifestation d’une infection antérieure par la tuberculose M ou une variété de bactéries non tuberculeuses. Dans la plupart des cas, la sensibilisation est induite par une infection mycobactérienne naturelle ou par la vaccination avec le vaccin BCG.
Indications et utilisation du Tubersol
Le dérivé protéique purifié de Tubersol Tuberculin (Mantoux) est indiqué pour faciliter le diagnostic de l’infection tuberculeuse (TB) chez les personnes à risque accru de développer une maladie active.
Les Centers for Disease Control and Prevention (CDC) ont publié des lignes directrices concernant les populations qui bénéficieraient du test cutané à la tuberculine (TST). Les recommandations actuelles peuvent être consultées à l’adresse suivante : http://www.cdc.gov/tb/publications/factsheets/testing.htm.
La vaccination antérieure au BCG n’est pas une contre-indication au test tuberculinique. Les résultats des tests cutanés des personnes vaccinées au BCG peuvent être utilisés pour étayer ou exclure le diagnostic d’infection tuberculeuse. Cependant, un test de libération d’interféron gamma approuvé par la FDA est préféré au test cutané à la tuberculine pour les personnes de 5 ans et plus qui ont déjà été vaccinées avec le BCG. (9)
Contre-indications
Une allergie à un composant du Tubersol ou une réaction anaphylactique ou autre allergique à un test antérieur de tuberculine PPD est une contre-indication à l’utilisation du Tubersol. (Voir DESCRIPTION et COMMENT FOURNI.)
Le tubersol ne doit pas être administré à:
- Personnes ayant eu une réaction sévère (par exemple, nécrose, cloques, choc anaphylactique ou ulcérations) à un TCT antérieur,
- Personnes ayant une tuberculose active documentée ou des antécédents clairs de traitement pour une infection ou une maladie tuberculeuse, (10)
- Personnes souffrant de brûlures étendues ou d’eczéma.
Avertissements
Hypersensibilité
Des réactions allergiques peuvent survenir après l’utilisation de Tubersol, même chez les personnes n’ayant pas d’antécédents d’hypersensibilité aux composants du produit. (11) Injection d’épinéphrine (1:1 000) et d’autres agents appropriés utilisés pour le contrôle des réactions allergiques immédiates doivent être immédiatement disponibles.
Syncope
Une syncope (évanouissement) peut survenir en association avec l’administration de médicaments injectables, y compris le Tubersol. Des procédures doivent être en place pour éviter les blessures par chute et rétablir la perfusion cérébrale après une syncope.
Précautions
Généralités
Limites diagnostiques
Des réactions au test cutané à la tuberculine faussement positives ou faussement négatives peuvent survenir chez certaines personnes. (Voir Interprétation du test.)
Des tests de réaction à la tuberculine faussement positifs surviennent chez des personnes infectées par d’autres mycobactéries, y compris la vaccination par le BCG.
Toutes les personnes infectées n’auront pas une réaction d’hypersensibilité retardée à un test à la tuberculine.
De nombreux facteurs ont été rapportés pour entraîner une diminution de la capacité de réponse au test tuberculinique en présence d’une infection tuberculeuse. (Voir Interprétation du test.)
Information pour les patients
Avant l’administration de Tubersol, l’état de santé actuel du patient et ses antécédents médicaux doivent être examinés. Le médecin doit examiner les antécédents vaccinaux du patient pour déterminer s’il est possible qu’il soit sensible aux composants du tubercule.
Le fournisseur de soins de santé doit informer le patient de la nécessité de revenir pour la lecture du test. L’auto-lecture du test s’est avérée inexacte et peu fiable.
Le fournisseur de soins de santé doit remettre au patient un dossier personnel permanent. De plus, il est essentiel que le professionnel de la santé enregistre l’historique des tests dans le dossier médical permanent de chaque patient. Ce registre permanent doit contenir le nom du produit, la date d’administration, la dose, le fabricant et le numéro de lot, ainsi que le résultat du test en millimètres d’induration (y compris 0 mm, le cas échéant). Déclarer les résultats uniquement comme négatifs ou positifs n’est pas satisfaisant.
Interactions médicamenteuses
La réactivité au test peut être diminuée ou supprimée chez les personnes recevant des corticostéroïdes ou des agents immunosuppresseurs. (8)
La réactivité au tubercule peut être temporairement réduite par certains vaccins à virus vivants (rougeole, oreillons, rubéole, poliomyélite orale, fièvre jaune et varicelle). Si un vaccin parentéral à virus vivant atténué a été administré récemment, le test tuberculinique doit être retardé > 1 mois après la vaccination. (8) (12) (Voir l’interprétation du test.)
Lorsque le dépistage de la tuberculine est nécessaire en même temps qu’un vaccin contenant la rougeole ou un autre vaccin à virus vivant atténué parentéral, l’administration simultanée de Tubérol et du vaccin à des sites distincts est l’option privilégiée.
CARCINOGENÈSE, MUTAGÉNÈSE, ALTÉRATION DE LA FERTILITÉ
Le tubérol n’a pas été évalué pour ses potentiels cancérigènes ou mutagènes ni pour son altération de la fertilité.
Grossesse
Aucune étude de reproduction chez l’animal n’a été menée avec le Tubersol. On ne sait pas non plus si le tubersol peut causer des dommages fœtaux lorsqu’il est administré à une femme enceinte ou peut affecter la capacité de reproduction. Le tubersol ne doit être administré à une femme enceinte que si cela est clairement nécessaire.
Mères allaitantes
On ne sait pas si le tubercule est excrété dans le lait maternel. Étant donné que de nombreux médicaments sont excrétés dans le lait maternel, des précautions doivent être prises lorsque le Tubersol est administré à une femme qui allaite.
Usage pédiatrique
Il n’y a pas de contre-indication aux tests cutanés à la tuberculine chez les nourrissons. Les nourrissons < âgés de 6 mois infectés par M. tuberculosis peuvent ne pas réagir au tubercule. (Voir Interprétation du test.)
Utilisation gériatrique
Les études cliniques de Tubersol n’ont pas inclus un nombre suffisant de sujets âgés de 65 ans et plus pour déterminer s’ils répondent différemment des sujets plus jeunes.
Effets indésirables
L’induration au site d’injection de Tuberosol est la réaction attendue pour un test cutané positif. (Voir Interprétation du test.)
Les informations relatives aux événements indésirables ont été compilées à partir d’études cliniques historiques et d’expériences post-commercialisation avec le Tubersol.
Troubles généraux et conditions au site d’administration
Douleur au site d’injection, prurit au site d’injection et inconfort au site d’injection. Érythème au site d’injection ou éruption cutanée au site d’injection (sans induration) survenant dans les 12 heures suivant le test. Ces réactions n’indiquent pas une infection tuberculeuse. Hémorragie au site d’injection et hématome au site d’injection jusqu’à trois jours après l’administration du test. Vésicules au site d’injection, ulcère au site d’injection ou nécrose au site d’injection chez les personnes hautement sensibles. Cicatrice au site d’injection à la suite de réactions fortement positives. Pyrexie
Troubles du système immunitaire
Hypersensibilité, y compris anaphylaxie / réactions anaphylactiques, œdème de Quincke, urticaire
Troubles respiratoires, thoraciques et médiastinaux
Stridor, dyspnée
Troubles de la peau et des tissus sous-cutanés
Éruption cutanée, éruption généralisée
Troubles du système nerveux
Présyncope, syncope (y compris syncope associée à des mouvements tonico-cloniques et à d’autres activités convulsives) entraînant parfois une perte de conscience transitoire avec blessure
Déclaration des effets indésirables
Pour signaler les EFFETS INDÉSIRABLES SUSPECTÉS, contactez la Pharmacovigilance Département, Sanofi Pasteur Inc., Discovery Drive, Swiftwater, PA 18370 ou appelez le 1-800-822-2463 (1-800- VACCINE) ou le programme MEDWATCH de la Food and Drug Administration (FDA) au 1-800-332-1088 et www.fda.gov/medwatch .
Dosage et administration du tubercule
Dosage
Cinq (5) unités de tuberculine (TU) par dose d’essai de 0,1 mL est la concentration standard utilisée pour les tests intradermiques (Mantoux).
Mode d’administration
Le Tubersol est indiqué uniquement pour l’injection intradermique. Ne pas injecter par voie intraveineuse, intramusculaire ou sous-cutanée. En cas d’injection sous-cutanée, le test ne peut pas être interprété.
Inspecter les particules étrangères et/ou les décolorations avant utilisation. Si ces conditions existent, ne pas administrer le produit.
Utilisez une seringue et une aiguille séparées pour chaque injection. (13)
La procédure suivante est recommandée pour effectuer le test de Mantoux:
- Le site préféré du test est l’aspect volar de l’avant-bras. Évitez les zones rouges ou enflées sur la peau. Évitez les veines visibles.
- Nettoyez le site cutané avec un germicide approprié et laissez le site sécher avant l’injection de l’antigène.
- Administrer la dose d’essai (0,1 mL) de Tuberosol à l’aide d’une seringue de 1 mL calibrée en dixièmes et munie d’une aiguille courte d’un quart à un demi-pouce de calibre 26 ou 27.
- Essuyez le bouchon du flacon avec un germicide approprié et laissez sécher avant l’insertion de l’aiguille. Ensuite, insérez doucement l’aiguille dans le bouchon et aspirez 0,1 mL de tubérol dans la seringue. Évitez l’injection d’air en excès avec l’élimination de chaque dose afin de ne pas trop pressuriser le flacon et éventuellement provoquer une infiltration au site de ponction.
- Insérez la pointe de l’aiguille dans les couches les plus superficielles de la peau, le biseau de l’aiguille pointant vers le haut et administrez la dose par injection intradermique lente. Si l’injection intradermique est effectuée correctement, un bleb pâle défini s’élèvera à la pointe de l’aiguille, d’environ 10 mm (3/8 « ) de diamètre. Ce bleb se dispersera en quelques minutes. Ne pas habiller le site.
- Une goutte de sang peut apparaître au site d’administration après l’injection. Épongez légèrement le site pour enlever le sang, mais évitez d’extraire le liquide de test à la tuberculine injecté.
En cas d’injection mal effectuée (c’est-à-dire qu’il n’y a pas de bleb formé), répéter immédiatement le test à un autre site, à au moins 2 pouces du premier site et entourer le deuxième site d’injection pour indiquer qu’il s’agit du site à lire.
Informer le patient de la nécessité de revenir pour la lecture du test par un professionnel de santé qualifié. L’auto-lecture peut être inexacte et est fortement déconseillée.
Interprétation du test
Le test cutané doit être lu par un professionnel de la santé qualifié 48 à 72 heures après l’administration de Tubersol. La sensibilité au test cutané est indiquée uniquement par induration; la rougeur ne doit pas être mesurée.
Mesurez le diamètre d’induration transversalement au grand axe de l’avant-bras et enregistrez la mesure en millimètres (dont 0 mm). (8) La pointe d’un stylo à bille, doucement poussée à un angle de 45 ° vers le site d’injection, s’arrêtera au bord de l’induration.
Notez également la présence et la taille (le cas échéant) de la nécrose et de l’œdème, bien que ceux-ci ne soient pas utilisés dans l’interprétation du test.
Réactions positives
La réactivité de la tuberculine peut indiquer une infection latente, une infection antérieure et/ ou une maladie avec M. tuberculosis et n’indique pas nécessairement la présence d’une maladie tuberculeuse active. Les personnes présentant des réactions positives à la tuberculine doivent être considérées comme positives par les directives de santé publique en vigueur et référées pour une évaluation médicale plus approfondie. (8) (10) Les tests répétés sur des personnes non infectées ne les sensibilisent pas au tuberosol. (7) (8) (10)
L’importance des mesures d’induration dans le diagnostic de l’infection tuberculeuse latente doit être prise en compte en fonction des antécédents du patient et du risque de développer une TB active, comme indiqué dans le tableau 1. (10)
| Réaction ≥5 mm d’Induration | Réaction ≥10 mm d’induration | div>Réaction ≥15 mm d’induration |
|---|---|---|
| * Le risque de tuberculose chez les patients traités par corticostéroïdes augmente avec une dose plus élevée et une durée plus longue. † Pour les personnes qui présentent par ailleurs un faible risque et qui sont testées au début de l’emploi, une réaction d’induration ≥15 mm est considérée comme positive. | ||
| Personnes séropositives Contacts récents de patients atteints de tuberculose Modifications fibrotiques à la radiographie thoracique compatibles avec une tuberculose antérieure Patients ayant subi une transplantation d’organe et d’autres patients immunodéprimés (recevant l’équivalent de ≥15 mg/j de prednisone pendant 1 mois ou plus)* |
/td> | Immigrants récents (c.-à-d. au cours des 5 dernières années) provenant de pays à forte prévalence Utilisateurs de drogues injectables Résidents ou employés† des milieux de rassemblement à haut risque suivants: prisons et prisons, maisons de retraite et autres établissements de longue durée pour personnes âgées, hôpitaux et autres établissements de santé, établissements d’hébergement pour patients atteints du syndrome d’immunodéficience acquise (SIDA) et refuges pour sans-abri Personnel de laboratoire de mycobactériologie Personnes présentant les conditions cliniques suivantes qui les exposent à un risque élevé: silicose, diabète sucré, insuffisance rénale chronique, certains troubles hématologiques (par ex. leucémies et lymphomes), d’autres tumeurs malignes spécifiques (par ex., carcinome de la tête ou du cou et des poumons), perte de poids ≥10% du poids corporel idéal, gastrectomie et pontage jéjunoiléal Enfants de moins de 4 ans ou nourrissons, enfants et adolescents exposés à des adultes à haut risque |
Personnes sans facteur de risque de tuberculose |
Une conversion TST est définie comme une augmentation de ≥10 mm d’induration sur une période de 2 ans, quel que soit l’âge. (10)
La possibilité doit être envisagée que la sensibilité au test cutané puisse également être due à un contact antérieur avec des mycobactéries atypiques ou à une vaccination antérieure au BCG. (8) (10)
Réactions négatives
Une personne qui ne présente pas de réaction positive à 5 TU lors du premier test, mais qui est soupçonnée d’être TB positive, peut être de nouveau testée avec 5 TU. (Voir Effet de rappel et Test en deux étapes.) Toute personne qui ne présente pas de réaction positive à une injection initiale de 5 TU, ou à un deuxième test avec 5 TU peut être considérée comme tuberculinique négative.
Réactions faussement positives
Des réactions tuberculiniques faussement positives peuvent survenir chez les personnes infectées par d’autres mycobactéries, y compris la vaccination par le BCG. (8) Cependant, un diagnostic d’infection à M. tuberculosis et l’utilisation d’un traitement préventif doivent être envisagés pour toute personne vaccinée au BCG qui présente une réaction positive au TST, en particulier si la personne a été ou présente un risque accru de contracter une infection tuberculeuse. (Voir INDICATIONS ET UTILISATION.) (14) (15)
Réactions faussement négatives
Toutes les personnes infectées n’auront pas une réaction d’hypersensibilité retardée à un test tuberculinique.
Chez les personnes âgées ou celles qui sont testées pour la première fois, les réactions peuvent se développer lentement et ne culminer qu’après 72 heures.
Étant donné que la sensibilité à la tuberculine peut prendre jusqu’à 8 semaines pour se développer après une exposition à M. tuberculosis (voir Mécanisme d’action), les personnes qui ont un test tuberculinique négatif <8 semaines après une éventuelle exposition à la tuberculose doivent subir un nouveau test ≥8 à 10 semaines après la dernière exposition connue ou suspectée. (16)
Statut immunitaire altéré
Une immunité à médiation cellulaire altérée ou atténuée (IMC) peut potentiellement provoquer une réaction tuberculinique faussement négative. De nombreux facteurs ont été signalés comme entraînant une diminution de la capacité de réponse au test tuberculinique en présence d’une infection tuberculeuse, y compris des infections virales (p. ex., rougeole, oreillons, varicelle et VIH), des vaccinations à virus vivants (p. ex., rougeole, oreillons, rubéole, poliomyélite orale et fièvre jaune), tuberculose écrasante, autres infections bactériennes, leucémie, sarcoïdose, infections fongiques, troubles métaboliques, états à faible teneur en protéines, maladies affectant les organes lymphoïdes, médicaments (corticostéroïdes et de nombreux autres agents immunosuppresseurs) et malignité ou stress. (8) (17) (18) Un TCT devrait être différé pour les patients atteints d’infections virales majeures ou d’une vaccination à virus vivants au cours du mois écoulé. Les personnes atteintes du rhume peuvent être testées à la tuberculine.
Comme les résultats du TST chez les personnes infectées par le VIH sont moins fiables à mesure que le nombre de CD4 diminue, le dépistage doit être effectué le plus tôt possible après l’infection par le VIH. (18)
Effet de rappel et test en deux étapes
Si le test à la tuberculine est effectué à intervalles réguliers, par exemple chez le personnel de santé ou le personnel pénitentiaire, un test en deux étapes doit être effectué comme référence pour éviter d’interpréter un effet de rappel comme une conversion à la tuberculine. Si le premier test n’a montré aucune réaction ou une petite réaction, le deuxième test doit être effectué une à quatre semaines plus tard. Les deux tests doivent être lus et enregistrés entre 48 et 72 heures. Les patients dont la réponse au second test tuberculinique (rappel) est ≥10 mm doivent être considérés comme ayant déjà été infectés par la tuberculose. (14) (19)
Les personnes qui n’augmentent pas lorsqu’elles subissent des tests répétés à une semaine, mais dont les réactions à la tuberculine deviennent positives après un an, doivent être considérées comme ayant une infection tuberculeuse nouvellement acquise et prises en charge en conséquence. (7)
Comment le Tubersol est-il fourni
Dérivé protéique purifié de la tuberculine de Tubersol (Mantoux), bioéquivalent à 5 unités US (TU) PPD-S par dose d’essai (0.1 mL) est fourni dans :
Flacon multidose de 1 mL (10 tests). NDC N° 49281-752-78; emballage de 1 flacon, NDC n° 49281-752-21
Flacon multidose de 5 mL (50 essais). NDC N° 49281-752-98; emballage de 1 flacon, NDC N° 49281-752-22
Le bouchon du flacon de ce produit ne contient pas de caoutchouc latex naturel.
STOCKAGE
Conserver entre 2 et 8 °C (35 et 46 °F). (20) Ne pas congeler. Jeter le produit s’il est exposé à la congélation.
Protéger de la lumière. Les solutions de PPD à la tuberculine peuvent être affectées par l’exposition à la lumière. Le produit doit être conservé dans l’obscurité, sauf lorsque les doses sont effectivement retirées du flacon. (21)
Un flacon de tubérol entré et utilisé pendant 30 jours doit être jeté. (22)
Ne pas utiliser après la date de péremption.
1 Landi S. Préparation, purification et stabilité de la tuberculine. Appl Microbiol 1963; 11:408-412. 2 Landi S, et coll. Préparation et caractérisation d’un grand lot de dérivé protéique purifié à la tuberculine (PPD-CT68). Ann Scalvo.1980;22:889-907. 3 US Code of Federal Regulations, Titre 21, Partie 610, Sous-partie C – Préparations standard et limites de puissance. 4 Landi S, et coll. Adsorption de la tuberculine PPD sur les surfaces en verre et en plastique. Taureau. OMS 1966; 35:593-602. 5 Landi S, et al. Disparité de puissance entre les solutions diluées de tuberculine stabilisées et non stabilisées. Am Rev Respir Dis 1971; 104:385-393. 6 Landi S, et al. Stabilité des solutions diluées de dérivé protéique purifié à la tuberculine. Tubercule 1978; 59:121-133. 7 Menzies D. Interprétation des tests tuberculiniques répétés. Am J Respir Crit Care Med 1999; 159:15-21. 8 American Thoracic Society: Normes diagnostiques et classification de la tuberculose chez les adultes et les enfants. Am J Respir Crit Care Med 2000; 161: 1376-1395. 9 CDC. Lignes directrices actualisées pour l’utilisation des Tests de Libération d’Interféron Gamma pour détecter l’infection à Mycobacterium tuberculosis – États-Unis, 2010. MMWR 2010; 59 (RR-5): 1-25. 10 CDC. Dépistage ciblé de la tuberculine et traitement de l’infection tuberculeuse latente. MMWR 2000; 49 (RR-6): 23-5. 11 Froeschle JE, et coll. Réactions d’hypersensibilité immédiates après l’utilisation d’un test cutané à la tuberculine. Clin Infect Dis 2002; 34: e12-13. 12 Brickman HF, et al. Le moment des tests tuberculiniques par rapport à l’immunisation avec des vaccins viraux vivants. Pediatrics: 1975; 55:392-396. 13 CDC. Recommandations générales sur la vaccination : recommandations du Comité Consultatif sur les pratiques de vaccination (ACIP) et de l’Académie américaine des médecins de famille (AAFP). MMWR 2002; 51 (RR-2): 1-36. 14 CDC. Guidelines for preventing the transmission of Mycobacterium tuberculosis in health-care settings, 2005. MMWR 2005; 54 (RR-17): 1-141. 15 CDC. Le rôle du vaccin BCG dans la prévention et le contrôle de la tuberculose aux États-Unis. Une déclaration conjointe du Conseil Consultatif pour l’Élimination de la tuberculose et du Comité Consultatif sur les Pratiques de vaccination. MMWR 1996; 45 (RR-4): 1-18. 16 CDC. Lignes directrices pour l’enquête sur les contacts des personnes atteintes de tuberculose infectieuse: Recommandations de la National Tuberculosis Controllers Association et du CDC. MMWR 2005; 54 (RR-15): 1-37. 17 Mori et Shiozawa. Suppression de l’hypersensibilité à la tuberculine causée par une infection à la rubéole. Am Rev Respir Dis 1985; 886-888. 18 CDC. Lignes directrices pour la prévention et le traitement des infections opportunistes chez les adultes et les adolescents infectés par le VIH. Recommandations du CDC, des Instituts nationaux de la santé et de la HIV Medicine Association of Infectious Diseases Society of America. MMWR 2009; 58 (RR-4): 1-207. 19 CDC. Prévention et contrôle de la tuberculose dans les établissements pénitentiaires et de détention: Recommandations du CDC. MMWR 2006; 55 (RR-9): 1-44. 20 Landi S, et coll. Stabilité de la solution diluée de dérivé protéique purifié à la tuberculine à des températures extrêmes. J Stand Biol 1981; 9:195-199. 21 Landi S, et coll. Effet de la lumière sur les solutions de dérivés protéiques purifiés à la tuberculine. Am Rev Respir Dis 1975; 111:52-61. 22 Landi S, et coll. Effet de l’oxydation sur la stabilité du dérivé protéique purifié de la tuberculine (PPD) Dans: Symposium International sur les Tuberculines et le vaccin BCG. Bâle: Association Internationale de Normalisation Biologique, 1983. Stand Dev Biol 1986; 58:545-552.
Fabriqué par:
Sanofi Pasteur Limited
Toronto Ontario Canada
Distribué par:
Sanofi Pasteur Inc.
Swiftwater PA 18370 USA
Informations sur le produit à partir de
Novembre 2020
PANNEAU D’AFFICHAGE PRINCIPAL – Étiquette du Flacon de 1 mL
Tuberculine purifiée
Dérivé protéique
(Mantoux)
Tubersol®
Flacon multi-doses
1 mL (10 tests)
Dose d’essai: 5 TU / 0,1 mL ID.
Protéger de la lumière.
Jeter le
produit ouvert après 30 jours.
Rx uniquement
Sanofi Pasteur Limited
Date d’ouverture

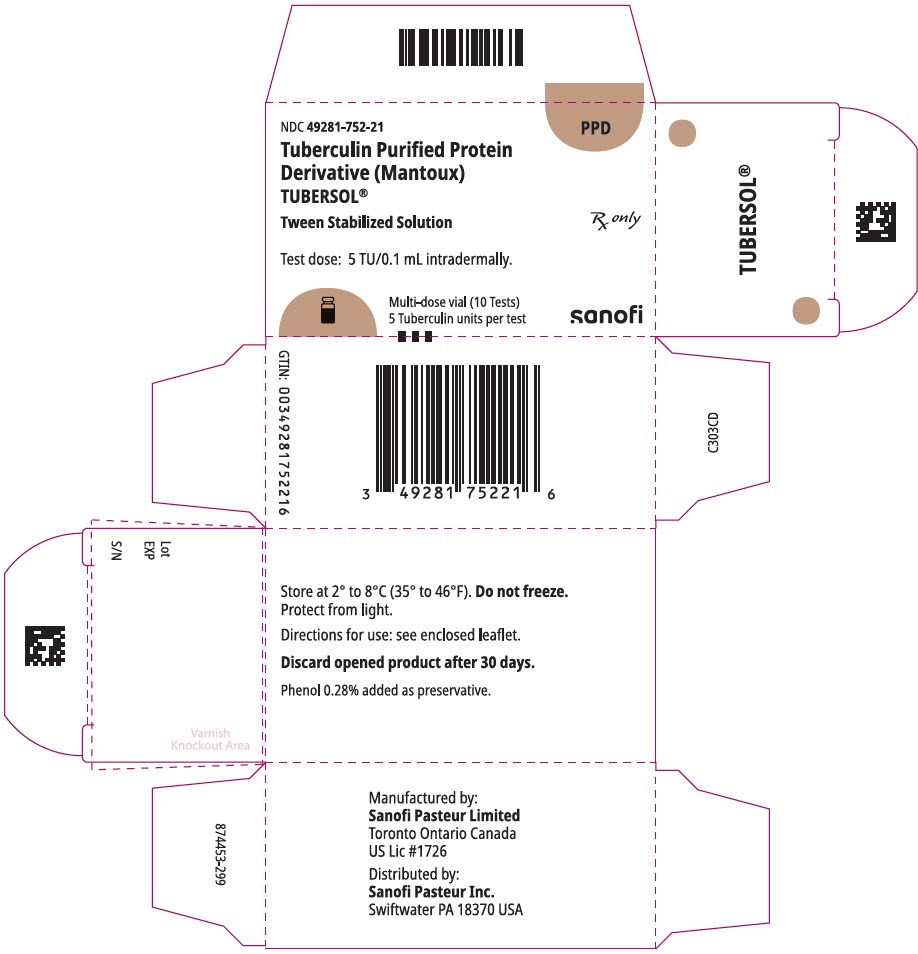
PANNEAU D’AFFICHAGE PRINCIPAL – Boîte de flacon de 1 mL
NDC 49281-752-21
PPD
Protéine purifiée à la tuberculine
Dérivé (Mantoux)
Tubersol®
Solution stabilisée de Tween
Flacon multidose 10 Essais 5 TU
Rx uniquement
Dose d’essai: 5 TU / 0,1 mL par voie intradermique.
Bio-équivalent à 5 unités US (TU) de PPD-S
SANOFI PASTEUR
PANNEAU D’AFFICHAGE PRINCIPAL – Étiquette du Flacon de 5 mL
Protéine purifiée à la tuberculine
Dérivé (Mantoux)
Tubersol®
Flacon multi-doses
5 mL (50 tests)
Dose d’essai: 5 TU / 0,1 mL ID.
Rx uniquement
Protéger de la lumière.
Jeter le produit ouvert après 30 jours.
Sanofi Pasteur Limited
Date d’ouverture

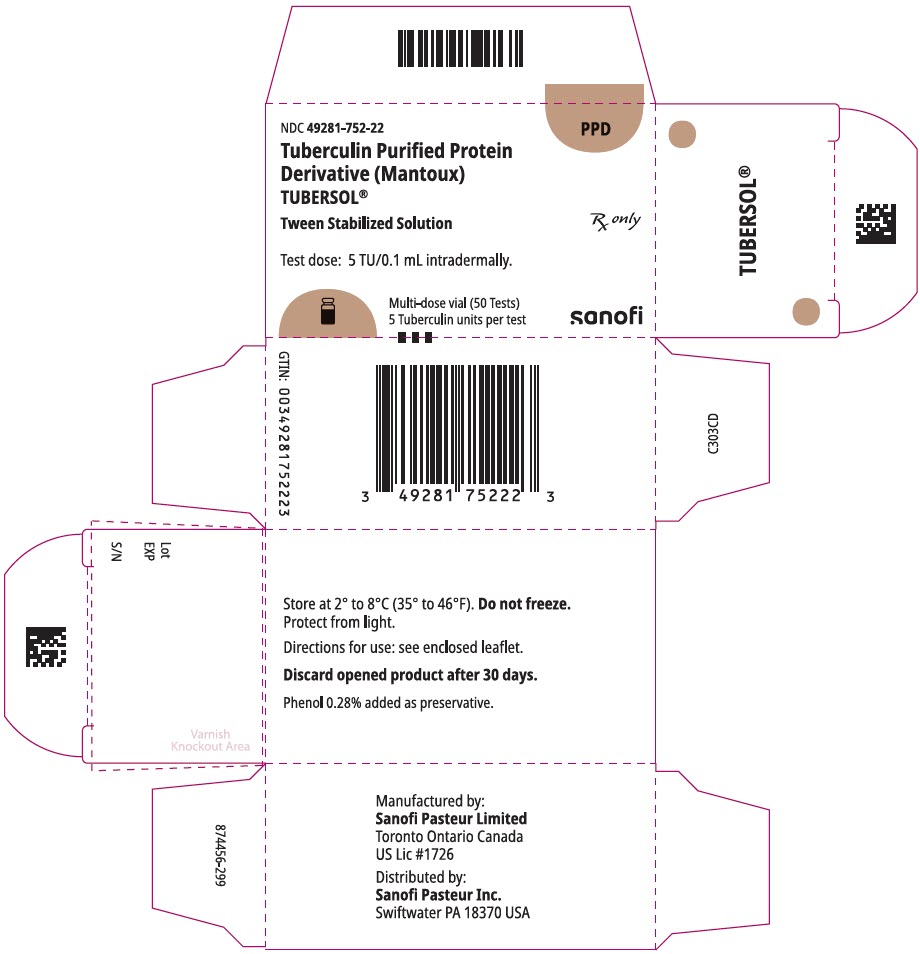
PANNEAU D’AFFICHAGE PRINCIPAL – Boîte de flacon de 5 mL
NDC 49281-752-22
PPD
Protéine purifiée à la tuberculine
Dérivé (Mantoux)
Tubersol®
Solution stabilisée de Tween
Flacon multidose 50 Essais 5 TU
Rx uniquement
Dose d’essai: 5 TU / 0,1 mL par voie intradermique.
Bio-equivalent to 5 US units (TU) of PPD-S
SANOFI PASTEUR
| Tubersol tuberculin purified protein derivative injection, solution |
|||||||||||||||||||
|
|||||||||||||||||||
|
|||||||||||||||||||
|
|||||||||||||||||||
|
|||||||||||||||||||
|
|||||||||||||||||||
|
|||||||||||||||||||
Labeler – Sanofi Pasteur Inc. (086723285)
| Establishment | |||
| Name | Address | ID/FEI | Operations |
| Sanofi Pasteur Limited | 208206623 | MANUFACTURE(49281-752) | |
En savoir plus sur le Tubersol (dérivé protéique purifié de la tuberculine)
- Effets secondaires
- Allaitement
- Informations posologiques
- Interactions médicamenteuses
- Prix &Coupons
- Classe de médicaments: produits biologiques diagnostiques in vivo
Ressources pour les consommateurs
- Lecture avancée
Ressources professionnelles
- Informations de prescription
Autres marques Aplisol
Guides de traitement connexes
- Diagnostic et investigation
Avertissement médical