Generiskt Namn: tuberkulin renat proteinderivat
doseringsform: injektion, lösning
medicinskt granskad av Drugs.com. Senast uppdaterad den Nov 1, 2020.
- översikt
- biverkningar
- dosering
- professionella
- interaktioner
- mer
AHFS Kategori: 36:84
endast Rx
diagnostiskt Antigen
(hjälp vid detektering av infektion med Mycobacterium tuberculosis)
för INTRADERMAL användning
polysorbat 80 stabiliserad lösning av Tuberkulinrenat proteinderivat för Tuberkulinprovning hos människor
Tubersol beskrivning
Tubersol Tuberculin renat proteinderivat (Mantoux) (PPD) (1) för intradermal tuberkulinprovning framställs från en stor master batch Connaught Tuberculin (CT68) (2) och är en cellfri renad proteinfraktion erhållen från en mänsklig stam av Mycobacterium tuberculosis odlad på en proteinfritt syntetiskt medium och inaktiverat. (2) användningen av ett standardpreparat som härrör från en enda sats (CT68) har antagits för att eliminera variation mellan partier och partier av samma tillverkare. (2)
Tubersol är en klar, färglös vätska.
| Tubersol innehåller: | |
| renat proteinderivat av M. tuberculosis | 5 tu per 0.1 mL |
| Polysorbate 80 | 0.0006% |
| Phenol | 0.22% to 0.35% w/v |
| in sterile isotonic phosphate buffered saline. | |
Before release, each successive lot is tested for potency in comparison with the US Standard Tuberculin PPD-S. (3)
oberoende studier utförda av US Public Health Service på människor har bestämt mängden CT68 i stabiliserad lösning som är nödvändig (4) (5) (6) för att producera bioekvivalens med tuberkulin PPD-S (i fosfatbuffert utan polysorbat 80) med 5 amerikanska enheter (tu) tuberkulin PPD-S som standard.
Tubersol – klinisk farmakologi
verkningsmekanism
sensibiliseringen efter infektion med mykobakterier förekommer främst i de regionala lymfkörtlarna. Små lymfocyter (T-lymfocyter) prolifererar som svar på den antigena stimulansen för att ge upphov till specifikt sensibiliserade lymfocyter. Efter 3-8 veckor kommer dessa lymfocyter in i blodflödet och cirkulerar i flera år. (7) efterföljande restimulering av dessa sensibiliserade lymfocyter med samma eller liknande antigen, såsom intradermal injektion av Tubersol, framkallar en lokal reaktion medierad av dessa celler. (8)
karakteristiskt börjar fördröjda överkänslighetsreaktioner på tuberkulin vid 5 till 6 timmar, är maximala vid 48 till 72 timmar och avtar under en period av dagar. Det resulterande immunsvaret består av induration på grund av cellinfiltration och ibland vesikulering och nekros. Kliniskt är en fördröjd överkänslighetsreaktion mot tuberkulin en manifestation av tidigare infektion med M tuberkulos eller en mängd icke-tuberkulosbakterier. I de flesta fall induceras sensibilisering av naturlig mykobakteriell infektion eller genom vaccination med BCG-vaccin.
indikationer och användning för Tubersol
Tubersol Tuberculin renat proteinderivat (Mantoux), är indicerat för att underlätta diagnos av tuberkulosinfektion (TB) hos personer med ökad risk att utveckla aktiv sjukdom.Centers for Disease Control and Prevention (CDC) har publicerat riktlinjer för populationer som skulle dra nytta av tuberkulinhudtest (TST). Aktuella rekommendationer kan nås på: http://www.cdc.gov/tb/publications/factsheets/testing.htm.
tidigare BCG-vaccination är inte en kontraindikation för tuberkulintest. Hudtestresultaten från BCG-vaccinerade personer kan användas för att stödja eller utesluta diagnosen TB-infektion. En FDA-godkänd interferon gamma – frisättningsanalys föredras dock framför tuberkulinhudtest för personer 5 år och äldre som tidigare vaccinerats med BCG. (9)
kontraindikationer
allergi mot någon komponent i Tubersol eller en anafylaktisk eller annan allergisk reaktion mot ett tidigare test av tuberkulin PPD är en kontraindikation för användning av Tubersol. (Se beskrivning och hur levereras.)
Tubersol ska inte ges till:
- personer som har haft en allvarlig reaktion (t.ex. nekros, blåsor, anafylaktisk chock eller sår) på en tidigare TST,
- personer med dokumenterad aktiv tuberkulos eller en tydlig historia av behandling för TB-infektion eller sjukdom, (10)
- personer med omfattande brännskador eller eksem.
varningar
överkänslighet
allergiska reaktioner kan inträffa efter användning av Tubersol även hos personer utan tidigare överkänslighet mot produktkomponenterna. (11) epinefrininjektion (1:1 000) och andra lämpliga medel som används för kontroll av omedelbara allergiska reaktioner måste vara omedelbart tillgängliga.
synkope
synkope (svimning) kan förekomma i samband med administrering av injicerbara läkemedel, inklusive Tubersol. Förfaranden bör vara på plats för att undvika fallande skada och för att återställa cerebral perfusion efter synkope.
försiktighetsåtgärder
allmänna
diagnostiska begränsningar
falskt positiva eller falskt negativa tuberkulintestreaktioner kan förekomma hos vissa individer. (Se tolkning av testet.)
falskt positiva tuberkulinreaktionstester förekommer hos individer som har smittats med andra mykobakterier, inklusive vaccination med BCG.
inte alla infekterade personer kommer att ha en fördröjd överkänslighetsreaktion mot ett tuberkulintest.
många faktorer har rapporterats orsaka minskad förmåga att svara på tuberkulintestet i närvaro av tuberkulös infektion. (Se tolkning av testet.)
information för patienter
före administrering av Tubersol ska patientens nuvarande hälsotillstånd och medicinska historia ses över. Läkaren bör granska patientens immuniseringshistoria för eventuell känslighet för komponenter i Tubersol.
vårdgivaren ska informera patienten om behovet av att återvända för att läsa testet. Självläsning av testet har visat sig vara felaktig och opålitlig.
vårdgivaren ska ge patienten en permanent personlig rekord. Dessutom är det viktigt att vårdpersonalen registrerar testhistoriken i den permanenta journalen för varje patient. Denna permanenta kontorspost bör innehålla produktens namn, angivet datum, dos, tillverkare och partinummer samt testresultatet i millimeter induration (inklusive 0 mm, om lämpligt). Att rapportera resultat endast som negativt eller positivt är inte tillfredsställande.
läkemedelsinteraktioner
reaktivitet mot testet kan vara deprimerad eller undertryckt hos personer som får kortikosteroider eller immunsuppressiva medel. (8)
reaktivitet mot Tubersol kan tillfälligt vara deprimerad av vissa levande virusvacciner (mässling, påssjuka, röda hund, oral polio, gul feber och varicella). Om ett parenteralt levande försvagat virusvaccin har administrerats nyligen, bör tuberkulinprovningen fördröjas för > 1 månad efter vaccination. (8) (12) (Se tolkning av testet.)
När tuberkulinscreening krävs samtidigt som ett mässlinginnehållande vaccin eller annat parenteralt levande försvagat virusvaccin är samtidig administrering av Tubersol och vaccinet på separata platser det föredragna alternativet.
karcinogenes, mutagenes, nedsatt fertilitet
Tubersol har inte utvärderats med avseende på dess karcinogena eller mutagena potentialer eller nedsatt fertilitet.
graviditet
reproduktionsstudier på djur har inte utförts med Tubersol. Det är inte heller känt om Tubersol kan orsaka fosterskador vid administrering till en gravid kvinna eller kan påverka reproduktionskapaciteten. Tubersol ska endast ges till en gravid kvinna om det är klart nödvändigt.
ammande mödrar
det är inte känt om Tubersol utsöndras i bröstmjölk. Eftersom många läkemedel utsöndras i bröstmjölk, bör försiktighet iakttas när Tubersol administreras till en ammande kvinna.
pediatrisk användning
det finns ingen kontraindikation för tuberkulinhudtest av spädbarn. Spädbarn <6 månaders ålder som är infekterade med M. tuberkulos kanske inte reagerar på Tubersol. (Se tolkning av testet.)
geriatrisk användning
kliniska studier av Tubersol inkluderade inte tillräckligt många försökspersoner över 65 år för att avgöra om de svarar annorlunda än yngre försökspersoner.
biverkningar
Induration vid injektionsstället Tubersol är den förväntade reaktionen för ett positivt hudtest. (Se tolkning av testet.)
informationen om biverkningar har sammanställts från Historiska kliniska studier och erfarenhet efter marknadsföring av Tubersol.
allmänna symtom och tillstånd vid administreringsstället
smärta vid injektionsstället, klåda vid injektionsstället och obehag vid injektionsstället. Erytem på injektionsstället eller utslag på injektionsstället (utan induration) som inträffar inom 12 timmar efter testningen. Dessa reaktioner indikerar inte TB-infektion. Blödning på injektionsstället och hematom på injektionsstället upp till tre dagar efter administrering av testet. Blåsor på injektionsstället, sår på injektionsstället eller nekros på injektionsstället hos mycket känsliga personer. Ärr på injektionsstället som ett resultat av starkt positiva reaktioner. Feber
immunsystemet
Överkänslighet, inklusive anafylaxi/anafylaktiska reaktioner, angioödem, urtikaria
andningsvägar, bröstkorg och mediastinum
Stridor, andnöd
hud-och subkutan vävnad
utslag, generaliserat utslag
nervsystemet
Presynkope, synkope (inklusive synkope i samband med tonisk-kloniska rörelser och annan anfallsliknande aktivitet) som ibland leder till övergående medvetslöshet med skada
rapportering av negativa biverkningar händelser
för att rapportera misstänkta biverkningar, kontakta säkerhetsövervakningen Institutionen, Sanofi Pasteur Inc., Discovery Drive, Swiftwater, PA 18370 eller ring 1-800-822-2463 (1-800-vaccin) eller Food and Drug Administration (FDA) MedWatch Program på 1-800-332-1088 och www.fda.gov/medwatch.
Tubersol dosering och administrering
dosering
fem (5) tuberkulinenheter (tu) per testdos på 0,1 mL är standardstyrkan som används för intradermal (Mantoux) testning.
administreringssätt
Tubersol är endast indicerat för intradermal injektion. Injicera inte intravenöst, intramuskulärt eller subkutant. Om subkutan injektion inträffar kan testet inte tolkas.
inspektera för främmande partiklar och / eller missfärgning före användning. Om dessa villkor föreligger, administrera inte produkten.
använd en separat spruta och nål för varje injektion. (13)
Följande procedur rekommenderas för att utföra Mantoux-testet:
- den föredragna platsen för testet är underarmens volaraspekt. Undvik områden på huden som är röda eller svullna. Undvik synliga vener.
- rengör huden med en lämplig baktericid och låt platsen torka före injektion av antigenet.
- administrera Testdosen (0,1 mL) Tubersol med en 1 mL spruta kalibrerad i tiondelar och försedd med en kort, en fjärdedel till en halv tum, 26 eller 27 gauge nål.
- torka av injektionsflaskans propp med ett lämpligt bakteriedödande medel och låt torka innan nålen sätts in. Sätt sedan in nålen försiktigt genom proppen och dra 0,1 mL Tubersol i sprutan. Undvik injektion av överskottsluft vid avlägsnande av varje dos för att inte övertrycka injektionsflaskan och eventuellt orsaka läckage vid punkteringsstället.
- sätt in nålens punkt i de mest ytliga skikten i huden med nålskenet pekande uppåt och administrera dosen genom långsam intradermal injektion. Om den intradermala injektionen utförs korrekt kommer en bestämd blek bleb att stiga vid nålpunkten, cirka 10 mm (3/8″) i diameter. Denna bleb kommer att spridas inom några minuter. Klä inte webbplatsen.
- en droppe blod kan uppträda på administreringsstället efter injektion. Tappa platsen lätt för att ta bort blodet men undvik att klämma ut den injicerade tuberkulintestvätskan.
vid en felaktigt utförd injektion (dvs. ingen bleb bildad), upprepa testet omedelbart på ett annat ställe, minst 2 tum från det första stället och cirkla det andra injektionsstället som en indikation på att detta är det ställe som ska läsas.
informera patienten om behovet av att återvända för att läsa testet av en utbildad sjukvårdspersonal. Självläsning kan vara felaktig och är starkt avskräckt.
tolkning av testet
hudtestet ska läsas av en utbildad sjukvårdspersonal 48 till 72 timmar efter administrering av Tubersol. Hudtestkänslighet indikeras endast med induration; rodnad bör inte mätas.
Mät indurationsdiametern tvärs över underarmens långa axel och registrera mätningen i millimeter (inklusive 0 mm). (8) spetsen på en kulspetspenna, som försiktigt skjuts i en vinkel på 45 kg mot injektionsstället, stannar vid indurationskanten.
registrerar också närvaro och storlek (om närvarande) av nekros och ödem, även om dessa inte används vid tolkningen av testet.
positiva reaktioner
Tuberkulinreaktivitet kan indikera latent infektion, tidigare infektion och / eller sjukdom med M. tuberkulos och indikerar inte nödvändigtvis närvaron av aktiv tuberkulös sjukdom. Personer som uppvisar positiva tuberkulinreaktioner bör betraktas som positiva enligt gällande riktlinjer för folkhälsa och hänvisas till ytterligare medicinsk utvärdering. (8) (10) upprepad testning av oinfekterade personer sensibiliserar dem inte för Tubersol. (7) (8) (10)
betydelsen av indurationsmätningar vid diagnos av latent TB-infektion måste beaktas med avseende på patientens historia och risken för att utveckla aktiv TB-sjukdom som anges i Tabell 1. (10)
| reaktionsaxi 5 mm Induration | reaktionsaxi 10 mm Induration | reaktion 15 mm induration |
|---|---|---|
| * risken för TB hos patienter som behandlas med kortikosteroider ökar med högre dos och längre duration. För personer som annars har låg risk och testas i början av anställningen anses en reaktion på 15 mm induration vara positiv. | ||
| HIV-positiva personer Senaste kontakter av tuberkulos (TB) fallpatienter fibrotiska förändringar på bröströntgen i överensstämmelse med tidigare TB patienter med organtransplantationer och andra immunsupprimerade patienter (som får motsvarande 15 mg/d av prednison i 1 månad eller mer)* |
senaste invandrare (dvs. inom de senaste 5 åren) från länder med hög prevalens injektionsmissbrukare invånare eller anställda: fängelser och fängelser, vårdhem och andra långsiktiga anläggningar för äldre, sjukhus och andra vårdinrättningar, bostadsanläggningar för patienter med förvärvat immunbristsyndrom (AIDS) och hemlösa skydd mycobacteriology laboratory personal personer med följande kliniska tillstånd som sätter dem i hög risk: silikos, diabetes mellitus, kronisk njursvikt, vissa hematologiska störningar (t. ex. leukemi och lymfom), andra specifika maligniteter (t. ex. 10% av idealvikt, gastrektomi och jejunoileal bypass barn yngre än 4 år eller spädbarn, barn och ungdomar utsatta för vuxna med hög risk |
personer utan riskfaktorer för TB |
en TST-omvandling definieras som en ökning med 10 mm induration i 2 år, oavsett ålder. (10)
möjligheten bör övervägas att hudtestkänsligheten också kan bero på en tidigare kontakt med atypiska mykobakterier eller tidigare BCG-vaccination. (8) (10)
negativa reaktioner
en individ som inte visar en positiv reaktion på 5 TU vid det första testet, men misstänks vara TB-positiv, kan testas igen med 5 tu. (Se Booster effekt och Tvåstegstestning.) Varje individ som inte visar en positiv reaktion på en initial injektion av 5 TU eller ett andra test med 5 TU kan betraktas som tuberkulinnegativ.
falska positiva reaktioner
falska positiva tuberkulinreaktioner kan förekomma hos individer som har smittats med andra mykobakterier, inklusive vaccination med BCG. (8) en diagnos av M. tuberkulosinfektion och användning av förebyggande terapi bör dock övervägas för alla BCG-vaccinerade personer som har en positiv TST-reaktion, särskilt om personen har eller har ökad risk att förvärva TB-infektion. (Se indikationer och användning.) (14) (15)
falska negativa reaktioner
inte alla infekterade personer kommer att ha en fördröjd överkänslighetsreaktion mot ett tuberkulintest.
hos de som är äldre eller de som testas för första gången kan reaktionerna utvecklas långsamt och kanske inte Toppar förrän efter 72 timmar.
eftersom tuberkulinkänslighet kan ta upp till 8 veckor att utvecklas efter exponering för M. tuberculosis (se verkningsmekanism), bör personer som har ett negativt tuberkulintest <8 veckor efter eventuell TB-exponering testas igen 8-10 veckor efter den senast kända eller misstänkta exponeringen. (16)
förändrad immunstatus
nedsatt eller dämpad cellmedierad immunitet (CMI) kan potentiellt orsaka en falsk negativ tuberkulinreaktion. Många faktorer har rapporterats orsaka minskad förmåga att svara på tuberkulintestet i närvaro av tuberkulös infektion inklusive virusinfektioner (t. ex. mässling, påssjuka, vattkoppor och HIV), levande virusvaccinationer (t. ex. gula febern), överväldigande tuberkulos, andra bakterieinfektioner, leukemi, sarkoidos, svampinfektioner, metaboliska störningar, lågproteintillstånd, sjukdomar som påverkar lymfoida organ, läkemedel (kortikosteroider och många andra immunsuppressiva medel) och malignitet eller stress. (8) (17) (18) en TST bör skjutas upp för patienter med större virusinfektioner eller levande virusvaccination under den senaste månaden. Personer med förkylning kan testas tuberkulin.
eftersom TST-resultat i HIV-infekterade individer är mindre tillförlitliga eftersom CD4-antalet minskar, bör screening slutföras så tidigt som möjligt efter att HIV-infektion inträffar. (18)
Boostereffekt och Tvåstegstestning
om tuberkulintestning kommer att utföras med jämna mellanrum, till exempel bland vårdpersonal eller fängelsearbetare, bör tvåstegstestning utföras som en baslinje för att undvika att tolka en boostereffekt som en tuberkulinomvandling. Om det första testet inte visade någon reaktion eller en liten reaktion, bör det andra testet utföras en till fyra veckor senare. Båda testerna ska läsas och registreras vid 48 till 72 timmar. Patienter med en andra tuberkulintestet (booster) svar på ≥10 mm bör anses ha upplevt tidigare TB-infektion. (14) (19)
personer som inte ökar när de ges upprepade tester på en vecka, men vars tuberkulinreaktioner ändras till positiva efter ett år, bör anses ha nyligen förvärvad tuberkulosinfektion och hanteras därefter. (7)
hur levereras Tubersol
Tubersol Tuberkulinrenat proteinderivat (Mantoux), bioekvivalent med 5 amerikanska enheter (tu) PPD-S per testdos (0.1 mL) levereras i:
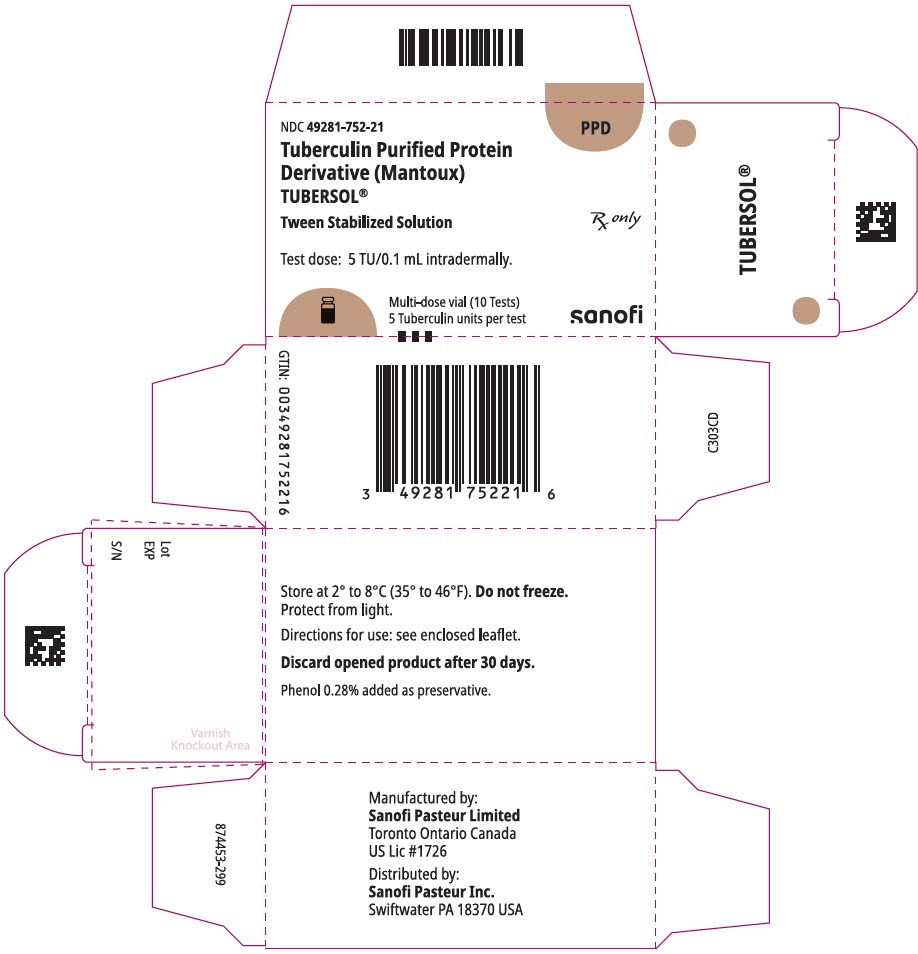
1 mL flerdosflaska (10 tester). NDC nr 49281-752-78; förpackning med 1 injektionsflaska, NDC nr 49281-752-21
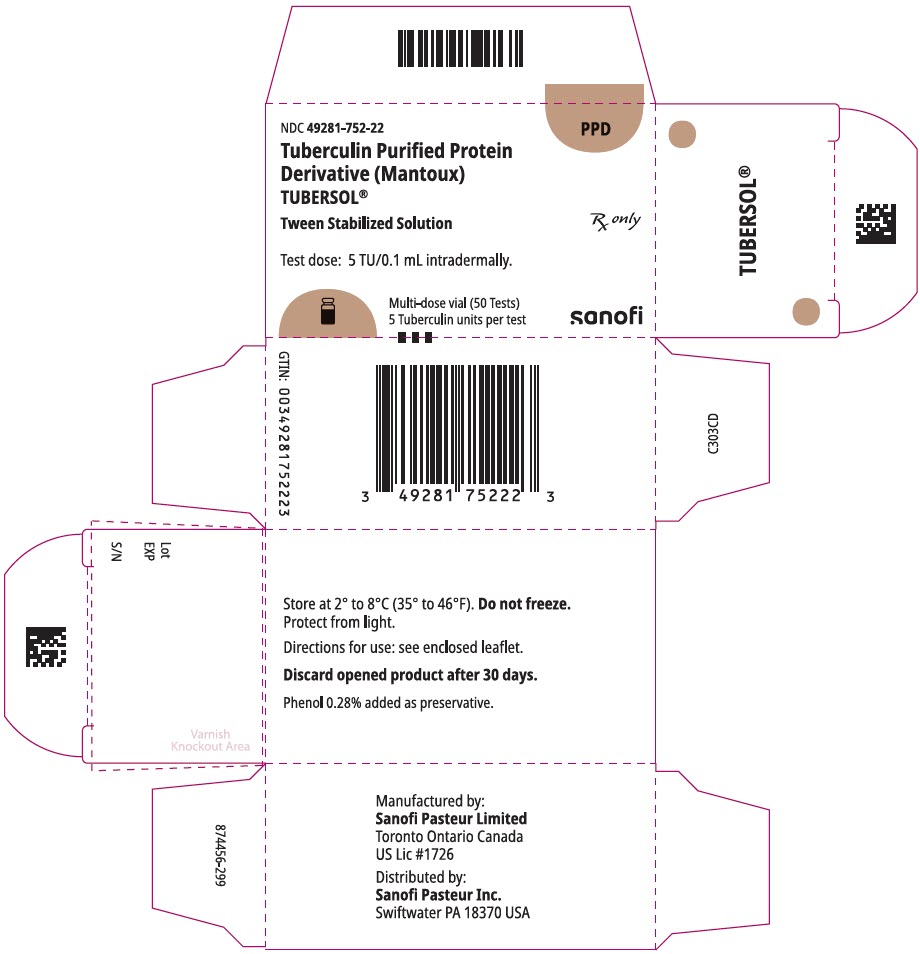
5 mL flerdosflaska (50 Test). NDC nr 49281-752-98; förpackning med 1 injektionsflaska, NDC nr 49281-752-22
injektionsflaskans propp för denna produkt innehåller inte naturligt latexgummi.
Lagring
Förvara vid 2-8 C (35-46 F). (20) frys inte. Kassera produkten om den utsätts för frysning.
skydda mot ljus. Tuberkulin PPD-lösningar kan påverkas negativt av exponering för ljus. Produkten ska förvaras i mörker utom när doserna faktiskt dras ut från injektionsflaskan. (21)
en injektionsflaska med Tubersol som har införts och använts i 30 dagar ska kasseras. (22)
använd inte efter utgångsdatum.
1 Landi S. beredning, rening och stabilitet av tuberkulin. Appl Microbiol 1963; 11: 408-412. 2 Landi S, et al. Framställning och karakterisering av en stor sats av tuberkulin renat proteinderivat (PPD-CT68). Ann Scalvo.1980;22:889-907. 3 us Code of Federal Regulations, avdelning 21, Del 610, kapitel C – standardpreparat och gränser för styrka. 4 Landi S, et al. Adsorption av tuberkulin PPD till glas-och plastytor. Tjur. Vem 1966; 35: 593-602. 5 Landi S, et al. Skillnad i styrka mellan stabiliserade och icke-stabiliserade utspädda tuberkulinlösningar. Är Rev Respir Dis 1971; 104: 385-393. 6 Landi S, et al. Stabilitet av utspädda lösningar av tuberkulinrenat proteinderivat. Tuberkel 1978; 59:121-133. 7 Menzies D. tolkning av upprepade tuberkulintester. Am J Respir Crit Vård Med 1999; 159: 15-21. 8 American Thoracic Society: diagnostiska standarder och klassificering av tuberkulos hos vuxna och barn. Am J Respir Crit Vård Med 2000; 161: 1376-1395. 9 CDC. Uppdaterade riktlinjer för användning av Interferon Gamma Release analyser för att upptäcka Mycobacterium tuberculosis infektion-USA, 2010. MMWR 2010; 59(RR-5): 1-25. 10 CDC. Riktad tuberkulinprovning och behandling av latent tuberkulosinfektion. MMWR 2000; 49 (RR-6): 23-5. 11 Froeschle JE, et al. Omedelbara överkänslighetsreaktioner efter användning av tuberkulinhudtest. Clin infektera Dis 2002; 34: e12-13. 12 Brickman HF, et al. Tidpunkten för tuberkulintest i förhållande till immunisering med levande virala vacciner. Pediatrik: 1975; 55:392-396. 13 CDC. Allmänna rekommendationer om immunisering: rekommendationer från Advisory Committee on Immunization Practices (ACIP) och American Academy of Family Physicians (AAFP). MMWR 2002; 51 (RR-2):1-36. 14 CDC. Riktlinjer för att förhindra överföring av Mycobacterium tuberculosis i hälsovårdsinställningar, 2005. MMWR 2005; 54 (RR-17):1-141. 15 CDC. BCG-vaccins roll i förebyggande och kontroll av tuberkulos i USA. Ett gemensamt uttalande från det Rådgivande Rådet för eliminering av tuberkulos och den rådgivande utskottet för immuniseringspraxis. MMWR 1996; 45 (RR-4): 1-18. 16 CDC. Riktlinjer för undersökning av kontakter med personer med infektiös tuberkulos: rekommendationer från National Tuberculosis Controllers Association och CDC. MMWR 2005; 54 (RR-15):1-37. 17 Mori och Shiozawa. Undertryckande av tuberkulinöverkänslighet orsakad av rubellainfektion. Är Rev Respir Dis 1985; 886-888. 18 CDC. Riktlinjer för förebyggande och behandling av opportunistiska infektioner hos HIV-infekterade vuxna och ungdomar. Rekommendationer från CDC, National Institutes of Health och HIV Medicine Association of Infectious Diseases Society of America. MMWR 2009; 58 (RR-4):1-207. 19 CDC. Förebyggande och kontroll av tuberkulos i korrectionella och interneringsanläggningar: rekommendationer från CDC. MMWR 2006; 55 (RR-9):1-44. 20 Landi S, et al. Stabilitet av utspädd lösning av tuberkulinrenat proteinderivat vid extrema temperaturer. J Biol Monter 1981; 9:195-199. 21 Landi S, et al. Effekt av ljus på tuberkulinrenade proteinderivatlösningar. Är Rev Respir Dis 1975; 111: 52-61. 22 Landi S, et al. Effekt av oxidation på stabiliteten hos tuberkulinrenat proteinderivat( PPD) i: internationellt Symposium om Tuberkuliner och BCG-vaccin. Basel: Internationella föreningen för biologisk standardisering, 1983. Dev Biol Stå 1986; 58: 545-552.
Tillverkad av:
Sanofi Pasteur Limited
Toronto Ontario Kanada
distribueras av:
Sanofi Pasteur Inc.
Swiftwater PA 18370 USA
produktinformation från och med
November 2020
HUVUDDISPLAYPANEL – 1 mL injektionsflaska etikett
tuberkulin renat
proteinderivat
(Mantoux)
Tubersol kubi
flerdosflaska
1 mL (10 tester)
testdos: 5 TU/0,1 mL ID.
skydda mot ljus.
kassera öppnad
produkt efter 30 dagar.
endast Rx
Sanofi Pasteur Limited
datum öppnat

HUVUDDISPLAYPANEL – 1 mL injektionsflaska kartong
NDC 49281-752-21
PPD
tuberkulin renat Protein
derivat (Mantoux)
tubersol kubi
tween stabiliserad lösning
flerdosflaska 10 tester 5 tu
endast RX
testdos: 5 tu/0,1 ml intradermalt.
Bio-ekvivalent med 5 amerikanska enheter (tu) av PPD-s
SANOFI PASTEUR
HUVUDDISPLAYPANEL – 5 mL injektionsflaska etikett
tuberkulin renat Protein
derivat (Mantoux)
Tubersol kubi
flerdosflaska
5 mL (50 tester)
testdos: 5 tu/0,1 ml ID.
endast Rx
skydda mot ljus.
kassera öppnad produkt efter 30 dagar.
Sanofi Pasteur Limited
datum öppnat

huvudskärm PANEL – 5 mL injektionsflaska kartong
NDC 49281-752-22
PPD
tuberkulin renat Protein
derivat (Mantoux)
Tubersol>
tween stabiliserad lösning
flerdosflaska 50 tester 5 tu
endast RX
testdos: 5 tu/0,1 ml intradermalt.
Bio-equivalent to 5 US units (TU) of PPD-S
SANOFI PASTEUR
| Tubersol tuberculin purified protein derivative injection, solution |
|||||||||||||||||||
|
|||||||||||||||||||
|
|||||||||||||||||||
|
|||||||||||||||||||
|
|||||||||||||||||||
|
|||||||||||||||||||
|
|||||||||||||||||||
Labeler – Sanofi Pasteur Inc. (086723285)
| Establishment | |||
| Name | Address | ID/FEI | Operations |
| Sanofi Pasteur Limited | 208206623 | MANUFACTURE(49281-752) | |
mer om Tubersol (tuberkulin renat proteinderivat)
- biverkningar
- amning
- doseringsinformation
- läkemedelsinteraktioner
- prissättning& kuponger
- läkemedelsklass: in vivo diagnostiska biologiska läkemedel
konsumentresurser
- avancerad läsning
professionella resurser
- förskrivningsinformation
andra märken aplisol
relaterade behandlingsguider
- diagnos och undersökning
medicinsk ansvarsfriskrivning