yleisnimi: tuberkuliinipuhdistettu proteiinijohdannainen
annosmuoto: injection, solution
Drugs.com. viimeksi päivitetty marras 1, 2020.
- leiskuva
- haittavaikutukset
- annostus
- yhteisvaikutukset
- lisää
ammattilainen
AHFS Kategoria: 36:84
vain Rx
diagnostinen antigeeni
(apu Mycobacterium tuberculosis-infektion toteamisessa)
NAHANSISÄISEEN käyttöön
polysorbaatti 80-stabiloitu Tuberkuliiniliuos puhdistettua Proteiinijohdannaista Tuberkuliinikoetta varten ihmisellä
Tubersolin kuvaus
Tuberberl® Tuberkuliinipuhdistettua Proteiinijohdannaista (Mantoux) (PPD) (1) nahansisäistä tuberkuliinikoetta varten on valmistettu suuresta pääerästä Connaught Tuberculin (ct68) (2) ja se on soluton puhdistettu proteiinifraktio, joka on saatu ihmisen Mycobacterium tuberculosis-kannasta, jota on kasvatettu proteiiniton synteettinen aine ja inaktivoitu. (2) yhdestä erästä johdetun standardivalmisteen (CT68) käyttö on hyväksytty saman valmistajan eräkohtaisen vaihtelun poistamiseksi. (2)
Tubersoli on kirkas, väritön neste.
| Tubersoli sisältää: | |
| M. tuberculosis | 5 Tu / 0.1 mL |
| Polysorbate 80 | 0.0006% |
| Phenol | 0.22% to 0.35% w/v |
| in sterile isotonic phosphate buffered saline. | |
Before release, each successive lot is tested for potency in comparison with the US Standard Tuberculin PPD-S. (3)
Yhdysvaltain Kansanterveyslaitoksen ihmisillä tekemissä riippumattomissa tutkimuksissa on määritetty ct68: n määrä stabiloidussa liuoksessa (4) (5) (6) bioekvivalenssin aikaansaamiseksi tuberkuliinin PPD-S: n kanssa (fosfaattipuskurissa ilman polysorbaatti 80: tä) käyttäen standardina 5 US-yksikköä (TU) tuberkuliinin PPD-S: ää.
Tubersol – Kliininen farmakologia
vaikutusmekanismi
mykobakteeritartunnan jälkeinen herkistyminen tapahtuu pääasiassa alueellisissa imusolmukkeissa. Pienet lymfosyytit (T-lymfosyytit) proliferoituvat vasteena antigeeniselle ärsykkeelle synnyttäen erityisen herkistyneitä lymfosyyttejä. 3-8 viikon kuluttua nämä lymfosyytit tulevat verenkiertoon ja kiertävät vuosia. (7) näiden herkistyneiden lymfosyyttien uudelleenstimulointi samalla tai vastaavalla antigeenillä, kuten Tubersoli-injektio ihon sisään, herättää näiden solujen välittämän paikallisen reaktion. (8)
tyypillisesti viivästyneet yliherkkyysreaktiot tuberkuliinille alkavat 5-6 tunnin kuluttua, ovat suurimmillaan 48-72 tunnin kuluttua ja laantuvat päivien kuluessa. Tuloksena oleva immuunivaste koostuu solujen infiltraatiosta johtuvasta kovettumasta ja satunnaisesti vesikulaatiosta ja nekroosista. Kliinisesti viivästynyt yliherkkyysreaktio tuberkuliinille on aiemman tuberkuloositartunnan tai muiden kuin tuberkuloosibakteerien ilmentymä. Herkistymisen aiheuttaa useimmiten luonnollinen mykobakteeri-infektio tai BCG-rokote.
Tubersolin käyttöaiheet ja käyttö
Tuberkkelin Tuberkuliinipuhdistettu Proteiinijohdannainen (Mantoux) on tarkoitettu tuberkuloositartunnan (TB) diagnosointiin henkilöillä, joilla on kohonnut riski sairastua aktiiviseen tautiin.
CDC (Centers for Disease Control and Prevention) on julkaissut ohjeet tuberkuliinikokeesta (TST) hyötyvistä populaatioista. Nykyiset suositukset löytyvät osoitteesta http://www.cdc.gov/tb/publications/factsheets/testing.htm.
aikaisempi BCG-rokotus ei ole tuberkuliinitestin vasta-aihe. BCG-rokotettujen ihotestituloksia voidaan käyttää tuberkuloositartunnan diagnoosin tukemiseen tai poissulkemiseen. FDA: n hyväksymä gammainterferonin vapautumistesti on kuitenkin parempi kuin ihon tuberkuliinitesti 5-vuotiailla ja sitä vanhemmilla henkilöillä, jotka on aiemmin rokotettu BCG: llä. (9)
vasta-aiheet
allergia Tubersolin jollekin aineosalle tai anafylaktinen tai muu allerginen reaktio aiemmassa tuberkuliinitestissä on tubersolin käytön vasta-aihe. (Katso kuvaus ja toimitustapa.)
Tubersolia ei saa antaa:
- henkilöt, joilla on ollut vakava reaktio (esim.nekroosi, rakkulat, anafylaktinen sokki tai haavauma) aiempaan TST: hen,
- henkilöt, joilla on dokumentoitu aktiivinen tuberkuloosi tai joilla on ollut selkeä aiempi hoito tuberkuloositartunnan tai taudin vuoksi, (10)
- henkilöt, joilla on ollut laajoja palovammoja tai ekseemaa.
Varoitukset
yliherkkyys
allergisia reaktioita voi esiintyä Tubersolin käytön jälkeen myös henkilöillä, joilla ei ole aiemmin ollut yliherkkyyttä valmisteen aineosille. (11) adrenaliini injektio (1:1 000) ja muita sopivia lääkeaineita, joita käytetään välittömien allergisten reaktioiden hallitsemiseen, on oltava välittömästi saatavilla.
Synkopee
pyörtymistä voi esiintyä injisoitavien lääkkeiden, mukaanlukien Tubersolin, käytön yhteydessä. Käytössä on oltava menettelyt putoamisvammojen välttämiseksi ja aivoperfuusion palauttamiseksi pyörtymisen jälkeen.
varotoimet
Yleiset
diagnostiset rajoitukset
joillakin henkilöillä voi esiintyä vääriä positiivisia tai vääriä negatiivisia tuberkuliinitestireaktioita. (KS. testin tulkinta.)
vääriä positiivisia tuberkuliinireaktiotestejä esiintyy henkilöillä, jotka ovat saaneet tartunnan muista mykobakteereista, mukaan lukien BCG-rokotus.
kaikille tartunnan saaneille ei tule viivästynyttä yliherkkyysreaktiota tuberkuliinikokeesta.
monien tekijöiden on raportoitu heikentävän kykyä vastata tuberkuliinitestiin tuberkuloositartunnan yhteydessä. (KS. testin tulkinta.)
tiedot
ennen Tubersolin antamista on tarkistettava potilaan terveydentila ja sairaushistoria. Lääkärin tulee tarkistaa potilaan immunisaatiohistoria mahdollisen herkkyyden Tubersolin komponenteille.
terveydenhuollon tarjoajan tulee ilmoittaa potilaalle, että hänen on palattava kokeeseen. Testin omaluku on osoittautunut virheelliseksi ja epäluotettavaksi.
terveydenhuollon tarjoajan tulee antaa potilaalle pysyvä henkilökohtainen Rekisteri. Lisäksi on oleellista, että terveydenhuollon ammattilainen kirjaa testaushistorian jokaisen potilaan pysyvään sairauskertomukseen. Tässä pysyvässä toimistossa olevassa tietueessa on oltava Tuotteen nimi, annettu päivämäärä, annos, valmistaja ja erän numero sekä testitulos kovettumamillimetreinä (tarvittaessa myös 0 mm). Tulosten ilmoittaminen vain negatiivisina tai positiivisina ei ole tyydyttävää.
Lääkkeiden yhteisvaikutukset
reaktiivisuus testiä kohtaan voi olla heikentynyt tai vaimentunut potilailla, jotka saavat kortikosteroideja tai immunosuppressiivisia lääkeaineita. (8)
tietyt elävät virusrokotteet (tuhkarokko, sikotauti, vihurirokko, suun kautta otettava polio, keltakuume ja vesirokko) saattavat tilapäisesti heikentää Tubersolin reaktiivisuutta. Jos parenteraalista elävää heikennettyä virusrokotetta on annettu äskettäin, tuberkuliinitestausta tulee lykätä, jos >1 kuukausi rokotuksen jälkeen. (8) (12) (ks.testin tulkinta.)
Jos tuberkuliiniseulonta on tarpeen samanaikaisesti tuhkarokkoa sisältävän rokotteen tai muun parenteraalisen elävän heikennetyn virusrokotteen kanssa, Tubersolin ja rokotteen antaminen samanaikaisesti eri kohtiin on suositeltava vaihtoehto.
karsinogeneesiä, mutageenisuutta, hedelmällisyyden heikkenemistä
Tubersolia ei ole arvioitu sen karsinogeenisten tai mutageenisten potentiaalien tai hedelmällisyyden heikkenemisen vuoksi.
raskaus
Tubersolilla ei ole tehty lisääntymistutkimuksia eläimillä. Ei myöskään tiedetä, voiko Tubersoli aiheuttaa sikiölle haittaa raskaana olevalle naiselle annettuna tai voi vaikuttaa lisääntymiskykyyn. Tubersolia tulee antaa raskaana olevalle naiselle vain, jos se on selvästi tarpeen.
imettävät äidit
ei tiedetä, erittyykö Tubersoli äidinmaitoon. Koska monet lääkkeet erittyvät äidinmaitoon, on noudatettava varovaisuutta, kun Tubersolia annetaan imettävälle naiselle.
lapsipotilailla
pikkulasten ihon tuberkuliinitestille ei ole vasta-aiheita. Pikkulapset <6 kuukauden ikäiset, joilla on M. tuberkuloosi ei välttämättä reagoi Tubersoliin. (KS. testin tulkinta.)
geriatrinen käyttö
Tubersolilla tehdyissä kliinisissä tutkimuksissa ei ollut riittävästi 65 vuotta täyttäneitä tutkimushenkilöitä sen määrittämiseksi, onko heillä erilainen vaste kuin nuoremmilla tutkimushenkilöillä.
haittavaikutukset
kovettuminen Tubersol-injektiokohdassa on odotettu reaktio positiiviselle ihotestille. (KS. testin tulkinta.)
haittatapahtumiin liittyvät tiedot on koottu Tubersolin aikaisista kliinisistä tutkimuksista ja markkinoille tulon jälkeisistä kokemuksista.
Yleisoireet ja antopaikassa todettavat haitat
kipu injektiokohdassa, kutina injektiokohdassa ja epämiellyttävä tunne injektiokohdassa. Pistoskohdan punoitus tai pistoskohdan ihottuma (kovettumaton), joka esiintyy 12 tunnin kuluessa testauksesta. Nämä reaktiot eivät viittaa TUBERKULOOSITARTUNTAAN. Pistoskohdan verenvuoto ja pistoskohdan hematooma enintään kolmen päivän kuluttua testin antamisesta. Injektiokohdan rakkulat, injektiokohdan haavauma tai injektiokohdan nekroosi erittäin herkillä henkilöillä. Pistoskohdan arpi voimakkaan positiivisen reaktion seurauksena. Kuume
immuunijärjestelmä
yliherkkyys, mukaan lukien anafylaksia/anafylaktiset reaktiot, angioedeema, urtikaria
Hengityselimet, rintakehä ja välikarsina
Stridor, hengenahdistus
ihon ja ihonalaiskerrosten häiriöt
ihottuma, yleistynyt ihottuma
hermosto
Presynkooppi, pyörtyminen (mukaan lukien pyörtyminen, johon liittyy toonis-kloonisia liikkeitä ja muuta kohtauksen kaltaista toimintaa), joskus aiheuttaen ohimenevää tajunnan menetystä ja vamman
raportointi haittavaikutuksista tapahtumat
ilmoittaaksesi epäillyistä haittavaikutuksista, ota yhteyttä lääketurvatoimintaan Department, Sanofi Pasteur Inc., Discovery Drive, Swiftwater, PA 18370 tai soita 1-800-822-2463 (1-800-VACCINE) tai Food and Drug Administration (FDA) MEDWATCH ohjelma 1-800-332-1088 ja www.fda.gov/medwatch.
Tubersolin Annostus ja anto
annostus
viisi (5) tuberkuliiniyksikköä (TU) 0, 1 mL: n testiannosta kohti on vakiovahvuus, jota käytetään ihonsisäisessä (Mantoux) testauksessa.
antotapa
Tubersoli on tarkoitettu vain nahansisäiseen injektioon. Ei saa antaa laskimoon, lihakseen eikä ihon alle. Jos injektio annetaan ihon alle, testiä ei voida tulkita.
ennen käyttöä on tarkastettava vieraiden hiukkasten ja / tai värimuutosten varalta. Jos tällaisia oireita esiintyy, valmistetta ei saa antaa.
käytä erillistä ruiskua ja neulaa jokaista pistosta varten. (13)
Mantoux-testin suorittamiseen suositellaan seuraavaa toimenpidettä:
- testin ensisijainen kohta on kyynärvarren volar-aspekti. Vältä ihoalueita, jotka ovat punaisia tai turvoksissa. Vältä näkyviä suonia.
- Puhdista ihokohta sopivalla itusidillä ja anna sen kuivua ennen antigeenin injektiota.
- Anna Testiannos (0, 1 mL) Tubersolia 1 mL: n ruiskulla, joka on kalibroitu kymmenesosissa ja varustettu lyhyellä, neljänneksestä puoleen tuuman, 26 tai 27 gaugen neulalla.
- pyyhi injektiopullon tulppa sopivalla itusidillä ja anna kuivua ennen neulan pistämistä. Työnnä neula varovasti tulpan läpi ja vedä ruiskuun 0, 1 mL Tubersolia. Vältä ylimääräisen ilman pistämistä ja jokaisen annoksen poistamista, jotta injektiopulloa ei paineta liikaa ja jotta pistoskohtaan ei tule vuotoa.
- työnnä neulan kärki ihon pinnallisimpiin kerroksiin neulan viiste ylöspäin ja anna annos hitaalla ihon sisään annettavalla injektiolla. Jos ihonsisäinen injektio suoritetaan oikein, selvä vaalea bleb nousee neulanpisteeseen, halkaisijaltaan noin 10 mm (3/8″). Bleb hajoaa muutamassa minuutissa. Älä pue sivustoa.
- injektiokohdassa voi näkyä veripisara injektion jälkeen. Pyyhi pistoskohta kevyesti veren poistamiseksi, mutta vältä pistetyn tuberkuliinitestinesteen puristamista ulos.
jos injektio on annettu väärin (eli bleb: tä ei ole muodostunut), toista testi välittömästi toiseen kohtaan, vähintään 2 sentin päähän ensimmäisestä pistoskohdasta, ja kierrä toinen pistoskohta merkiksi siitä, että tämä on luettava kohta.
ilmoita potilaalle, että on tarpeen palata lukemaan testi koulutetun terveydenhuollon ammattilaisen toimesta. Itse lukeminen voi olla epätarkkaa ja sitä lannistetaan voimakkaasti.
testin tulkinta
koulutetun terveydenhuollon ammattilaisen tulee lukea ihotesti 48-72 tunnin kuluttua Tubersolin antamisesta. Ihotestin herkkyys ilmoitetaan vain kovettumalla; punoitusta ei pidä mitata.
mittaa kovettuman halkaisija poikittain kyynärvarren pituusakseliin nähden ja kirjaa mittaus millimetreinä (mukaan lukien 0 mm). (8) kuulakärkikynän kärki, jota työnnetään kevyesti 45° kulmassa injektiokohtaa kohti, pysähtyy kovettuman reunaan.
kirjataan myös nekroosin ja turvotuksen esiintyminen ja koko (Jos esiintyy), vaikka niitä ei käytetä testin tulkinnassa.
positiiviset reaktiot
Tuberkuliinireaktiot voivat viitata piilevään infektioon, aiempaan infektioon ja / tai M. tuberkuloosiin eikä välttämättä aktiivisen tuberkuloositaudin esiintymiseen. Henkilöt, joilla tuberkuliinireaktiot ovat positiivisia, on katsottava positiivisiksi voimassa olevien kansanterveysohjeiden perusteella, ja heidät on lähetettävä jatkolääketieteelliseen arviointiin. (8) (10) tartunnan saaneiden henkilöiden toistuva testaus ei herkistä heitä Tubersolille. (7) (8) (10)
induraatiomittausten merkitystä piilevän tuberkuloositartunnan diagnosoinnissa on tarkasteltava potilaan historian ja aktiivisen TUBERKULOOSITAUDIN kehittymisen riskin kannalta, kuten taulukossa 1 on esitetty. (10)
| reaktio ≥5 mm kovettumista | reaktio ≥10 mm kovettumista | reaktio ≥15 mm: n kovettuma |
|---|---|---|
| * tuberkuloosin riski kortikosteroidihoitoa saavilla potilailla kasvaa suuremman annoksen ja pidemmän keston myötä. † Henkilöillä, joilla on muuten pieni riski ja jotka testataan työsuhteen alussa, ≥15 mm: n kovettumisreaktio katsotaan positiiviseksi. | ||
| HIV-positiiviset äskettäiset tuberkuloosipotilaat fibroottiset muutokset rintakehän röntgenkuvassa, jotka ovat yhdenmukaisia aiemman tuberkuloosin kanssa elinsiirtopotilaat ja muut immunosuppressiopotilaat (jotka saivat ≥15 mg/d prednisonia vähintään kuukauden ajan)* |
äskettäin saapuneet maahanmuuttajat (eli viimeisten 5 vuoden aikana) korkean esiintyvyyden maista injektiohuumeidenkäyttäjät asukkaat tai työntekijät† seuraavista korkean riskin seurakunnista: vankilat ja vankilat, vanhainkodit ja muut pitkäaikaislaitokset, sairaalat ja muut terveydenhuoltolaitokset, hankittua immuunikatoa (AIDS) sairastavien potilaiden asuinrakennukset ja kodittomien asuntolat Mycobacteriology Laboratoryn henkilökunta henkilöt, joilla on seuraavat kliiniset sairaudet, jotka asettavat heidät suureen riskiin: silikoosi, diabetes mellitus, krooninen munuaisten vajaatoiminta, jotkut hematologiset häiriöt (esim. leukemiat ja lymfoomat), muut erityiset maligniteetit (esim., pään, kaulan ja keuhkojen karsinooma), painon lasku ≥10% ihannepainosta, gastrectomia ja jejunoileaalinen ohitusleikkaus alle 4-vuotiaat lapset tai imeväiset, lapset ja nuoret altistuvat aikuisille, joilla on suuri riski |
henkilöt, joilla ei ole tuberkuloosin riskitekijöitä |
TST-muunnos määritellään ≥10 mm: n lisäyksenä 2 vuoden aikana iästä riippumatta. (10)
on otettava huomioon, että ihotestin herkkyys voi johtua myös aiemmasta kontaktista epätyypillisiin mykobakteereihin tai aiemmasta BCG-rokotuksesta. (8) (10)
negatiiviset reaktiot
henkilö, joka ei ensimmäisessä testissä saanut positiivista reaktiota 5 TU: lle, mutta jonka epäillään olevan TUBERKULOOSIPOSITIIVINEN, voidaan testata uudelleen 5 TU: lla. (KS. tehoste ja kaksivaiheinen testaus.) Tuberkuliininegatiivisina voidaan pitää henkilöä, joka ei reagoi positiivisesti 5 TU: n alkuinjektioon tai 5 TU: n toiseen testiin.
vääriä positiivisia reaktioita
vääriä positiivisia tuberkuliinireaktioita voi esiintyä henkilöillä, jotka ovat saaneet tartunnan muista mykobakteereista, mukaan lukien BCG-rokotus. (8) tuberkuloositartunnan diagnosointia ja ehkäisevän hoidon käyttöä tulisi kuitenkin harkita kaikille BCG-rokotetuille henkilöille, joilla on positiivinen TST-reaktio, erityisesti jos henkilöllä on ollut tai on suurentunut riski saada TUBERKULOOSITARTUNTA. (Katso käyttöaiheet ja käyttö.) (14) (15)
väärät negatiiviset reaktiot
kaikille tartunnan saaneille ei tule viivästynyttä yliherkkyysreaktiota tuberkuliinikokeesta.
iäkkäillä tai ensimmäistä kertaa testattavilla potilailla reaktiot voivat kehittyä hitaasti ja ne voivat kehittyä huippuunsa vasta 72 tunnin kuluttua.
koska tuberkuliiniherkkyyden kehittyminen voi kestää jopa 8 viikkoa M. tuberkuloosille altistumisen jälkeen (ks.vaikutusmekanismi), henkilöt, joille on tehty negatiivinen tuberkuliinitesti <8 viikkoa mahdollisen TUBERKULOOSIALTISTUKSEN jälkeen, on testattava uudelleen ≥8-10 viikkoa viimeisen tunnetun tai epäillyn altistuksen jälkeen. (16)
muuttunut immuunitilanne
heikentynyt tai heikennetty soluvälitteinen immuniteetti (CMI) voi mahdollisesti aiheuttaa väärän negatiivisen tuberkuliinireaktion. Monien tekijöiden on raportoitu heikentävän kykyä vastata tuberkuliinikokeeseen tuberkuliinitartunnan yhteydessä, mukaan lukien virusinfektiot (esim. tuhkarokko, sikotauti, vesirokko ja HIV), elävien virusten rokotukset (esim., tuhkarokko, sikotauti, vihurirokko, suullinen polio ja keltakuume), ylivoimainen tuberkuloosi, muut bakteeri-infektiot, leukemia, sarkoidoosi, sieni-infektiot, metaboliset derangements, alhainen proteiini tilat, sairaudet vaikuttavat lymfoidisissa elimissä, lääkkeet (kortikosteroidit ja monet muut immunosuppressiiviset aineet), ja maligniteetti tai stressi. (8) (17) (18) TST-rokotusta on lykättävä potilailla, joilla on ollut vakavia virusinfektioita tai eläviä viruksia koskeva rokotus viimeksi kuluneen kuukauden aikana. Flunssaa sairastaville voidaan tehdä tuberkuliinitesti.
koska HIV-infektoituneiden henkilöiden TST-tulokset ovat EPÄLUOTETTAVAMPIA CD4-määrien vähentyessä, seulonta tulisi suorittaa mahdollisimman pian HIV-infektion toteamisen jälkeen. (18)
Tehostevaikutus ja kaksivaiheinen testaus
Jos tuberkuliinitestejä tehdään säännöllisin väliajoin esimerkiksi terveydenhuollon tai vankilan työntekijöille, perustasona on käytettävä kaksivaiheista testiä, jotta tehostevaikutusta ei tulkittaisi tuberkuliinikonversioksi. Jos ensimmäinen testi osoitti joko ei reaktiota tai pieni reaktio, toinen testi on tehtävä yhdestä neljään viikkoa myöhemmin. Molemmat testit on luettava ja kirjattava 48-72 tunnin kuluttua. Jos toisen tuberkuliinitestin (tehosterokotus) vaste on ≥10 mm, on katsottava, että potilaalla on aiemmin ollut TUBERKULOOSITARTUNTA. (14) (19)
henkilöt, joille ei tehdä uusintatestejä viikon kuluttua, mutta joiden tuberkuliinireaktiot muuttuvat positiivisiksi vuoden kuluttua, on katsottava vasta saaduiksi tuberkuloositartunnoiksi ja hoidettava sen mukaisesti. (7)
miten Tubersolia toimitetaan
Tubersoli Tuberkuliinipuhdistettu Proteiinijohdannainen (Mantoux), bioekvivalentti 5 us-yksikköön (TU) PPD-S / testiannos (0.1 mL) on saatavilla:
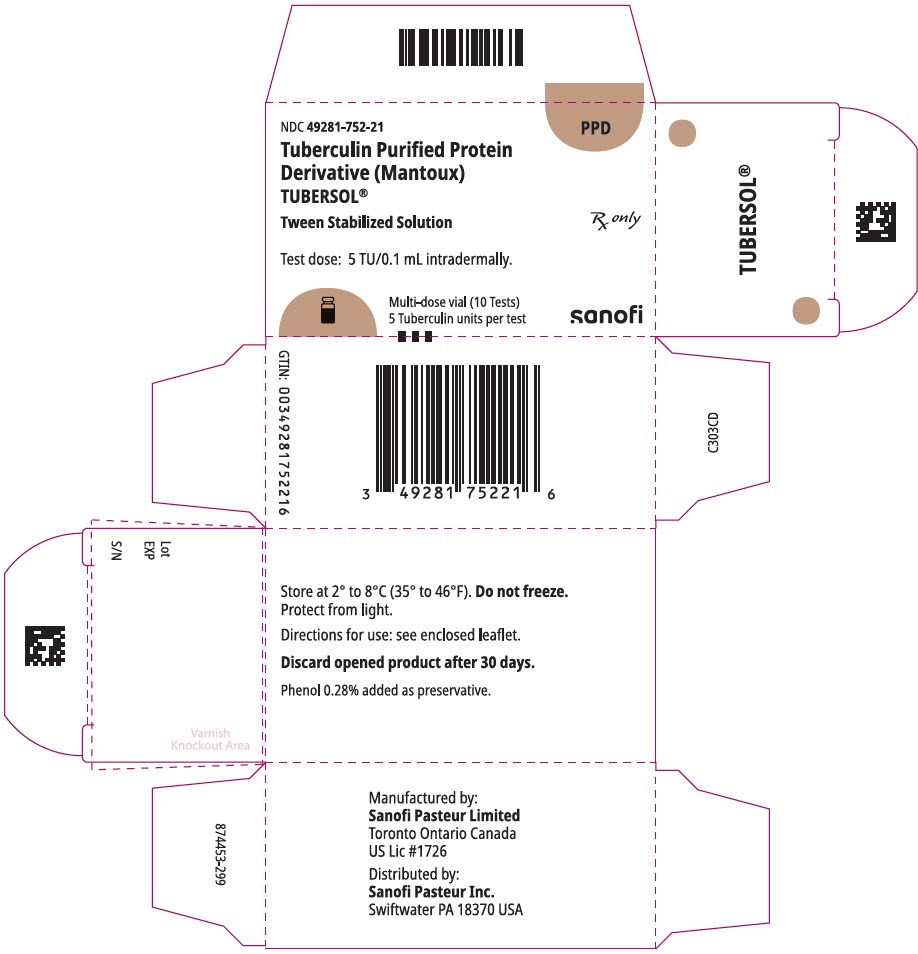
1 mL: n moniannosinjektiopullossa (10 testiä). NDC-nro 49281-752-78; 1 injektiopullon Pakkaus, NDC-nro 49281-752-21
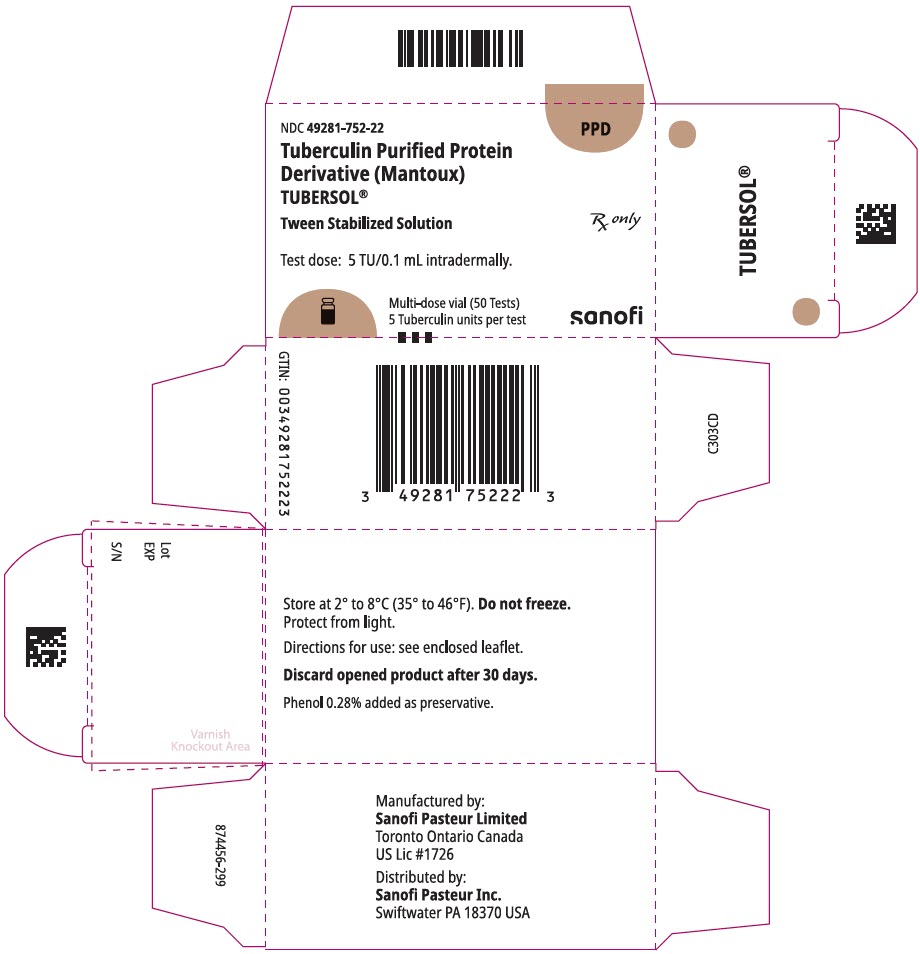
5 mL: n moniannospullo (50 testiä). NDC-nro 49281-752-98; 1 injektiopullon Pakkaus, NDC-nro 49281-752-22
tämän valmisteen injektiopullon tulppa ei sisällä luonnon lateksikumia.
säilytys
säilytä 2° – 8°C (35° – 46°F). (20) ei saa jäätyä. Jäätymisvaarassa oleva valmiste on hävitettävä.
suojaa valolta. Valolle altistuminen voi vaikuttaa haitallisesti tuberkuliiniliuoksiin. Valmiste tulee säilyttää pimeässä paitsi silloin, kun injektiopullosta otetaan annoksia. (21)
30 vuorokautta käytössä ollut Tubersol-injektiopullo tulee hävittää. (22)
Älä käytä viimeisen käyttöpäivämäärän jälkeen.
1 Landi S. tuberkuliinin valmistelu, puhdistus ja stabiilisuus. Appl Microbiol 1963; 11: 408-412. 2 Landia, et al. Suuren erän tuberkuliinipuhdistettua proteiinijohdannaista (PPD-CT68) valmistelu ja luonnehdinta. Ann Scalvo.1980;22:889-907. 3 US Code of Federal Regulations, Title 21, Part 610, Subluku C-Standard preparations and limits of potency. 4 Landia, et al. Tuberkuliinin PPD: n adsorptio lasi-ja muovipinnoille. Sonni. WHO 1966;35: 593-602. 5 Landia ym. Stabiloitujen ja stabilisoimattomien laimeiden tuberkuliiniliuosten välinen teho. Am Rev Respir Tämä 1971; 104: 385-393. 6 Landia, et al. Tuberkuliinipuhdistetun proteiinijohdannaisen laimeiden liuosten stabiilisuus. Tubercle 1978; 59: 121-133. 7 Menzies D. toistettujen tuberkuliinitestien tulkinta. Am J Respir Crit Care Med 1999;159: 15-21. 8 American Thoracic Society: Diagnostic standards and classification of tuberculosis in adults and children. Am J Respir Crit Care Med 2000; 161: 1376-1395. 9 CDC. Päivitetyt ohjeet interferoni Gamma Release Assays to Detect Mycobacterium tuberculosis – United States, 2010. MMWR 2010; 59 (RR-5): 1-25. 10 CDC. Kohdennettu tuberkuliinitutkimus ja latentin tuberkuloosi-infektion hoito. MMWR 2000; 49(RR-6): 23-5. 11 Froeschle JE, et al. Välittömät yliherkkyysreaktiot ihon tuberkuliinitestin jälkeen. Clin Infect Dis 2002; 34: e12-13. 12 Brickman HF ym. Tuberkuliinikokeiden ajoitus suhteessa immunisointiin elävillä virusrokotteilla. Pediatrics: 1975; 55: 392-396. 13 CDC. General recommendations on immunization: recommendations of the Advisory Committee on Immunization Practices (ACIP) and the American Academy of Family Physicians (AAFP). MMWR 2002; 51(RR-2): 1-36. 14 CDC. Guidelines for preventing the transmission of Mycobacterium tuberculosis in health-care settings, 2005. MMWR 2005; 54(RR-17): 1-141. 15 CDC. BCG-rokotteen rooli tuberkuloosin ehkäisyssä ja torjunnassa Yhdysvalloissa. Tuberkuloosin torjunnan neuvottelukunnan ja Immunisaatiokäytäntöjä käsittelevän neuvoa-antavan komitean yhteinen lausuma. MMWR 1996; 45(RR-4): 1-18. 16 CDC. Guidelines for the Investigation of Contacts of Persons with Infectious Tuberculosis: Recommendations from the National Tuberculosis Controllers Association and CDC. MMWR 2005; 54(RR-15): 1-37. Mori ja Shiozawa 17. Vihurirokkoinfektion aiheuttama tuberkuliiniyliherkkyyden tukahduttaminen. Am Rev Respir Dis 1985; 886-888. 18 CDC. Ohjeet opportunisti-infektioiden ehkäisyyn ja hoitoon HIV-infektoituneilla aikuisilla ja nuorilla. Suositukset CDC, National Institutes of Health, ja HIV Medicine Association of Infectious Diseases Society of America. MMWR 2009; 58(RR-4): 1-207. 19 CDC. Tuberkuloosin ehkäisy ja valvonta rangaistuslaitoksissa ja säilöönottolaitoksissa: CDC: n suositukset. MMWR 2006; 55(RR-9): 1-44. 20 Landia ym. Laimean tuberkuliinipuhdistetun proteiinijohdannaisen stabiilisuus äärilämpötiloissa. J Biol Stand 1981; 9:195-199. 21 Landi s, et al. Valon vaikutus tuberkuliinipuhdistettuihin proteiinijohdannaisiin. Am Rev Respir Tämä 1975; 111: 52-61. 22 Landia ym. Effect of oxidation on the stability of tuberculin purified protein derivative (PPD) julkaisussa: International Symposium on Tuberculins and BCG Vaccine. Basel: International Association of Biological Standardization, 1983. Dev Biol Stand 1986; 58: 545-552.
valmistaja:
Sanofi Pasteur Limited
Toronto Ontario Kanada
jakelija:
Sanofi Pasteur Inc.
Swiftwater PA 18370 USA
Tuotetiedot
Marraskuu 2020
pääasiallinen näyttöpaneeli – 1 mL: n injektiopullon etiketti
tuberkuliini puhdistettu
Proteiinijohdannainen
(Mantoux)
Tubersol®
Moniannospullo
1 mL (10 testiä)
Testiannos: 5 TU / 0, 1 mL ID.
suojaa valolta.
hävitä avattu
valmiste 30 päivän kuluttua.
vain Rx
Sanofi Pasteur Limited
avaamispäivämäärä

pääasiallinen näyttöpaneeli – 1 mL: n injektiopullon kotelo
NDC 49281-752-21
PPD
Tuberkuliinipuhdistettu proteiini
johdannainen (Mantoux)
tubersol®
Tween stabiloitu liuos
moniannosinjektiopullo 10 testiä 5 tu
RX vain
testiannos: 5 Tu/0, 1 ml intradermaalisesti.
Bio-equivalent to 5 US units (TU) of PPD-s
SANOFI PASTEUR
pääasiallinen näyttöpaneeli – 5 mL: n injektiopullon etiketti
Tuberkuliinipuhdistettu proteiini
johdannainen (Mantoux)
Tubersol®
Moniannospullo
5 mL (50 testiä)
testiannos: 5 Tu/0, 1 ml ID.
vain Rx
suojaa valolta.
hävitä avattu valmiste 30 päivän kuluttua.
Sanofi Pasteur Limited
Avaamispäivämäärä

pääasiallinen näyttöpaneeli – 5 mL: n injektiopullon kotelo
NDC 49281-752-22
PPD
Tuberkuliinipuhdistettu proteiini
johdannainen (Mantoux)
Tuberclerol®
tween stabiloitu liuos
moniannosinjektiopullo 50 testiä 5 tu
RX vain
testiannos: 5 Tu/0, 1 ml intradermaalisesti.
Bio-equivalent to 5 US units (TU) of PPD-S
SANOFI PASTEUR
| Tubersol tuberculin purified protein derivative injection, solution |
|||||||||||||||||||
|
|||||||||||||||||||
|
|||||||||||||||||||
|
|||||||||||||||||||
|
|||||||||||||||||||
|
|||||||||||||||||||
|
|||||||||||||||||||
Labeler – Sanofi Pasteur Inc. (086723285)
| Establishment | |||
| Name | Address | ID/FEI | Operations |
| Sanofi Pasteur Limited | 208206623 | MANUFACTURE(49281-752) | |
lisää Tubersolista (tuberkuliinipuhdistettu proteiinijohdannainen)
- sivuvaikutukset
- annostustiedot
- lääkkeiden yhteisvaikutukset
- hinnoittelu &Kupongit
- Lääkeaineluokka: in vivo diagnostiset biologiset aineet
imetys
Kuluttajaresurssit
professional resources
- lääkemääräystiedot
muut merkit aplisol
asiaan liittyvät hoito-ohjeet
- diagnoosi ja tutkimus
lääketieteellinen vastuuvapauslauseke