Generisk Navn: tuberkulin renset protein derivat
Doseringsform: injeksjon, løsning
Medisinsk anmeldt Av Drugs.com. sist oppdatert Nov 1, 2020.
- Oversikt
- Bivirkninger
- Dosering
- Profesjonell
- Interaksjoner
- MER
AHFS Kategori: 36:84
Rx only
Diagnostisk Antigen
(Hjelpemiddel i påvisning av infeksjon Med Mycobacterium tuberculosis)
For INTRADERMAL BRUK
Polysorbat 80 Stabilisert Løsning Av Tuberkulin Renset Proteinderivat For Tuberkulin Testing Hos Mennesker
Tubersol Beskrivelse
Tubersol® Tuberkulin Renset Proteinderivat (Mantoux) (Ppd) (1) for intradermal tuberkulin testing er fremstilt fra en stor hovedbatch connaught Tuberculin (ct68) (2) Og er en cellefri renset proteinfraksjon Oppnådd Fra en human stamme av mycobacterium Tuberculosis dyrket på en proteinfritt syntetisk medium og inaktivert. (2) bruken av et standardpreparat avledet fra en enkelt batch (CT68) er vedtatt for å eliminere batch til batch variasjon av samme produsent. (2)
Tubersol Er en klar, fargeløs væske.
| Tubersol inneholder: | |
| Renset proteinderivat Av m. tuberkulose | 5 tu per 0.1 mL |
| Polysorbate 80 | 0.0006% |
| Phenol | 0.22% to 0.35% w/v |
| in sterile isotonic phosphate buffered saline. | |
Before release, each successive lot is tested for potency in comparison with the US Standard Tuberculin PPD-S. (3)
Uavhengige studier utført AV US Public Health Service hos mennesker har bestemt MENGDEN CT68 i stabilisert løsning som er nødvendig (4) (5) (6) for å produsere bioekvivalens med Tuberkulin PPD-S (i fosfatbuffer uten polysorbat 80) ved bruk av 5 AMERIKANSKE enheter (TU) Tuberkulin PPD-S som standard.
Tubersol-Klinisk Farmakologi
Virkningsmekanisme
sensibiliseringen etter infeksjon med mykobakterier forekommer primært i de regionale lymfeknuter. Små lymfocytter (T-lymfocytter) sprer seg som respons på den antigene stimulansen for å gi opphav til spesielt sensibiliserte lymfocytter. Etter 3-8 uker kommer disse lymfocyttene inn i blodstrømmen og sirkulerer i årevis. (7) Etterfølgende restimulering av disse sensibiliserte lymfocyttene med det samme eller et lignende antigen, som intradermal Injeksjon Av Tubersol, fremkaller en lokal reaksjon mediert av disse cellene. (8)
typisk begynner forsinkede hypersensitivitetsreaksjoner på tuberkulin etter 5 til 6 timer, er maksimale ved 48 til 72 timer og avtar over en periode på dager. Den resulterende immunresponsen består av indurasjon på grunn av celleinfiltrasjon og noen ganger vesikulasjon og nekrose. Klinisk forsinket hypersensitivitetsreaksjon på tuberkulin er en manifestasjon av tidligere Infeksjon med tuberkulose m eller en rekke ikke-tuberkulosebakterier. I de fleste tilfeller er sensibilisering indusert av naturlig mykobakteriell infeksjon eller ved vaksinasjon MED BCG-Vaksine.
Indikasjoner og Bruk For Tubersol
Tubersol Tuberkulin Renset Proteinderivat (Mantoux), er indisert for å hjelpe diagnose av tuberkuloseinfeksjon (TB) hos personer med økt risiko for å utvikle aktiv sykdom.Centers For Disease Control And Prevention (CDC) har publisert retningslinjer for populasjoner som vil ha nytte av tuberkulin hud testing (TST). Gjeldende anbefalinger kan nås på: http://www.cdc.gov/tb/publications/factsheets/testing.htm.
TIDLIGERE BCG-vaksinasjon er ikke en kontraindikasjon for tuberkulinprøving. Hudtestresultatene fra BCG-vaksinerte personer kan brukes til å støtte eller utelukke diagnosen TB-infeksjon. EN FDA-godkjent interferon gamma release assay er imidlertid foretrukket over tuberkulin hudtest for personer 5 år og eldre som tidligere ble vaksinert med BCG. (9)
Kontra
Allergi Mot noen komponent Tubersol eller anafylaktisk eller annen allergisk reaksjon på en tidligere test tuberkulin PPD er en kontraindikasjon For Bruk Tubersol. (SE BESKRIVELSE OG HVORDAN LEVERT.)
Tubersol skal ikke administreres til:
- Personer som har hatt en alvorlig reaksjon (f. eks. nekrose, blemmer, anafylaktisk sjokk eller sårdannelse) på en tidligere TST,
- Personer med dokumentert aktiv tuberkulose eller en klar historie med BEHANDLING FOR TB-infeksjon eller sykdom, (10)
- Personer Med omfattende brannskader eller eksem.
Advarsler
Overfølsomhet
Allergiske reaksjoner kan oppstå Etter Bruk Av Tubersol, selv hos personer uten tidligere overfølsomhet overfor produktkomponentene. (11) Adrenalin injeksjon (1:1000) og andre egnede midler som brukes til å kontrollere umiddelbare allergiske reaksjoner, må være umiddelbart tilgjengelige.
Synkope
Synkope (besvimelse) kan forekomme i forbindelse med administrering av injiserbare legemidler, inkludert Tubersol. Prosedyrer bør være på plass for å unngå fallskader og for å gjenopprette cerebral perfusjon etter synkope.
Forholdsregler
Generelt
Diagnostiske Begrensninger
Falske positive eller falske negative tuberkulin hudtestreaksjoner kan forekomme hos enkelte individer. (Se Tolkning Av Testen.)
Falske positive tuberkulinreaksjonstester forekommer hos personer som har blitt infisert med andre mykobakterier, inkludert vaksinasjon MED BCG.
Ikke alle infiserte personer vil ha en forsinket overfølsomhetsreaksjon på tuberkulinprøve.
Mange faktorer har blitt rapportert å forårsake redusert evne til å reagere på tuberkulinprøven i nærvær av tuberkuløs infeksjon. (Se Tolkning Av Testen.)
Informasjon til Pasienter
Før Administrering Av Tubersol, bør pasientens nåværende helsetilstand og sykehistorie gjennomgås. Legen bør gjennomgå pasientens immuniseringshistorie for mulig følsomhet overfor Komponenter Av Tubersol.
helsepersonell bør informere pasienten om behovet for å returnere for lesing av testen. Selvlesning av testen har vist seg å være unøyaktig og upålitelig.
helsepersonell bør gi pasienten en permanent personlig rekord. I tillegg er det viktig at helsepersonell registrerer testhistorikken i den permanente medisinske journalen til hver pasient. Denne permanente kontorrekorden skal inneholde navnet på produktet, oppgitt dato, dose, produsent og lotnummer, samt testresultatet i millimeter indurasjon (inkludert 0 mm, hvis det er hensiktsmessig). Rapportering av resultater bare som negativ eller positiv er ikke tilfredsstillende.
Legemiddelinteraksjoner
Reaktivitet til testen kan være deprimert eller undertrykt hos personer som får kortikosteroider eller immunsuppressive midler. (8)
Reaktivitet Til Tubersol kan være midlertidig deprimert av visse levende virusvaksiner (meslinger, kusma, rubella, oral polio, gul feber og varicella). Hvis en parenteral levende, svekket virusvaksine nylig er administrert, bør tuberkulinprøving utsettes for >1 måned etter vaksinasjon. (8) (12) (Se Tolkning Av Testen.)
når tuberkulin screening er nødvendig samtidig med en meslinger-inneholdende vaksine eller annen parenteral levende, svekket virusvaksine, er samtidig administrering Av Tubersol og vaksinen på separate steder det foretrukne alternativet.
KARSINOGENESE, MUTAGENESE, NEDSATT FERTILITET
Tubersol er ikke evaluert for dets karsinogene eller mutagene potensialer eller nedsatt fertilitet.
Graviditet
reproduksjonsstudier På Dyr er ikke utført med Tubersol. Det er heller ikke kjent om Tubersol kan forårsake fosterskader når det administreres til en gravid kvinne eller kan påvirke reproduksjonskapasiteten. Tubersol bør kun gis til en gravid kvinne hvis det er klart nødvendig.
Ammende Mødre
Det er ikke kjent Om Tubersol utskilles i morsmelk hos mennesker. Fordi mange legemidler utskilles i morsmelk, bør det utvises forsiktighet når Tubersol administreres til en sykepleier.
Pediatrisk Bruk
det er ingen kontraindikasjon for tuberkulin hudtesting av spedbarn. Spedbarn < 6 måneder som er infisert Med m. tuberculosis kan ikke reagere På Tubersol. (Se Tolkning Av Testen.)
Geriatrisk Bruk
Kliniske studier av Tubersol inkluderte ikke tilstrekkelig antall forsøkspersoner i alderen 65 år og eldre til å avgjøre om De responderte annerledes enn yngre forsøkspersoner.
Bivirkninger
Indurasjon På Tubersol injeksjonssted er den forventede reaksjonen for en positiv hudtest. (Se Tolkning Av Testen.)
informasjonen vedrørende bivirkninger er samlet fra historiske kliniske studier og erfaring etter markedsføring med Tubersol.
Generelle lidelser og reaksjoner på administrasjonsstedet
Smerter på Injeksjonsstedet, kløe på injeksjonsstedet og ubehag på injeksjonsstedet. Erytem på injeksjonsstedet eller utslett på injeksjonsstedet (uten indurasjon) innen 12 timer etter testing. Disse reaksjonene indikerer IKKE TB-infeksjon. Blødning på injeksjonsstedet og hematom på injeksjonsstedet opptil tre dager etter administrering av testen. Vesikler på injeksjonsstedet, sår på injeksjonsstedet eller nekrose på injeksjonsstedet hos svært følsomme personer. Injeksjonsstedet arr som følge av sterkt positive reaksjoner. Pyreksi
Forstyrrelser I Immunsystemet
Overfølsomhet, inkludert anafylaksi/anafylaktiske reaksjoner, angioødem, urtikaria
Sykdommer I Luftveiene, thorax og mediastinum
Stridor, dyspnø
Sykdommer I Hud og underhud
Utslett, generalisert utslett
Sykdommer I Nervesystemet
Presynkope, synkope (inkludert synkope forbundet med tonisk-kloniske bevegelser og annen krampelignende aktivitet) som noen ganger resulterer i forbigående tap av bevissthet med skade
Rapportering Av Bivirkninger
kontakt legemiddelovervåkning for å rapportere mistenkte bivirkninger Avdeling, Sanofi Pasteur Inc., Discovery Drive, Swiftwater, PA 18370 eller ring 1-800-822-2463 (1-800-VAKSINE) Eller Food And Drug Administration (FDA) Medwatch Program på 1-800-332-1088 Og www.fda.gov/medwatch.
Tubersol Dosering og Administrasjon
Dosering
Fem (5) tuberkulinenheter (TU) per testdose på 0,1 mL er standardstyrken som brukes til intradermal (Mantoux) testing.
Administrasjonsmåte
Tubersol er kun indisert for intradermal injeksjon. Ikke injiser intravenøst, intramuskulært eller subkutant. Hvis subkutan injeksjon oppstår, kan testen ikke tolkes.
Inspiser for fremmede partikler og / eller misfarging før bruk. Hvis disse forholdene eksisterer, må du ikke administrere produktet.
Bruk en separat sprøyte og kanyle til hver injeksjon. (13)
Følgende prosedyre anbefales for Å utføre Mantoux-testen:
- det foretrukne stedet for testen er volar-aspektet av underarmen. Unngå områder på huden som er røde eller hovne. Unngå synlige årer.
- Rengjør hudstedet med et egnet bakteriedrepende middel og la området tørke før injeksjon av antigenet.
- Administrer testdosen (0,1 mL) Tubersol med en 1 mL sprøyte kalibrert i tiendedeler og utstyrt med en kort, en fjerdedel til en halv tomme, 26 eller 27 gauge nål.
- Tørk av proppen på hetteglasset med et egnet bakteriedrepende middel og la det tørke før kanylen settes inn. Stikk deretter nålen forsiktig gjennom proppen og trekk 0,1 mL Tubersol inn i sprøyten. Unngå injeksjon av overflødig luft ved fjerning av hver dose slik at hetteglasset ikke presses for høyt og muligens kan føre til lekkasje på stikkstedet.
- Stikk nålens punkt inn i de mest overfladiske lagene i huden med kanylens skråkant pekende oppover og administrer dosen ved langsom intradermal injeksjon. Hvis den intradermale injeksjonen utføres på riktig måte, vil en bestemt blek bleb stige ved nålpunktet, omtrent 10 mm (3/8″) i diameter. Dette bleb vil spre i løpet av minutter. Ikke kle på nettstedet.
- en dråpe blod kan forekomme på administrasjonsstedet etter injeksjon. Blot området lett å fjerne blodet, men unngå å klemme ut injisert tuberkulin test væske.
i tilfelle en feil utført injeksjon (dvs. ingen bleb dannet), gjenta testen umiddelbart på et annet sted, minst 2 tommer fra det første stedet og sirkel det andre injeksjonsstedet som en indikasjon på at dette er stedet som skal leses.
Informer pasienten om behovet for å returnere for lesing av testen av en utdannet helsepersonell. Selvlesning kan være unøyaktig og er sterkt motløs.
Tolkning av Testen
hudtesten bør leses av en utdannet helsepersonell 48 til 72 timer etter administrering Av Tubersol. Hudtestfølsomhet indikeres kun ved indurasjon; rødhet skal ikke måles.
Mål diameteren av indurasjonen på tvers av underarmens lange akse og registrer målingen i millimeter (inkludert 0 mm). (8) spissen på en kulepenn, som forsiktig skyves i en 45° vinkel mot injeksjonsstedet, vil stoppe ved kanten av indurasjonen.
registrerer også tilstedeværelse og størrelse (hvis tilstede) av nekrose og ødem, selv om disse ikke brukes i tolkningen av testen.
Positive Reaksjoner
Tuberkulinreaktivitet kan indikere latent infeksjon, tidligere infeksjon og / eller sykdom Med m. tuberculosis og indikerer ikke nødvendigvis tilstedeværelse av aktiv tuberkuløs sykdom. Personer som viser positive tuberkulinreaksjoner bør vurderes som positive i henhold til gjeldende retningslinjer for folkehelse og henvises til videre medisinsk evaluering. (8) (10) gjentatt testing av uinfiserte personer sensibiliserer dem ikke For Tubersol. (7) (8) (10)
betydningen av indurasjonsmålinger ved diagnostisering av latent TB-infeksjon må vurderes ut fra pasientens anamnese og risikoen for å utvikle aktiv TB-sykdom som angitt i Tabell 1. (10)
| reaksjon ≥10 mm Av Indurasjon | reaksjonsmessig 10 mm Av Indurasjon | reaksjon ≥15 mm indurasjon |
|---|---|---|
| * risiko for tb hos pasienter behandlet med kortikosteroider øker med høyere dose og lengre varighet. For personer som ellers har lav risiko og som testes i begynnelsen av arbeidsforholdet, anses en reaksjon på ≥15 mm indurasjon som positiv. | HIV-positive personerNylige kontakter av tuberkulose (TB) case pasienter Fibrotiske endringer på brystet radiografi i samsvar med tidligere TB Pasienter med organtransplantasjoner og andre immunsupprimerte pasienter (som får tilsvarende ≥15 mg/d prednison i 1 måned eller mer)* |
nylige innvandrere (dvs. i løpet av de siste 5 årene) fra land med høy prevalens injection drug users innbyggere eller ansatte† av følgende høyrisiko congregate Innstillinger: fengsler og fengsler, sykehjem og andre langsiktige fasiliteter for eldre, sykehus og andre helseinstitusjoner, boliger for pasienter med ervervet immunsvikt syndrom (AIDS) og hjemløse shelters Mycobacteriology laboratoriepersonell Personer med følgende kliniske tilstander som plasserer dem i høy risiko: silikose, diabetes mellitus, kronisk nyresvikt, noen hematologiske lidelser (f. eks leukemi og lymfomer), andre spesifikke maligniteter (f. eks. av ideell kroppsvekt , gastrektomi og jejunoileal bypass Barn yngre enn 4 år eller spedbarn, barn og ungdom eksponert for voksne med høy risiko |
Personer uten risikofaktorer for TB |
en tst-konvertering er definert som en økning av ≥10 mm i løpet av en 2-års periode, uansett alder. (10)
muligheten bør vurderes at hudtestfølsomheten også kan skyldes tidligere kontakt med atypiske mykobakterier eller TIDLIGERE BCG-vaksinasjon. (8) (10)
Negative Reaksjoner
en person som ikke viser en positiv reaksjon på 5 TU på den første testen, men mistenkes FOR Å VÆRE TB positiv, kan testes på nytt med 5 TU. (Se Booster Effekt Og To-Trinns Testing. Enhver person som ikke viser en positiv reaksjon på en første injeksjon av 5 TU, eller en andre test med 5 TU kan betraktes som tuberkulin negativ.
Falske Positive reaksjoner
Falske positive tuberkulinreaksjoner kan forekomme hos personer som har blitt infisert med andre mykobakterier, inkludert vaksinasjon MED BCG. (8) en diagnose av M. tuberkuloseinfeksjon og bruk av forebyggende behandling bør imidlertid vurderes for ENHVER BCG-vaksinert person som har en positiv TST-reaksjon, spesielt hvis personen har vært eller har økt risiko for Å få TB-infeksjon. (SE INDIKASJONER OG BRUK.) (14) (15)
Falske Negative Reaksjoner
ikke alle infiserte personer vil ha en forsinket overfølsomhetsreaksjon på tuberkulinprøve.
hos de som er eldre eller de som blir testet for første gang, kan reaksjonene utvikle seg sakte og kan ikke toppes før etter 72 timer.
siden tuberkulinfølsomhet kan ta opptil 8 uker å utvikle seg etter eksponering For m. tuberculosis (Se Virkningsmekanisme), bør personer som har en negativ tuberkulinprøve <8 uker etter mulig TB-eksponering testes på nytt 8-10 uker etter siste kjente eller mistenkte eksponering. (16)
Endret Immunstatus
Svekket eller svekket cellemediert immunitet (CMI) kan potensielt forårsake en falsk negativ tuberkulinreaksjon. Mange faktorer har blitt rapportert å forårsake redusert evne til å reagere på tuberkulinprøven ved tilstedeværelse av tuberkuløs infeksjon, inkludert virusinfeksjoner (f. eks. meslinger, kusma, vannkopper og HIV), levende virusvaksinasjoner( f. eks. tuberkulose, andre bakterielle infeksjoner, leukemi, sarkoidose, soppinfeksjoner, metabolske derangements, lav protein tilstander, sykdommer som påvirker lymfoide organer, narkotika (kortikosteroider og mange andre immunsuppressive midler), og malignitet eller stress. (8) (17) (18) EN TST bør utsettes for pasienter med store virusinfeksjoner eller levende virus vaksinasjon i den siste måneden. Personer med forkjølelse kan være tuberkulin testet.
FORDI TST-resultater hos HIV-infiserte individer er mindre pålitelige da CD4-tellingene avtar, bør screeningen fullføres så tidlig SOM mulig etter AT HIV-infeksjon oppstår. (18)
Boostereffekt og Totrinns Testing
hvis tuberkulinprøving vil bli utført med jevne mellomrom, for eksempel blant helsepersonell eller fengselsarbeidere, bør totrinns testing utføres som en baseline for å unngå å tolke en boostereffekt som tuberkulinomdannelse. Hvis den første testen viste enten ingen reaksjon eller en liten reaksjon, bør den andre testen utføres en til fire uker senere. Begge testene skal leses og registreres på 48 til 72 timer. Pasienter med en annen tuberkulinprøve (booster) respons på ≥10 mm bør vurderes å ha opplevd TIDLIGERE TB-infeksjon. (14) (19)
Personer som ikke øker når de får gjentatte tester på en uke, men hvis tuberkulinreaksjoner endres til positive etter ett år, bør vurderes å ha nylig ervervet tuberkuloseinfeksjon og behandles deretter. (7)
Hvordan Leveres Tubersol
Tubersol Tuberkulin Renset Proteinderivat (Mantoux), bioekvivalent til 5 amerikanske enheter (TU) PPD-s per testdose (0.1 mL) leveres i:
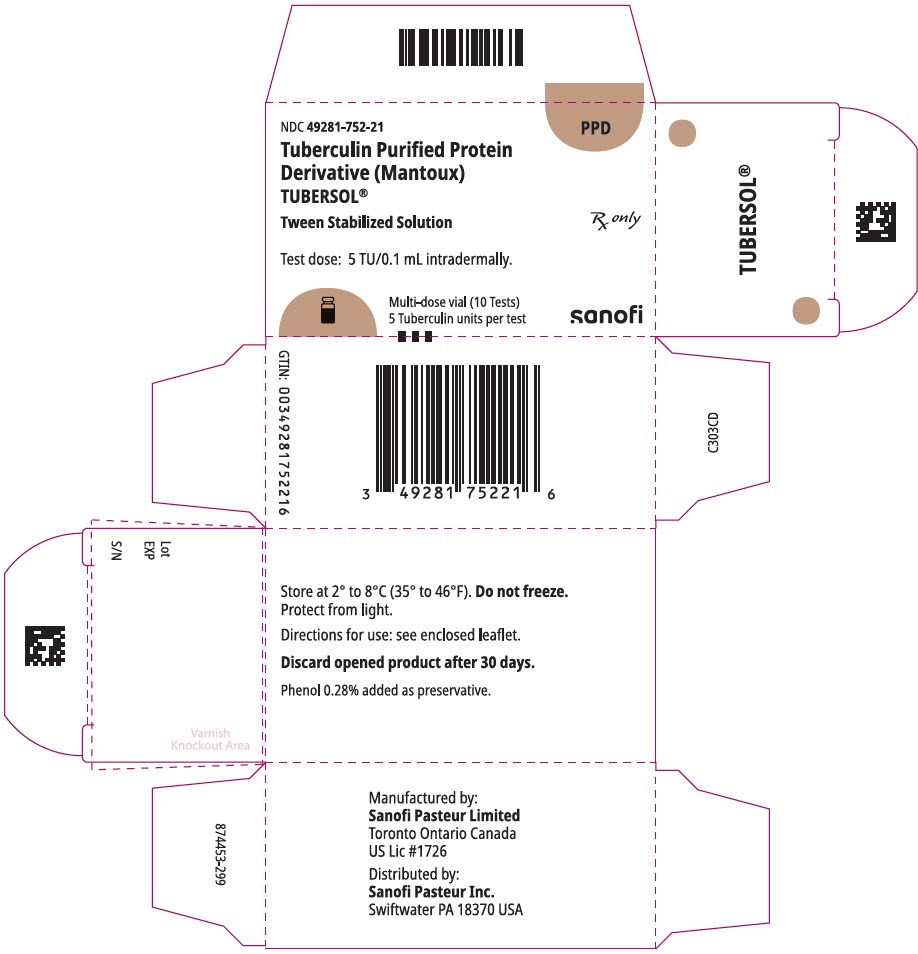
1 mL flerdosehetteglass (10 tester). NDC Nr. 49281-752-78; pakning med 1 hetteglass, NDC nr. 49281-752-21
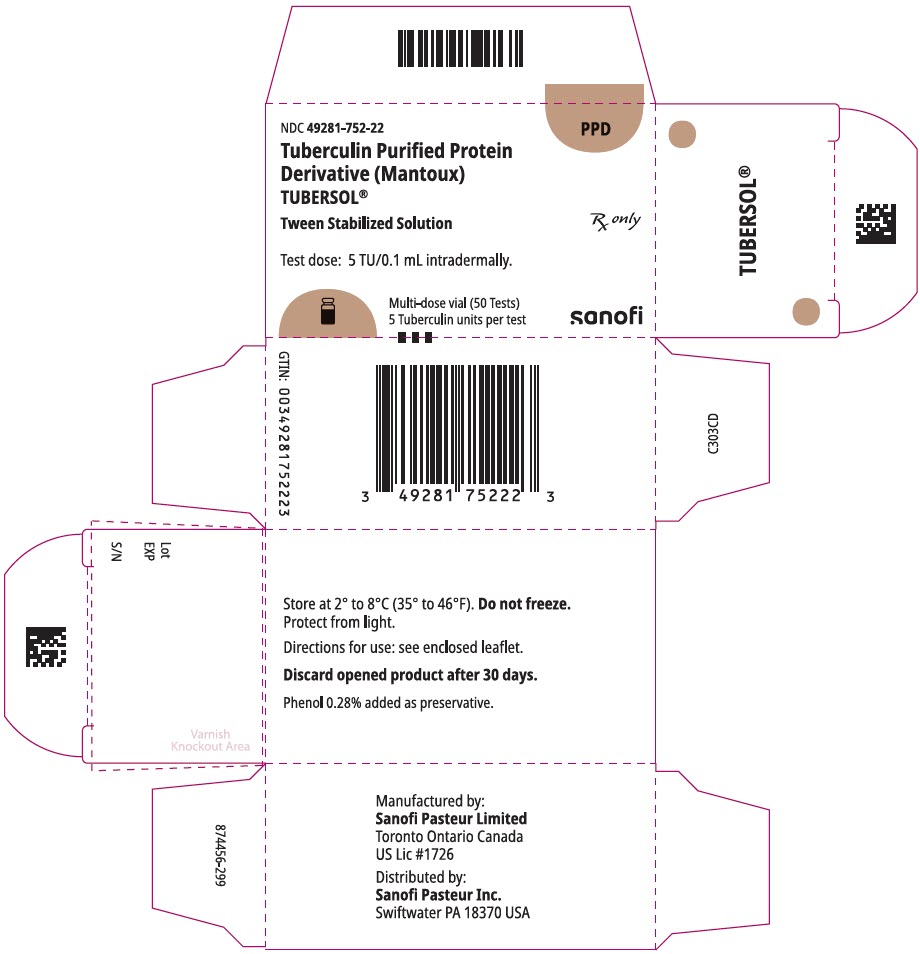
5 mL flerdosehetteglass (50 tester). NDC No. 49281-752-98; pakning med 1 hetteglass, NDC No. 49281-752-22
proppen på hetteglasset for dette produktet inneholder ikke naturlig lateksgummi.
LAGRING
Oppbevares ved 2° til 8°C (35° til 46°F). (20) må ikke fryses. Kast produktet hvis det utsettes for frysing.
Beskytt mot lys. Tuberkulin PPD-løsninger kan påvirkes negativt ved eksponering for lys. Produktet skal oppbevares i mørket, unntatt når dosene faktisk trekkes ut av hetteglasset. (21)
Et hetteglass Med Tubersol som er lagt inn og i bruk i 30 dager, skal kastes. (22)
ikke bruk etter utløpsdato.
1 Landi S. Forberedelse, rensing og stabilitet av tuberkulin. Appl Mikrobiol 1963; 11: 408-412. 2 Landi S, et al. Forberedelse og karakterisering av en stor gruppe tuberkulinrenset proteinderivat (PPD-CT68). Ann Scalvo.1980;22:889-907. 3 US Code Of Federal Regulations, Tittel 21, Del 610, Del C-standard forberedelser og grenser for potens. 4 Landi S, et al. Adsorpsjon av tuberkulin PPD til glass og plast overflater. Bull. HVEM 1966;35: 593-602. 5 Landi S, et al. Ulik styrke mellom stabiliserte og ikke-stabiliserte fortynnede tuberkulinløsninger. Jeg Er Pastor I 1971; 104: 385-393. 6 Landi S, et al. Stabilitet av fortynnede løsninger av tuberkulinrenset proteinderivat. Tuberkel 1978; 59: 121-133. 7 Menzies D. Tolkning av gjentatte tuberkulinprøver. Er J Respir Crit Omsorg Med 1999; 159: 15-21. 8 American Thoracic Society: Diagnostiske standarder og klassifisering av tuberkulose hos voksne og barn. Er J Respir Crit Omsorg Med 2000; 161: 1376-1395. 9 CDC. Oppdaterte Retningslinjer For Bruk Av Interferon Gamma Release Assays For Å Oppdage Mycobacterium tuberculosis Infeksjon-Usa, 2010. MMWR 2010; 59 (RR-5):1-25. 10 CDC. Målrettet tuberkulinprøving og behandling av latent tuberkuloseinfeksjon. MMWR 2000;49(RR-6):23-5. 11 Froeschle JE, et al. Umiddelbare overfølsomhetsreaksjoner etter bruk av tuberkulin hudtesting. Clin Infisere Dette 2002; 34: e12-13. 12 Brickman HF, et al. Tidspunktet for tuberkulinprøver i forhold til immunisering med levende virale vaksiner. Pediatri: 1975;55:392-396. 13 CDC. Generelle anbefalinger om immunisering: anbefalinger Fra Advisory Committee on Immunization Practices (ACIP) og American Academy Of Family Physicians (Aafp). MMWR 2002;51(RR-2):1-36. 14 CDC. Retningslinjer for forebygging av overføring Av Mycobacterium tuberculosis i helsevesenet, 2005. MMWR 2005;54(RR-17):1-141. 15 CDC. BCG-vaksinens rolle i forebygging og kontroll av tuberkulose i Usa. En felles uttalelse Fra Advisory Council For Elimination Of Tuberculosis og Advisory Committee on Immunization Practices. MMWR 1996; 45(RR-4):1-18. 16 CDC. Retningslinjer For Undersøkelse Av Kontakt Med Personer Med Smittsom Tuberkulose: Anbefalinger Fra National Tuberculosis Controllers Association og CDC. MMWR 2005;54(RR-15):1-37. 17 Mori og Shiozawa. Suppression av tuberkulin overfølsomhet forårsaket av rubella infeksjon. Er Rev Respir Dis 1985; 886-888. 18 CDC. Retningslinjer for forebygging og behandling AV opportunistiske infeksjoner HOS HIV-infiserte voksne og ungdom. Anbefalinger fra CDC, National Institutes Of Health og HIV Medicine Association Of Infectious Diseases Society Of America. MMWR 2009;58(RR-4):1-207. 19 CDC. Forebygging og kontroll av tuberkulose i fengsler og fengsler: ANBEFALINGER FRA CDC. MMWR 2006;55(RR-9):1-44. 20 Landi S, et al. Stabilitet av fortynnet oppløsning av tuberkulinrenset proteinderivat ved ekstreme temperaturer. J Biol Står 1981;9: 195-199. 21 Landi S, et al. Effekt av lys på tuberkulinrensede proteinderivatløsninger. Det Er Rev Respir Dette 1975; 111: 52-61. 22 Landi S, et al. Effekt av oksidasjon på stabiliteten av tuberkulinrenset proteinderivat (PPD) I: Internasjonalt Symposium På Tuberkuliner og BCG-Vaksine. Basel: Internasjonal Forening For Biologisk Standardisering, 1983. Dev Biol Står 1986;58:545-552.
Produsert Av:
Sanofi Pasteur Limited
Toronto Ontario Canada
Distribuert Av:
Sanofi Pasteur Inc.
Swiftwater PA 18370 USA
Produktinformasjon fra
November 2020
HOVEDSKJERMPANEL – 1 mL Hetteglassetikett
Tuberkulinrenset
Proteinderivat
(Mantoux)
tubersol®
multidose hetteglass
1 mL (10 Tester)
Testdose: 5 TU / 0,1 mL ID.
Beskytt mot lys.
Kast åpnet
produkt etter 30 dager.Sanofi Pasteur Limited
dato åpnet

HOVEDSKJERMPANEL – 1 mL Hetteglass Kartong
NDC 49281-752-21
PPD
Tuberkulin Renset Protein
Derivat (Mantoux)
tubersol®
tween stabilisert Oppløsning
multidose hetteglass 10 tester 5 tu
kun rx
testdose: 5 tu/0,1 ml intradermalt.
Bio-ekvivalent med 5 amerikanske enheter (TU) AV PPD-s
SANOFI PASTEUR
HOVEDSKJERMPANEL – 5 mL Hetteglassetikett
Tuberkulinrenset Protein
Derivat (Mantoux)
tubersol®
multidose hetteglass
5 mL (50 Tester)
testdose: 5 tu/0,1 ML ID.
Bare Rx
Beskytt mot lys.
Kast åpnet produkt etter 30 dager.
Sanofi Pasteur Limited
dato åpnet

HOVEDSKJERMPANEL – 5 mL Hetteglass
NDC 49281-752-22
PPD
Tuberkulinrenset Protein
Derivat (Mantoux)
tubersol®
tween stabilisert Oppløsning
multidose hetteglass 50 tester 5 tu
kun rx
testdose: 5 tu / 0,1 ml intradermalt.
Bio-equivalent to 5 US units (TU) of PPD-S
SANOFI PASTEUR
| Tubersol tuberculin purified protein derivative injection, solution |
|||||||||||||||||||
|
|||||||||||||||||||
|
|||||||||||||||||||
|
|||||||||||||||||||
|
|||||||||||||||||||
|
|||||||||||||||||||
|
|||||||||||||||||||
Labeler – Sanofi Pasteur Inc. (086723285)
| Establishment | |||
| Name | Address | ID/FEI | Operations |
| Sanofi Pasteur Limited | 208206623 | MANUFACTURE(49281-752) | |
Mer Om Tubersol (tuberkulin renset protein derivat)
- Bivirkninger
- Amming
- Dosering Informasjon
- Interaksjoner
- Priser & Kuponger
- Drug class: in vivo diagnostiske biologiske
Forbruker ressurser
- avansert Lesing
profesjonelle ressurser
- forskrivningsinformasjon
- diagnose og undersøkelse
andre merker aplisol relaterte behandlingsveiledninger
medisinsk ansvarsfraskrivelse