Dofetilde: um novo antiarrítmico de classe III
Volume III, número 4/Setembro / Outubro de 2000 Jodie Zalewski, Pharm.D.
Voltar a Farmacoterapia Índice de Atualização
Introdução
Dofetilida (Tikosyn®) é uma nova classe III agente antiarrítmico usado para a conversão e manutenção do ritmo sinusal normal em pacientes altamente sintomáticos fibrilação atrial/flutter. É diferente de outros antiarrítmicos de classe III na medida em que exibe bloqueio selectivo do canal de potássio, sem efeito no sistema de condução. Dofetilida prolonga a repolarização auricular e ventricular, aumentando assim o período refractário no músculo cardíaco. Outros agentes antiarrítmicos de classe III possuem propriedades antiarrítmicas adicionais. O Sotalol (um bloqueador beta) e a amiodarona diminuem a condução nodal. Por esta razão, juntamente com as toxicidades orgânicas da amiodarona (e.g. fibrose pulmonar, disfunção tiroideia e hepática), estes fármacos não são adequados para todos os doentes. O mecanismo selectivo da dofetilida parece ser melhor do que outros agentes da sua classe; contudo, a dofetilida deve ainda ser utilizada com precaução devido aos seus efeitos adversos.
efeitos adversos
Uma vez que o dofetilida actua no canal de potássio e aumenta o potencial de acção, ocorre um prolongamento do intervalo QT, que está associado a torsades de pointes. O prolongamento do intervalo QT está directamente relacionado com a dose e a concentração plasmática de dofetilida. A concentração pode aumentar devido a Interacções medicamentosas ou a uma função renal deficiente. Por conseguinte, a dofetilida está reservada para utilização apenas em doentes altamente sintomáticos.
A FDA mandatou o fabricante de dofetilida, a Pfizer, para impor diretrizes rigorosas para assegurar o uso apropriado e a dosagem correta. O impulso foi o aumento da consciência do potencial para torsades de pointes induzidos pela droga (demonstrado pela remoção do astemizol, terfenadina e cisaprida do mercado). Para que a terapêutica com dofetilida seja iniciada, o doente deve ser admitido num hospital certificado durante pelo menos 72 horas para monitorização cardíaca. Antes de um hospital ser uma instalação certificada, um formulário que verifique a conclusão do programa de Educação da Pfizer por membros do pessoal deve estar em arquivo com a empresa.
avaliação do doente
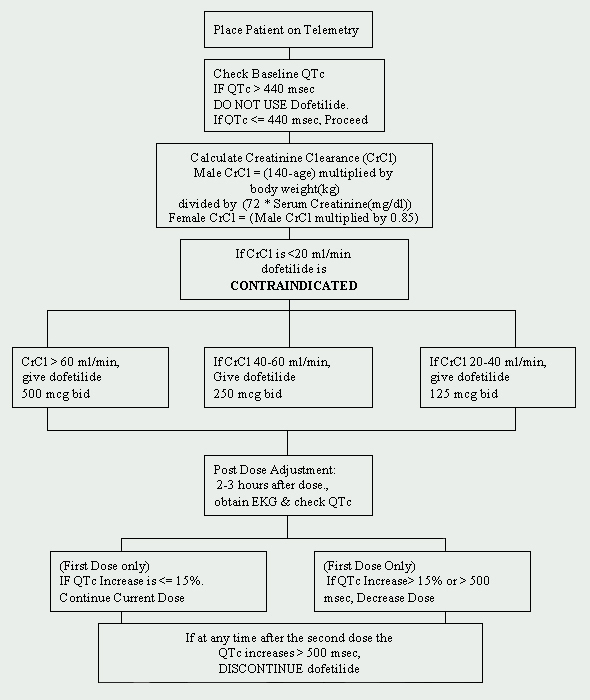
na Cleveland Clinic Foundation, a dofetilida está restrita ao Departamento de Cardiologia. Foi implementado um protocolo para o início da dofetilida e está em conformidade com os regulamentos impostos pelo fabricante (ver Figura 1). Os doentes a iniciar o tratamento com dofetilida devem ser admitidos numa unidade de telemetria aprovada para monitorização electrocardiográfica (ECG). Esta monitorização é necessária para determinar a presença de prolongamento do intervalo QT. Os valores basais de QTc (intervalo QT corrigido: QTc = QTMsec / raiz quadrada de RR sec ) são necessários e se o QTc for superior a 440Msec (500 Msec em doentes com anomalias da condução ventricular), o dofetilida está contra-indicado.
outra avaliação basal crucial é a função renal. Uma vez que a dofetilida é eliminada por via renal, a insuficiência renal (medida pela depuração da creatinina ) pode levar à acumulação de dofetilida, aumentando assim o risco de arritmias. A dose inicial de dofetilida é determinada pela depuração da creatinina (ver Quadro 1). Os doentes com função renal normal (ClCr>
60 ml/min) são iniciados com 500 mcg administrados por via oral duas vezes por dia. A dofetilida está contra-indicada em doentes com depuração da creatinina< 20 ml/min.
posição numa tabela 1: Initial Dofetilide Dose
| Calculated CrCl (ml/min) | Dofetilide Dose |
|---|---|
| >60 | 500 mcg twice daily |
| 40-60 | 250 mcg twice daily |
| 20-39 | 125 mcg twice daily |
| <20 | 125 mcg twice daily |
deve também ser obtido um painel metabólico básico de base (BMP). As anomalias electrolíticas devem ser corrigidas antes do início da terapêutica com dofetilida, uma vez que a hipocaliemia e a hipomagnesemia podem tornar os doentes mais susceptíveis às arritmias. Se o potássio sérico (K+) for < 4 mEq/L e/ou o magnésio sérico (Mg++) for < 2 mEq/L, então as deficiências devem ser repostas e verificadas antes da administração de dofetilida.as interacções medicamentosas devem também ser abordadas antes de se iniciar a terapêutica com dofetilida. O uso concomitante de verapamil (Calan®, Calan SR®, Covera-HS®, Isoptin®, Isoptin SR®, Verelan®, Verelan PM®), cimetidina (Tagamet®), trimetoprim (Proloprim®, Trimpex®, ou na combinação de produtos de Bactrim®, Septra®), cetoconazol (Nizoral®), proclorperazina (Compazine®) e de megestrol (Megace®) com dofetilida é contra-indicado. Estes agentes retardam a eliminação da dofetilida inibindo o sistema de transporte renal, o que conduz a um aumento dos níveis de dofetilida. Além disso, medicamentos que não inibem, mas que são secretados por esta via devem ser usados com precaução (ex., triamtereno, metformina, amilorida). Outros agentes que devem ser evitados são aqueles que prolongam o intervalo QT, tais como as fenotiazinas, cisaprida, bepridil, antidepressivos tricíclicos, eritromicina, e classe I (por exemplo, quinidina, procainamida, lidocaína, flecainida) e classe III de agentes antiarrítmicos. Por último, os agentes que causam hipocaliemia ou hipomagnesemia, tais como diuréticos, também devem ser utilizados com precaução. se o doente não tiver contra-indicações, pode iniciar-se a administração, a monitorização e a administração de dofetilida. Um ECG repetido é realizado 2 a 3 horas após a primeira dose para avaliar o intervalo QTc. Se o intervalo QTc tiver aumentado > 15% ou se o QTc for > 500Msec (550Msec em doentes com anomalias da condução ventricular), a dose de dofetilida deve ser diminuída. Em geral, a dose é reduzida para metade (Ver Tabela 2). Durante o resto do período de início de 72 horas, a monitorização do electrocardiograma é realizada duas a três horas após cada dose subsequente de dofetilida. Não são recomendadas reduções adicionais de dose com base no intervalo QTc. Se, em qualquer altura após a segunda dose, o QTc se tornar > 500Msec (550 Msec em doentes com anomalias da condução ventricular), o dofetilida deve ser interrompido. A monitorização cardíaca contínua por telemetria é continuada durante um mínimo de 72 horas, ou 12 horas após a conversão eléctrica ou farmacológica ao ritmo sinusal normal, consoante o que for maior.
Tabela 2: Prolongation Ajuste de Tabela
| Dose Inicial com Base na CrCl | Dose Ajustada (para prolongation) |
|---|---|
| 500 mcg, duas vezes ao dia | 250 mcg duas vezes ao dia |
| 250 mcg duas vezes ao dia | 125 mcg duas vezes ao dia |
| 125 mcg duas vezes ao dia | 125 mcg uma vez ao dia |
a Pfizer, em conjunto com a FDA, o que tem levado outro passo para assegurar o uso adequado de dofetilida. Apenas uma farmácia (por correspondência) nos Estados Unidos, Statlanders farmácia na Pensilvânia, dispensa dofetilide. Um formulário de inscrição dos Serviços de farmácia deve ser preenchido e enviado por fax aos estatistas antes da alta do paciente para evitar a interrupção da terapia. Após a alta, os pacientes recebem uma semana de fornecimento de drogas. Este fornecimento dá ao paciente medicação suficiente até que sua receita por correio é entregue.
conclusão
embora a dofetilida seja um agente antiarrítmico eficaz para a fibrilhação/flutter Auricular sintomático, deve ser iniciada com precaução. É necessária a estrita adesão às diretrizes definidas pela FDA para garantir a segurança do paciente.