US Pharm. 2017; 42(1):HS16-HS20.
rezumat: agenții de blocare neuromusculară (NMBAs) joacă un rol important în gestionarea unui număr mare de pacienți spitalizați. Farmacologia NMBAs este bine înțeleasă, dar utilizarea acestor agenți poate fi controversată. NMBAs sunt frecvente în situații chirurgicale și intubare rapidă a secvenței, dar alte indicații, cum ar fi sindromul de detresă respiratorie acută, hipotermia terapeutică și presiunea intracraniană crescută, sunt oarecum divizive. Este esențial ca farmaciștii să fie familiarizați cu implicațiile clinice și rezultatele asociate cu utilizarea NMBA. În plus, este important să se înțeleagă considerente concurente, cum ar fi sedarea, monitorizarea și inversarea. Farmaciștii din spital ar trebui să fie familiarizați cu noul medicament sugammadex (Bridion) aprobat recent.
agenții de blocare neuromusculară (NMBAs) joacă un rol important în gestionarea unui număr mare de pacienți spitalizați. În plus față de utilizarea lor de rutină în anestezia chirurgicală, NMBA-urile pot fi valoroase în multe situații de îngrijire critică noi și în evoluție. Prin urmare, este esențial ca farmacistul spitalului să se familiarizeze cu implicațiile clinice și rezultatele asociate cu utilizarea și inversarea NMBA.
Farmacologie
BNM își exercită efectele farmacologice prin modularea transmiterii semnalului în mușchii scheletici. Potențialele de acțiune (modificări ale potențialului electric asociate cu trecerea unui impuls de-a lungul membranei unui mușchi sau a unei celule nervoase) care ajung la mușchiul scheletic activează eliberarea acetilcolinei în plăcile de capăt ale motorului. Acetilcolina se leagă de receptorii nicotinici la placa finală, rezultând eliberarea de Na +(sodiu) în fibrele musculare, ceea ce declanșează potențialul de acțiune musculară. Ionii de calciu sunt apoi eliberați în reticulul sarcoplasmic, provocând legarea miozinei de actină. Miozina va continua să se lege și să se deplaseze de-a lungul locurilor de actină, scurtând sarcomerul, atâta timp cât calciul este prezent în celulă. NMBAs funcționează în două moduri pentru a bloca acest proces.
NMBA depolarizante acționează ca agoniști la receptorii nicotinici.1 ei țin deschise canalele cu ioni, ducând la fascicularea musculară până când potențialul ionic este epuizat și apoi la paralizie.2 succinilcolina este singurul NMBA depolarizant disponibil. NMBA-urile nondepolarizante sunt antagoniști competitivi la receptorii nicotinici, blocând acetilcolina la placa finală a motorului.1 Acest lucru împiedică răspândirea potențialului de acțiune, făcând astfel celulele musculare insensibile la impulsurile nervoase motorii. Paralizia musculară apare secvențial, începând cu mușchii mici, cu mișcare rapidă în ochi și laringe și progresând până la membre, trunchi, căi respiratorii, mușchi intercostali și diafragmă. Recuperarea de la blocarea neuromusculară are loc în ordine inversă.2
ca urmare a efectelor lor mecanice asupra acetilcolinei, NMBA-urile prezintă multe efecte secundare. Acetilcolina joacă un rol în eliberarea histaminei, activarea muscarinică, acțiunea vagolitică și eliberarea norepinefrinei. Ca urmare, au fost observate efecte secundare cum ar fi tahicardia și bradicardia, hipertensiunea și hipotensiunea arterială și bronhodilatația și bronhospasmul cu utilizarea lor (tabelul 1).
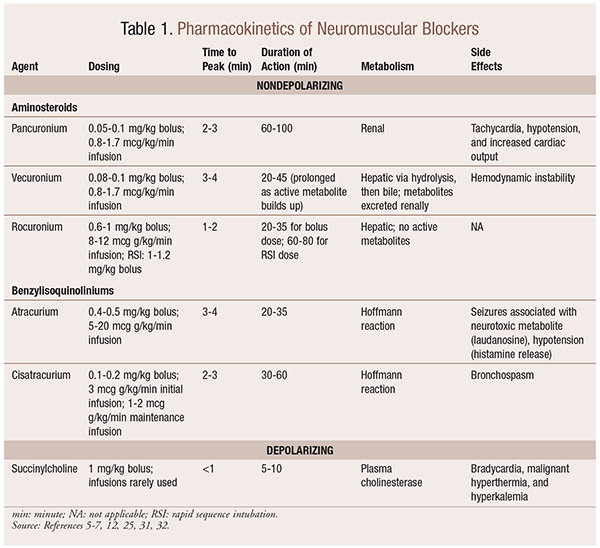
farmacocinetica
în funcție de situație, este util să existe o varietate de profiluri cinetice disponibile atunci când este selectat un NMBA. Debutul Rapid și durata scurtă sunt utile pentru indicații precum intubația rapidă a secvenței (RSI), în timp ce cele cu o durată mai lungă au o valoare mai mare în chirurgie. Vezi Tabelul 1 pentru o scurtă trecere în revistă a profilurilor cinetice, inclusiv dozarea și reacțiile adverse frecvente.
utilizare clinică
chirurgicale: NMBA-urile au fost un element esențial al anesteziologiei și chirurgiei de la introducerea succinilcolinei în 1952.3-7 alegerea agentului și dozarea variază foarte mult în funcție de procedura chirurgicală și, de asemenea, de utilizarea agenților alternativi, inclusiv anestezice generale, anestezice locale și medicamente de sedare IV. Principala preocupare în utilizarea chirurgicală a NMBAs este de a atinge niveluri adecvate de blocadă musculară fără a induce efecte secundare cardiovasculare sau a prelungi durata totală a blocadei dincolo de intervalul de timp al procedurii chirurgicale.4 deși o discuție completă a selecției și dozării agentului pentru indicațiile chirurgicale depășește domeniul de aplicare al acestui articol, se va aborda inversarea clinică a acestor efecte. Monitorizarea clinică a unui pacient care a primit un NMBA cu acțiune intermediară până la lungă în timpul unei proceduri chirurgicale ar trebui să includă testarea stimulării nervilor periferici (PNS) (discutată mai târziu).1,4
RSI: RSI este un proces emergent utilizat pentru a asigura căile respiratorii ale unui pacient instabil. Protocoalele RSI implică administrarea unui agent de inducție cu sedare profundă (de exemplu, propofol, etomidat, midazolam) cu administrarea aproape simultană a unui NMBA. Rezultatul dorit este ca pacientul să dezvolte atât sedare amnestică, cât și relaxare musculară profundă, îmbunătățind astfel probabilitatea unei intubații reușite.8,9 selectarea medicamentelor adecvate trebuie să se bazeze pe farmacocinetica specifică agentului și pe variabilele clinice specifice pacientului.
un agent ideal pentru RSI este unul cu atât un debut rapid, cât și un offset rapid, care scade timpul de la administrare la intubație și, de asemenea, reduce durata totală a paraliziei.10 o întârziere lungă în debutul medicamentului crește riscul general de hipoxie pentru pacient. Pe măsură ce timpul de debut se prelungește, trebuie să treacă mai mult timp între ultima respirație prin sac și primele respirații livrate prin tubul endotraheal. Durata crescută a paraliziei sporește riscul de intubare eșuată.10,11 în loc de recuperarea rapidă observată cu succinilcolină, agenții cu durată mai lungă, cum ar fi rocuroniul, pot necesita suport respirator mai mult de 90 de minute.12
o mare recenzie Cochrane publicată în 2015 a demonstrat că succinilcolina a fost superioară rocuroniului în ceea ce privește condițiile favorabile de intubare. Aceste constatări reflectă probabil profilul cinetic favorabil al succinilcolinei.13 Cu toate acestea, în practica clinică există câteva contraindicații importante pentru utilizarea succinilcolinei. La pacienții cu antecedente de hipertermie malignă sau la cei cu risc crescut de a dezvolta hiperkaliemie, rocuronium rămâne un agent RSI viabil.
îngrijire critică
sindromul de detresă respiratorie acută (ARDS): una dintre preocupările clinice primare pentru pacienții care dezvoltă ARDS este de a reduce presiunea și stresul asupra plămânilor, reducând astfel inflamația suplimentară dincolo de daunele sau insultele inițiale. Datorită efectelor lor asupra tonului diafragmatic, NMBA-urile au fost sugerate ca metodă de scădere a asincroniei ventilatorului și a presiunilor pulmonare. Trei studii primare au fost publicate în limba engleză care au evaluat utilizarea NMBA în faza timpurie a ARDS.14-16 fiecare studiu a demonstrat o oxigenare crescută la pacienții tratați precoce cu o perfuzie continuă de cisatracurium de 48 de ore. O meta-analiză din 2013 a datelor reunite din aceste studii a arătat că administrarea timpurie a cisatracuriului a dus la reducerea barotraumei (P = .02) și scăderea mortalității spitalicești (P = .005), dar nu a avut niciun efect asupra duratei ventilației mecanice (P = .57).17
pe baza acestor constatări, este rezonabil să se ia în considerare NMBAs pentru tratamentul ARDS acut la pacienții care se prezintă la UTI.4 în timp ce mecanismul de acțiune pentru toate NMBA-urile nondepolarizante ar trebui să contribuie la mecanismul propus de beneficiu clinic în ARDS, studiile randomizate, controlate publicate au utilizat cisatracurium numai în grupul intervențional. Dacă alți agenți ar avea un efect asupra acestor rezultate nu a fost abordată în literatura de specialitate.
hipotermie terapeutică: NMBAs au fost propuse ca parte a multor algoritmi de tratament pentru pacienții supuși hipotermiei terapeutice după stop cardiac.18 prin controlul tremurului, NMBA-urile pot reduce consumul total de oxigen. Deși acest lucru nu a fost studiat în îngrijirea critică, aceste modificări fiziologice au fost demonstrate la pacienții chirurgicali supuși hipotermiei în timpul bypass cardiopulmonar.19,20 într-un studiu retrospectiv la 111 pacienți care au suferit hipotermie terapeutică (18 cu NMBA vs .93 fără), a existat o îmbunătățire a supraviețuirii spitalicești (P=.004) care au rămas semnificative după analiza multivariată a potențialilor factori de confuzie de bază (IÎ 95%, 1,56-33,38).21 o tendință de îmbunătățire a clearance-ului lactatului și a rezultatelor funcționale a fost, de asemenea, observată la pacienții care au primit NMBA continuu.
un alt studiu retrospectiv a abordat selecția NMBAs la pacienții supuși hipotermiei terapeutice după stop cardiac.22 folosind o analiză multivariată, cercetătorii au comparat 201 de pacienți care au primit hipotermie terapeutică (29,9% cu cisatracurium vs.17,9% cu vecuronium). Cisatracuriul a fost singurul predictor pozitiv independent al supraviețuirii cu un rezultat neurologic bun (P = .014). Datorită naturii retrospective și dimensiunii mici a eșantionului acestui studiu, este dificil de evaluat puterea globală de a detecta orice diferență oferită de vecuronium similară cu cea observată cu cisatracurium. Este posibil ca variabilele de confuzie să aibă o influență mai puternică decât agentul neuroblockade selectat asupra rezultatelor globale.22
presiune intracraniană crescută (ICP): ICP este gestionat în mod obișnuit prin sedare profundă și analgezie, reducând consumul de oxigen și metabolismul cerebral în timp ce controlează durerea, mișcarea și asincronia ventilatorului.2 adăugarea de NMBAs este luată în considerare numai atunci când sedarea profundă este insuficientă pentru controlul creșterilor periculoase ale ICP, adesea rezultatul tusei, aspirării sau tremurului.2,12 s-a demonstrat că utilizarea timpurie a NMBA duce la scăderea mortalității, dar cu prețul creșterii morbidității. Hsiang și colegii săi au revizuit retrospectiv datele pe o cohortă de 514 pacienți din Banca de date a comei traumatice pentru a evalua utilizarea utilizării NMBA extinse precoce față de utilizarea NMBA de scurtă durată. Șederea la UTI a fost în medie cu 3 zile mai lungă, mai mulți pacienți au dezvoltat pneumonie și a existat o tendință de creștere a riscului de sepsis la pacienții cu NMBA extins. În plus, deși au existat mai multe decese în grupul non-NMBA, grupul NMBA a avut o incidență mai mare a supraviețuitorilor vegetativi sau cu dizabilități severe.23 utilizarea NMBAs în ICP crescut duce la dificultăți semnificative în monitorizarea funcției neurologice și a activității convulsive.24
agenți de inversare
deși mai puțin frecvente în UTI, inversarea NMBAs este o parte importantă a managementului chirurgical al pacienților care primesc paralitici. Din punct de vedere istoric, acest lucru s-a produs prin utilizarea neostigminei postoperator.4 neostigmina este un inhibitor al acetilcolinesterazei (ACheI) care reduce descompunerea acetilcolinei în placa de capăt a motorului, determinând o creștere a concentrației de acetilcolină. Deoarece NMBA-urile nondepolarizante sunt antagoniști competitivi ai receptorului nicotinic, neostigmina crește presiunea concurențială a acetilcolinei la locul acțiunii medicamentului. Deși neostigmina este eficientă în îmbunătățirea timpilor de recuperare după administrarea NMBA, poate fi nesigură din cauza mecanismului său indirect de acțiune.4,25 dacă concentrațiile NMBA sunt suficient de mari, antagonismul nu poate fi depășit indiferent de doza de anticolinesterază administrată. Eșecul de a inversa complet NMBAs postoperator s-a dovedit a crește ratele de slăbiciune reziduală și disfagie și riscul de aspirație.4,25 în plus, neostigmina are propriile efecte secundare prin acțiunea sa atât asupra receptorilor nicotinici, cât și asupra receptorilor muscarinici. În timp ce receptorul nicotinic este blocat prin intermediul NMBA, efectul neostigminei asupra receptorului muscarinic are ca rezultat creșterea bronhospasmelor, motilității gastrice, secrețiilor și bradicardiei.25 pentru a reduce aceste riscuri, un agonist antimuscarinic, cum ar fi atropina sau glicopirolatul, trebuie utilizat împreună cu neostigmina pentru a compensa creșterea activării muscarinice.în decembrie 2015, FDA a aprobat sugammadex (Bridion), un nou agent de inversare directă pentru rocuronium și vecuronium. Clasificat ca gamma-ciclodextrină, sugammadex creează un complex medicament-medicament cu NMBA liber, reducând astfel concentrațiile de agent disponibile. Aceste efecte farmacocinetice asupra concentrației NMBA sunt atât rapide, cât și complete. Cu toate acestea, din cauza dimensiunii lor, cisatracurium, atracurium și succinilcolina nu sunt afectate de sugammadex.26 beneficiul principal al sugammadex, comparativ cu neostigmina, este viteza cu care are loc inversarea (2 minute față de 17 minute).27 spre deosebire de ACheIs, sugammadex nu are efect de plafon; adică, cu o doză suficient de mare de sugammadex, orice adâncime de paralizie poate fi inversată rapid.26,28 în cele din urmă, utilizarea sugammadex nu are efect farmacodinamic asupra receptorilor muscarinici, diminuând semnificativ profilul efectului secundar al medicamentului și evitând necesitatea administrării concomitente a agenților antimuscarinici. Dozarea sugammadex se bazează pe nivelul blocadei neuromusculare, variind de la 2 mg/kg pentru blocada moderată până la 16 mg/kg pentru inversarea imediată.26,28
sedare
este extrem de important să recunoaștem că, deși NMBA împiedică mișcarea musculară, acestea nu au niciun efect asupra nivelului de conștiință sau a capacității pacientului de a percepe durerea sau disconfortul, rezultând un fenomen descris ca conștientizare neintenționată.1 fie pentru indicații chirurgicale, fie pentru indicații medicale, pacienții pot fi expuși riscului de sedare sau analgezie insuficientă. O serie de cazuri a demonstrat că până la 18% dintre pacienți mențin un anumit grad de conștientizare în timp ce sunt paralizați.29 acești pacienți raportează senzații care variază de la o stare de vis la o conștientizare explicită. Nu există studii care să ofere îndrumări specifice privind gestionarea conștientizării neintenționate în timpul blocadei neuromusculare. Indiferent, se consideră o practică standard stabilirea și menținerea unor niveluri adecvate de analgezie și sedare profundă înainte și în timpul blocării neuromusculare.1
monitorizare
monitorizarea pacienților cu NMBAs este imperativă, dar metodele sunt adesea complicate de evoluția clinică, administrarea concomitentă de sedative și analgezice și modalități terapeutice suplimentare (de exemplu, hipotermie terapeutică). PNS este de obicei considerată ca metoda de monitorizare de alegere, dar are limitări. Parametrii suplimentari de monitorizare includ respirația spontană și tendințele semnelor vitale.2
PNS este recomandat independent pacienților aflați în perfuzie continuă cu NMBA și ca adjuvant în alte situații clinice.1 un dispozitiv de tren de patru atașat la orbicularis oculi, nervul ulnar sau nervul peroneal oferă patru stimuli electrici succesivi. În absența blocadei neuromusculare, se va observa un răspuns egal de mișcare pentru toți cei patru stimuli, rezultând un raport T4/T1 de 1. La un pacient paralizat, răspunsul twitch trebuie observat cu primul stimul, dar acest lucru ar trebui să se diminueze din cauza blocării neuronilor motori. Scopul este de a atinge un raport T4/T1 de aproximativ 0,25.1
complicații
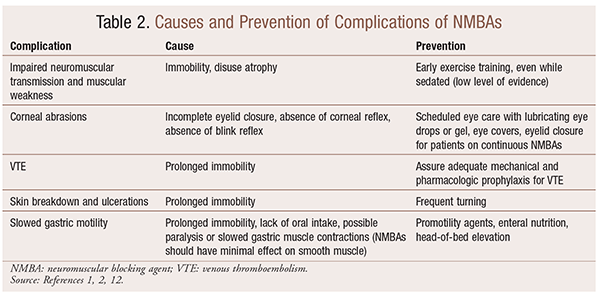
deși există beneficii semnificative pentru utilizarea NMBA în situații particulare, există și complicații pe termen scurt și lung. În contextul acut, utilizarea NMBAs poate duce la o ședere crescută a UCI, ventilație mecanică prelungită, tromboembolism venos, ruperea pielii și ulcerații, infecție, leziuni corneene și anafilaxie. Administrarea pe termen lung poate duce la imobilitate sau la creșterea timpului de recuperare din cauza transmiterii neuromusculare afectate și a slăbiciunii musculare.30 mai multe recomandări pentru prevenirea acestor efecte sunt prezentate în tabelul 2.
concluzie
farmacistul poate juca un rol extrem de important în reglementarea și utilizarea NMBA într-o gamă largă de locuri de practică clinică. Prin înțelegerea mecanismului de acțiune, a indicațiilor terapeutice, a literaturii de susținere și a efectelor secundare clinice ale acestei clase de medicamente cu alertă ridicată, farmacistul poate avea un efect neprețuit asupra îngrijirii pacientului și a siguranței pacientului.
1. Murray MJ, DeBlock H, Erstad B și colab. Ghiduri de practică clinică pentru blocarea neuromusculară susținută la pacientul adult în stare critică. Crit Care Med. 2016;44:2079-2103.
2. Warr J, Thiboutot Z, Rose L și colab. Utilizări terapeutice actuale, farmacologie și considerații clinice ale agenților de blocare neuromusculară pentru adulții bolnavi critic. Ann Pharmacother. 2011;45:1116-1126.
3. Foldes FF, McNall PG, Borrego-Hinojosa JM. Succinilcolina: o nouă abordare a relaxării musculare în anesteziologie. N Engl J Med. 1952;247:596-600.
4. Naguib M, Lien CA. Farmacologia relaxantelor musculare și a antagoniștilor acestora. În: Anestezia lui Miller. Ediția a 7-a. Miller RD, Eriksson LI, Fleisher LA și colab., eds. Philadelphia, PA: Churchill Livingstone; 2010.
5. Anectină (succinilcolină) prospect. Princeton, NJ: Sandoz Inc; septembrie 2010.
6. Rocuronium prospect. Irvine, CA: Teva parenteral Medicines, Inc; noiembrie 2008.
7. Nimbex (cisatracurium) prospect. North Chicago, IL: Abbott Laboratories; 2010.
8. Sakles JC, Laurin EG, Rantapaa AA, Panacek EA. Managementul căilor respiratorii în departamentul de urgență; un studiu de un an de 610 intubații traheale. Ann Emerg Med. 1998;31:325-332.
9. Tayal VS, Riggs RW, Marx JA și colab. Intubarea rapidă a secvenței la o rezidență de medicină de urgență: rata de succes și evenimentele adverse pe o perioadă de doi ani. Acad Emerg Med. 1999;6:31-37.
10. Li J, Murphy-Lavoie H, Bugas C, și colab. Complicații ale intubației de urgență cu și fără paralizie. Sunt J Emerg Med. 1999;17:141-143.
11. Naguib M, Samarkandi AH, El-Din ME și colab. Doza de succinilcolină necesară pentru condiții excelente de intubare endotraheală. Anesth Analg. 2006;102:151-155.
12. Greenberg SB, Vender J. utilizarea agenților de blocare neuromusculară în UTI: unde suntem acum? Crit Care Med. 2013;41:1332-1344.
13. Tran DT, Newton EK, Muntele VA și colab. Rocuronium versus succinilcolină pentru intubarea rapidă a inducției secvenței. Cochrane baza de date Syst Rev. 2015; (10):CD002788.
14. Gainnier M, Roch A, Forel JM și colab. Efectul agenților de blocare neuromusculară asupra schimbului de gaze la pacienții care prezintă sindrom de detresă respiratorie acută. Crit Care Med. 2004;32:113-119.
15. Forel JM, Roch a, Marin V și colab. Blocanții neuromusculare scad răspunsul inflamator la pacienții care prezintă sindrom de detresă respiratorie acută. Crit Care Med. 2006;34:2749-2757.
16. Papazian L, Forel JM, Gacouin A și colab. Blocante neuromusculare în sindromul de detresă respiratorie acută precoce. N Engl J Med. 2010;363:1107-1116.
17. Alhazzani W, Alshahrani M, Jaeschke R, și colab. Agenți de blocare neuromusculară în sindromul de detresă respiratorie acută: o revizuire sistemică și meta-analiză a studiilor controlate randomizate. Crit Care. 2013; 17: R43.
18. Chamorro C, Borrallo JM, Romera MA și colab. Protocolul de anestezie și analgezie în timpul hipotermiei terapeutice după stop cardiac: o revizuire sistematică. Anesth Analg. 2010;110:1328-1335.
19. Cruise C, MacKinnon J, Tough J, Houston P. Compararea meperidinei și pancuroniului pentru tratamentul tremurului după intervenția chirurgicală cardiacă. Poate J Anaesth. 1992;39:563-568.
20. Sladen RN, Berend JZ, Fassero JS și colab. Comparația dintre vecuronium și meperidină cu privire la efectele clinice și metabolice ale tremurului după bypass cardiopulmonar hipotermic. J Cardiothorac Vasc Anesth. 1995;9:147-153.
21. Salciccioli JD, Cocchi MN, Rittenberger JC și colab. Blocarea neuromusculară continuă este asociată cu scăderea mortalității la pacienții cu stop cardiac. Resuscitare. 2013;84:1728-1733.
22. Baker WL, Geronila G, Kallur R și colab. Efectul blocantelor neuromusculare asupra rezultatelor la pacienții care primesc hipotermie terapeutică după stop cardiac. Anal Resusc Curr Res. 2013;S1.
23. Hsiang JK, Chesnut RM, Crisp CB și colab. Paralizie timpurie, de rutină pentru controlul presiunii intracraniene în vătămarea severă a capului: este necesar? Crit Care Med. 1994;22:1471-1476.
24. Rangel-Castilla L, Gopinath S, Robertson CS. Managementul hipertensiunii intracraniene. Neurol Clin. 2008;26:521-541.
25. Caldwell JE. Limitări clinice ale antagoniștilor acetilcolinesterazei. J Crit Îngrijire. 2009;24:21-28.
26. Bridion (sugammadex) package insert. Whitehouse Station, NJ: Merck & Co, Inc; July 2015.
27. Sacan O, White PF, Tufanogullari B, Klein K. Sugammadex reversal of rocuronium-induced neuromuscular blockade: a comparison with neostigmine-glycopyrrolate and edrophonium-atropine. Anesth Analg. 2007;10:569-574.
28. Meistelman C, Donati F. Do we really need sugammadex as an antagonist of muscle relaxants in anesthesia? Curr Opin Anaesthesiol. 2016;29:462-467.
29. Arnot-Smith J, Smith AF. Patient safety incidents involving neuromuscular blockade: analiza datelor sistemului național de raportare și învățare din Marea Britanie din 2006 până în 2008. Anestezie. 2010;65:1106-1113.
30. Price DR, Mikkelsen mine, Umscheid CA, Armstrong EJ. Agenți de blocare neuromusculară și disfuncție neuromusculară dobândită în boala critică: o revizuire sistematică și meta-analiză. Crit Care Med. 2016;44:2070-2078.
31. Prielipp RC, COURSIN DB, Scuderi PE și colab. Compararea cerințelor de perfuzie și a profilurilor de recuperare ale vecuronium și cisatracurium 51W89 la pacienții din unitatea de terapie intensivă. Anesth Analg. 1995;81:3-12.
32. Sparr HJ, Wierda JM, Proost JH și colab. Farmacodinamica și farmacocinetica rocuroniului la pacienții cu terapie intensivă. Br J Anaesth. 1997;78:267-273.