US Pharm. 2017;42 (1):HS16-HS20.
absztrakt: a neuromuszkuláris blokkoló szerek (NMBAs) fontos szerepet játszanak számos kórházi beteg kezelésében. Az NMBAs farmakológiája jól ismert, de ezeknek az ágenseknek a használata ellentmondásos lehet. NMBAs gyakori sebészeti helyzetekben, gyors szekvencia intubálás, de más jelzések, mint például az akut légzési distressz szindróma, terápiás hipotermia, emelkedett koponyaűri nyomás, kissé megosztó. Elengedhetetlen, hogy a gyógyszerészek tisztában legyenek az NMBAs alkalmazásával kapcsolatos klinikai következményekkel és eredményekkel. Ezenkívül fontos megérteni az olyan egyidejű megfontolásokat, mint a szedáció, a monitorozás és a visszafordítás. A kórházi környezetben lévő gyógyszerészeknek ismerniük kell a nemrégiben jóváhagyott, újszerű, közvetlen hatású sugammadex (Bridion) hatóanyagot.
a neuromuszkuláris blokkoló szerek (NMBAs) fontos szerepet játszanak számos kórházi beteg kezelésében. A sebészeti érzéstelenítésben történő rutinszerű alkalmazásuk mellett az NMBAs számos új, fejlődő kritikus ápolási helyzetben értékes lehet. Ezért elengedhetetlen, hogy a kórházi gyógyszerész megismerje az NMBA alkalmazásával és a visszafordítással kapcsolatos klinikai következményeket és eredményeket.
farmakológia
az NMBAs a vázizomzat jelátvitelének modulálásával fejtik ki farmakológiai hatásukat. Akciópotenciálok (az izom-vagy idegsejt membránja mentén fellépő impulzus áthaladásával járó elektromos potenciál változásai) a vázizom elérése aktiválja az acetilkolin felszabadulását a motor véglapjaiba. Az acetilkolin kötődik a nikotin receptorokhoz a véglapon, ami Na+ (nátrium) felszabadulását eredményezi az izomrostokba, ami kiváltja az izomműködési potenciált. A kalciumionokat ezután felszabadítják a szarkoplazmatikus retikulumba, ami a myozin aktinhoz való kötődését idézi elő. A Myosin továbbra is kötődik és mozog az aktin helyek mentén, lerövidítve a sarcomere-t, mindaddig, amíg a kalcium jelen van a sejtben. Az NMBAs kétféle módon működik, hogy blokkolja ezt a folyamatot.
a depolarizáló NMBAs agonistaként hat a nikotin receptorokon.1 nyitva tartják az ionkapu csatornákat, ami izomzathoz vezet, amíg az ionpotenciál kimerül, majd bénuláshoz vezet.2 a szukcinil-kolin az egyetlen depolarizáló NMBA. A nondepolarizáló NMBAs versenyképes antagonisták a nikotin receptorokon, blokkolva az acetilkolint a motor véglapján.1 Ez megakadályozza az akciós potenciál terjedését, ezáltal az izomsejtek érzéketlenek a motoros idegimpulzusokra. Izom bénulás következik be egymás után, kezdve a kis, gyors-twitch izmok, a szeme, a gége, s halad a végtagok, törzs, légúti, bordaközi izmok, valamint a rekeszizom. A neuromuszkuláris elzáródás helyreállítása fordított sorrendben történik.2
az acetilkolinra gyakorolt mechanisztikus hatásuk következtében az NMBAs számos mellékhatást mutat. Az acetilkolin szerepet játszik a hisztamin felszabadulásában, a muszkarin aktiválásában, a vagolitikus hatásban és a norepinefrin felszabadulásában. Ennek eredményeképpen olyan mellékhatásokat figyeltek meg, mint a tachycardia és bradycardia, a magas vérnyomás és a hypotonia, valamint a bronchodilatáció és a bronchospasmus (1.táblázat).
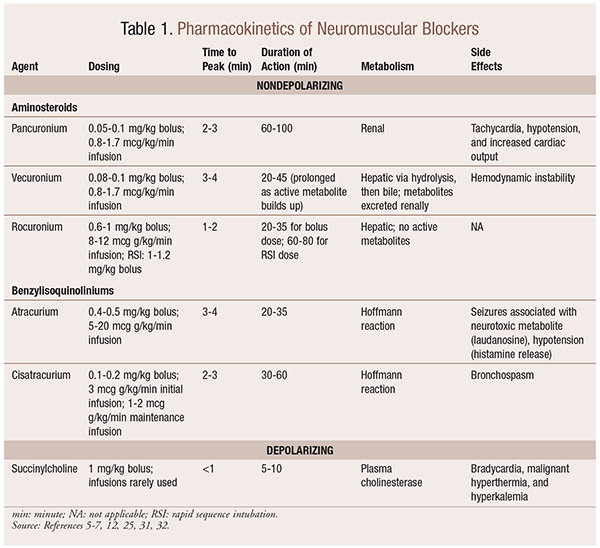
farmakokinetika
a helyzettől függően hasznos, ha egy nmba kiválasztásakor különféle kinetikai profilok állnak rendelkezésre. A gyors megjelenés és a rövid időtartam olyan indikációkban hasznos, mint a gyors szekvencia intubáció (RSI), míg a hosszabb időtartamú betegek nagyobb értéket képviselnek a műtét során. Lásd az 1. táblázatot a kinetikus profilok rövid áttekintéséhez, beleértve az adagolást és a gyakori mellékhatásokat.
Klinikai Használat
Sebészeti: NMBAs már egy vágott aneszteziológus, sebészet bevezetése óta szukcinilkolin a 1952.3-7 A választás ügynök adagolás változó, attól függően, hogy a sebészeti eljárás, valamint az alternatív szerek, beleértve az általános érzéstelenítők, helyi érzéstelenítők, illetve IV nyugtató gyógyszereket. Az NMBAs sebészeti alkalmazásának elsődleges szempontja az izomblokád megfelelő szintjének elérése a kardiovaszkuláris mellékhatások kiváltása nélkül, vagy a blokád teljes időtartamának meghosszabbítása a sebészeti beavatkozás időkeretén túl.4 bár a műtéti indikációk esetén az ágensek kiválasztásának és adagolásának teljes körű megvitatása nem tartozik e cikk hatálya alá, ezeknek a hatásoknak a klinikai visszafordítása foglalkozni fog. A sebészeti beavatkozás során közbenső – hosszú hatású NMBA-t kapott beteg klinikai monitorozásának magában kell foglalnia a perifériás idegstimulációt (PNS) (később tárgyalt).1,4
RSI: Az RSI egy kialakuló folyamat, amelyet egy instabil beteg légútjának biztosítására használnak. Az RSI protokollok magukban foglalják egy mély szedációs indukciós szer (pl. propofol, etomidát, midazolám) alkalmazását egy NMBA közeli egyidejű alkalmazásával. A kívánt eredmény az, hogy a beteg mind amnesztikus szedációt, mind mély izomlazulást fejlesszen ki, ezáltal javítva a sikeres intubáció valószínűségét.8,9 a megfelelő szerek kiválasztásának az ágensspecifikus farmakokinetikán és a betegspecifikus klinikai változókon kell alapulnia.
Az RSI ideális hatóanyaga mind a gyors kezdet, mind a gyors eltolás, ami csökkenti a beadástól az intubálásig eltelt időt, valamint csökkenti a bénulás teljes időtartamát.10 a gyógyszer megjelenésének hosszú késleltetése növeli a hypoxia általános kockázatát a beteg számára. Ahogy a kezdeti idő meghosszabbodik, több időnek kell eltelnie az utolsó lélegzet között a táskán keresztül az első lélegzet között, amelyet az endotracheális csövön keresztül szállítanak. A bénulás fokozott időtartama növeli a sikertelen intubáció kockázatát.10,11 a szukcinil-kolinnal megfigyelt gyors gyógyulás helyett a hosszabb időtartamú szerek, például a rokurónium több mint 90 percig légzési támogatást igényelhetnek.12
egy 2015-ben közzétett nagy Cochrane-áttekintés kimutatta, hogy a szukcinil-kolin a kedvező intubációs Feltételek tekintetében felülmúlta a rokuroniumot. Ezek az eredmények valószínűleg tükrözik a szukcinil-kolin kedvező kinetikus profilját.13 a klinikai gyakorlatban azonban számos fontos ellenjavallat létezik a szukcinil-kolin használatára. Azoknál a betegeknél, akiknek kórtörténetében rosszindulatú hipertermia vagy a hiperkalémia kialakulásának magas kockázata áll fenn, a rokurónium életképes RSI-szer marad.
Critical Care
akut Respiratory Distress Syndrome (ARDS): az ARDS-ben szenvedő betegek egyik elsődleges klinikai problémája a tüdőre nehezedő nyomás és stressz csökkentése, ezáltal csökkentve a további gyulladást a kezdeti károsodáson vagy sértésen túl. A diafragmatikus tónusra gyakorolt hatásuk miatt az NMBAs-t javasolták a lélegeztető és a pulmonalis nyomás csökkentésének módszereként. Három elsődleges tanulmányt tettek közzé angolul, amelyek értékelték az NMBAs használatát az ARDS korai szakaszában.14-16 minden vizsgálatban fokozott oxigenizációt mutattak ki a 48 órás folyamatos ciszatracurium infúzióval Korán kezelt betegeknél. Az ezekből a vizsgálatokból származó összesített adatok 2013-as meta-analízise azt mutatta, hogy a cisatracurium korai alkalmazása csökkent barotraumát eredményezett (P = .02) és csökkent kórházi halálozás (P = .005), de nem volt hatással a mechanikus szellőzés időtartamára (P = .57).17
ezen eredmények alapján indokolt mérlegelni az NMBAS-t az akut ARDS kezelésére az ICU-ban szenvedő betegeknél.4 míg az összes nem depolarizáló NMBAs hatásmechanizmusának hozzá kell járulnia az ARDS-ben javasolt klinikai előny mechanizmusához, randomizált, kontrollos vizsgálatokban csak az intervenciós csoportban alkalmazták a ciszatracuriumot. A szakirodalom nem foglalkozik azzal, hogy más szerek hatással lennének-e ezekre az eredményekre.
terápiás hipotermia: Az NMBAs-t számos kezelési algoritmus részeként javasolták a szívmegállás utáni terápiás hipotermiában szenvedő betegek számára.18 a remegés szabályozásával az NMBAs csökkentheti a teljes oxigénfogyasztást. Bár ezt nem vizsgálták a critical care-ban, ezeket a fiziológiai változásokat kimutatták a cardiopulmonalis bypass során hipotermiában szenvedő sebészeti betegeknél.19,20 egy retrospektív vizsgálatban 111 betegnél, akik terápiás hipotermián estek át (18 NMBA vs. 93 nélkül), javult a kórházi túlélés (P = .004), amely a potenciális kiindulási zavaró tényezők többváltozós elemzése után is jelentős maradt (95% CI, 1, 56-33, 38).21 folyamatos NMBA-kezelésben részesülő betegeknél a laktát clearance és a funkcionális eredmények javulásának tendenciáját is megfigyelték.
egy másik retrospektív vizsgálat az NMBAs kiválasztását vizsgálta a szívmegállás utáni terápiás hipotermiában szenvedő betegeknél.22 Használata egy többváltozós elemzés, a kutatók összehasonlították 201 kapó betegek terápiás hypothermia (29,9% volt a cisatracurium vs 17.9% – os vekuronium). A Cisatracurium volt a túlélés egyetlen független pozitív előrejelzője, jó neurológiai eredménnyel (P = .014). A vizsgálat retrospektív jellege és kis mintamérete miatt nehéz felmérni a vecuronium által a ciszatracuriummal megfigyelthez hasonló különbség kimutatásának teljes erejét. Lehetséges, hogy a zavaró változók erősebb hatással lehetnek, mint a kiválasztott neuroblockade ágens az Általános eredményekre.22
emelkedett koponyaűri nyomás (ICP): Az ICP-t rutinszerűen mély szedációval és fájdalomcsillapítással kezelik, csökkentve az oxigénfogyasztást és az agyi anyagcserét, miközben a fájdalmat, a mozgást és a lélegeztetőgépet is kontrollálják.2 az NMBAs hozzáadását csak akkor kell figyelembe venni, ha a mély szedáció nem elegendő az ICP veszélyes növekedésének szabályozására, gyakran köhögés, Szopás vagy remegés következtében.2,12 a korai NMBA-használatról kimutatták, hogy a mortalitás csökkenéséhez vezet, de a megnövekedett morbiditás költségén. A Hsiang és munkatársai visszamenőleg megvizsgálták a traumás Coma adatbankból származó 514 beteg kohorszára vonatkozó adatokat, hogy értékeljék a korai kiterjesztett NMBA-használat alkalmazását a rövid időtartamú NMBA-használathoz képest. Az ICU-tartózkodás átlagosan 3 nappal hosszabb volt, több betegnél alakult ki tüdőgyulladás, és a szepszis fokozott kockázata felé fordult a kiterjesztett NMBA-ban szenvedő betegeknél. Továbbá, bár a nem NMBA csoportban több haláleset történt, az NMBA csoportban nagyobb volt a vegetatív vagy súlyosan fogyatékos túlélők előfordulása.23 az NMBAS fokozott ICP-ben történő alkalmazása jelentős nehézségeket okoz a neurológiai funkció és a görcsroham aktivitásának monitorozásában.24
visszafordító szerek
bár az ICU-ban nem gyakori, az NMBAS megfordulása fontos része a bénulást kapó betegek műtéti kezelésének. Történelmileg ez a neostigmin posztoperatív alkalmazásával történt.4 A neosztigmin egy acetilkolinészteráz inhibitor (ACheI), amely csökkenti az acetilkolin lebontását a motor véglapjában, ami növeli az acetilkolin koncentrációját. Mivel a nondepolarizáló NMBAs a nikotin receptor versenyképes antagonistái, a neostigmin növeli az acetilkolin versenyképes nyomását a gyógyszerhatás helyén. Bár a neostigmin hatékonyan javítja a helyreállítási időket az NMBA beadása után, közvetett hatásmechanizmusa miatt megbízhatatlan lehet.4,25 ha az NMBA-koncentráció elég magas, az antagonizmust az alkalmazott antikolinészteráz-dózistól függetlenül nem lehet leküzdeni. Az NMBAs műtét utáni teljes visszafordításának elmulasztásáról kimutatták, hogy növeli a maradék gyengeség és dysphagia arányát, valamint az aspiráció kockázatát.4,25 ezenkívül a neosztigminnek saját mellékhatásai vannak mind a nikotin, mind a muszkarin receptorokra gyakorolt hatása révén. Míg a nikotin receptor az NMBA-n keresztül blokkolódik, a neosztigmin muszkarin receptorra gyakorolt hatása fokozott bronchospasmust, gyomor motilitást, váladékot és bradycardiát eredményez.25 e kockázatok csökkentése érdekében neosztigminnal együtt antimuszkarin agonistát, például atropint vagy glikopirrolátot kell alkalmazni a megnövekedett muszkarinaktiváció ellensúlyozására.
2015 decemberében az FDA jóváhagyta a sugammadex-et (Bridion), amely a rokuronium és a vekuronium új, közvetlen visszafordító szere. A gamma-ciklodextrinként besorolt sugammadex szabad NMBA-val rendelkező gyógyszer-gyógyszer komplexet hoz létre, ezáltal csökkentve a rendelkezésre álló hatóanyag-koncentrációkat. Ezek a farmakokinetikai hatások az NMBA koncentrációra mind gyorsak, mind teljesek. Méretük miatt azonban a ciszatracuriumot, az atrakuriumot és a szukcinil-kolint nem érinti a sugammadex.26 a sugammadex elsődleges előnye a neosztigminhez képest a fordulatszám (2 perc vs.17 perc).27 Az ACheIs-szel ellentétben a sugammadexnek nincs mennyezeti hatása; azaz elég nagy sugammadex adaggal a bénulás bármely mélysége gyorsan megfordítható.26,28 végül, a sugammadex alkalmazása nem gyakorol Farmakodinámiás hatást a muszkarin receptorokra, jelentősen csökkenti a gyógyszer mellékhatásprofilját, és elkerüli az antimuszkarin hatóanyagok együttes alkalmazásának szükségességét. A sugammadex adagolása a neuromuszkuláris blokád szintjén alapul, amely a mérsékelt blokád esetén 2 mg/kg-tól 16 mg/kg-ig terjed az azonnali visszafordítás érdekében.26,28
szedáció
rendkívül fontos felismerni, hogy bár az NMBAs megakadályozza az izommozgást, nincs hatással a beteg tudatszintjére vagy a fájdalom vagy kellemetlen érzés érzékelésére, ami véletlen tudatosságként leírt jelenséget eredményez.1 sebészeti vagy orvosi indikációk esetén a betegek veszélyeztethetik az elégtelen szedációt vagy fájdalomcsillapítást. Egy esetsorozat kimutatta, hogy a betegek legfeljebb 18% – a tart fenn bizonyos fokú tudatosságot, miközben megbénult.29 ezek a betegek az álomszerű állapottól az explicit tudatosságig terjedő érzéseket jelentik. Nincs olyan vizsgálat, amely konkrét útmutatást adna a nem szándékos tudatosság kezelésére a neuromuszkuláris blokád során. Ettől függetlenül bevett gyakorlatnak számít a fájdalomcsillapítás és a mély szedáció megfelelő szintjének megállapítása és fenntartása a neuromuszkuláris blokád előtt és alatt.1
Monitoring
a betegek nmbas-val történő monitorozása elengedhetetlen, de a módszereket gyakran bonyolítja a klinikai tanfolyam, a nyugtatók és fájdalomcsillapítók együttes alkalmazása, valamint további terápiás módszerek (pl. terápiás hipotermia). A PNS-t általában a választott felügyeleti módszernek tekintik, de korlátai vannak. További megfigyelési paraméterek a spontán légzés és a vitális tünetek alakulása.2
a PNS-t az NMBAs folyamatos infúziójában szenvedő betegek számára önállóan, más klinikai helyzetekben kiegészítésként kell alkalmazni.1 az orbicularis oculi, az ulnáris ideg vagy a peroneális ideg négy egymást követő elektromos ingert biztosít. Neuromuszkuláris blokád hiányában mind a négy ingerre egyenlő twitch válasz figyelhető meg, ami 1 T4/T1 arányt eredményez. Egy megbénult betegben az első ingerrel meg kell figyelni a twitch választ,de ez a motoros neuronok blokádja miatt csökken. A cél az, hogy elérjék a T4/T1 arány körülbelül 0,25.1
szövődmények
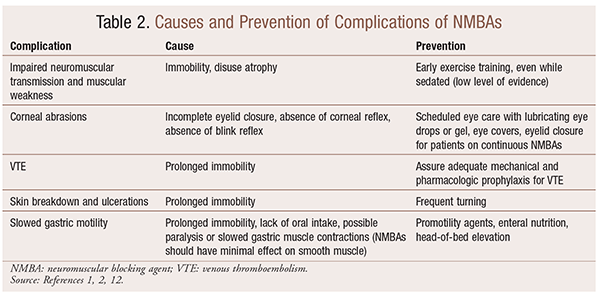
bár az NMBAs alkalmazása bizonyos helyzetekben jelentős előnyökkel jár, vannak rövid távú és hosszú távú szövődmények is. Az akut beállítása, használata NMBAs vezethet fokozott INTENZÍVEN maradni, hosszabb gépi lélegeztetés, vénás tromboembólia, bőr, könnyezés, fekélyek, fertőzés, szaruhártya-sérülés, valamint az anafilaxia. A hosszú távú alkalmazás immobilitáshoz vagy fokozott gyógyulási időhöz vezethet a neuromuszkuláris transzmisszió és az izomgyengeség károsodása miatt.30 a 2. táblázat számos ajánlást tartalmaz e hatások megelőzésére.
következtetés
a gyógyszerész rendkívül fontos szerepet játszhat az NMBAs szabályozásában és alkalmazásában a klinikai praxisok széles körében. A gyógyszerész a hatásmechanizmus, a terápiás javallatok, a szakirodalom, valamint a magas fokú figyelmeztető gyógyszerosztály klinikai mellékhatásainak megértésével felbecsülhetetlen hatással lehet a betegellátásra és a betegbiztonságra.
1. Murray MJ, DeBlock H, Erstad B, et al. Klinikai gyakorlat iránymutatások tartós neuromuszkuláris blokád a felnőtt kritikusan beteg beteg. Crit Care Med. 2016;44:2079-2103.
2. Warr J, Thiboutot Z, Rose L, et al. A kritikusan beteg felnőttek neuromuszkuláris blokkoló szereinek jelenlegi terápiás alkalmazása, farmakológiája és klinikai megfontolásai. Ann Pharmacother. 2011;45:1116-1126.
3. Foldes FF, McNall PG, Borrego-Hinojosa JM. Szukcinil-kolin: az izomlazítás új megközelítése az aneszteziológiában. N Engl J Med. 1952;247:596-600.
4. Naguib M, Lien ca. Az izomrelaxánsok és azok antagonistáinak farmakológiája. A: Miller altatását. 7. Szerk. Miller RD, Eriksson LI, Fleisher LA, et al, eds. Philadelphia, PA: Churchill Livingstone; 2010.
5. Anektin (szukcinil-kolin)csomag betét. Princeton, NJ: Sandoz Inc; szeptember 2010.
6. Rokuronium csomag betét. Irvine, CA: Teva parenteralis Medicines, Inc; 2008.November.
7. Nimbex (ciszatracurium) csomagolóanyag. Észak-Chicago, IL: Abbott Laboratories; 2010.
8. Sakles JC, Laurin EG, Rantapaa AA, Panacek EA. Légutak kezelése a sürgősségi osztályon; egy éves vizsgálat 610 légcső intubációval. Ann Emerg Med. 1998;31:325-332.
9. Tayal VS, Riggs RW, Marx JA, et al. Gyors szekvenciás intubáció sürgősségi orvosi rezidencián: sikerességi arány és nemkívánatos események két év alatt. Acad Emerg Med. 1999;6:31-37.
10. Li J, Murphy-Lavoie H, Bugas C, et al. A sürgősségi intubáció szövődményei bénulással vagy anélkül. J Emerg Med Vagyok. 1999;17:141-143.
11. Naguib M, Samarkandi AH, El-Din ME, et al. A szukcinil-kolin dózisa a kiváló endotracheális intubáló körülményekhez szükséges. Anesth Analg. 2006;102:151-155.
12. Greenberg SB, Venter J. a neuromuszkuláris blokkoló szerek alkalmazása az ICU – ban: hol vagyunk most? Crit Care Med. 2013;41:1332-1344.
13. Tran DT, Newton EK, Mount VA, et al. Rokuronium versus szukcinil-kolin gyors szekvencia indukciós intubáció. Cochrane Database Syst Rev. 2015;(10):CD002788.
14. Gainnier M, Roch A, Forel JM, et al. A neuromuszkuláris blokkoló szerek hatása a gázcserére akut légzési distressz szindrómában szenvedő betegeknél. Crit Care Med. 2004;32:113-119.
15. Forel JM, Roch A, Marin V, et al. Az akut légzési distressz szindrómában szenvedő betegeknél a neuromuszkuláris blokkoló szerek csökkentik a gyulladásos választ. Crit Care Med. 2006;34:2749-2757.
16. Papazian L, Forel JM, Gacouin A, et al. Neuromuszkuláris blokkolók korai akut légzési distressz szindrómában. N Engl J Med. 2010;363:1107-1116.
17. Alhazzani W, Alshahrani M, Jaeschke R, et al. Neuromuszkuláris blokkoló szerek akut légzési distressz szindrómában: a randomizált, kontrollos vizsgálatok szisztémás felülvizsgálata és meta-analízise. Crit Care. 2013;17: R43.
18. Chamorro C, Borrallo JM, Romera MA, et al. Anesztézia és fájdalomcsillapítás protokoll a szívmegállás utáni terápiás hipotermia során: szisztematikus felülvizsgálat. Anesth Analg. 2010;110:1328-1335.
19. Cruise C, MacKinnon J, Tough J, Houston P. meperidin és pancuronium összehasonlítása szívműtét utáni remegés kezelésére. Can J Anasth. 1992;39:563-568.
20. Sladen RN, Berend JZ, Fassero JS, et al. A vekuronium és a meperidin összehasonlítása a hypothermiás cardiopulmonalis bypass után fellépő hidegrázás klinikai és metabolikus hatásaival. J Cardiothorac Vasc Anesth. 1995;9:147-153.
21. Salciccioli JD, Cocchi MN, Rittenberger JC, et al. A folyamatos neuromuszkuláris blokád a szívmegállás utáni betegeknél csökkent mortalitással jár. Újraélesztés. 2013;84:1728-1733.
22. Baker WL, Geronila G, Kallur R, et al. A neuromuszkuláris blokkolók hatása a szívmegállás utáni terápiás hipotermiában szenvedő betegek kimenetelére. Analg Resusc Curr Res. 2013; S1.
23. Hsiang JK, Chesnut RM, Crisp CB, et al. Korai, rutin bénulás az intrakraniális nyomásszabályozáshoz súlyos fejsérülés esetén:szükséges? Crit Care Med. 1994;22:1471-1476.
24. Rangel-Castilla L, Gopinath S, Robertson CS. Intracranialis hipertónia kezelése. Neurol Klin. 2008;26:521-541.
25. Caldwell JE. Az acetilkolinészteráz antagonisták klinikai korlátai. J Crit Care. 2009;24:21-28.
26. Bridion (sugammadex) package insert. Whitehouse Station, NJ: Merck & Co, Inc; July 2015.
27. Sacan O, White PF, Tufanogullari B, Klein K. Sugammadex reversal of rocuronium-induced neuromuscular blockade: a comparison with neostigmine-glycopyrrolate and edrophonium-atropine. Anesth Analg. 2007;10:569-574.
28. Meistelman C, Donati F. Do we really need sugammadex as an antagonist of muscle relaxants in anesthesia? Curr Opin Anaesthesiol. 2016;29:462-467.
29. Arnot-Smith J, Smith AF. Patient safety incidents involving neuromuscular blockade: 2006 és 2008 között a Brit Nemzeti jelentéstételi és tanulási rendszer adatainak elemzése. Anesztézia. 2010;65:1106-1113.
30. Price DR, Mikkelsen ME, Umscheid CA, Armstrong EJ. Neuromuszkuláris blokkoló szerek és neuromuszkuláris diszfunkció szerzett kritikus betegség: szisztematikus felülvizsgálata és meta-analízis. Crit Care Med. 2016;44:2070-2078.
31. Prielipp RC, Coursin DB, Scuderi PE, et al. Intenzív osztályon kezelt betegeknél a vecuronium és a cisatracurium 51w89 infúziós követelményeinek és visszanyerési profiljának összehasonlítása. Anesth Analg. 1995;81:3-12.
32. Sparr HJ, Wierda JM, Proost JH, et al. A rokuronium farmakodinamikája és farmakokinetikája intenzív kezelésben részesülő betegeknél. Brjanth. 1997;78:267-273.