US Pharm. 2017; 42 (1): HS16-HS20.
RESUMEN: Los bloqueadores neuromusculares (BNM) desempeñan un papel importante en el manejo de un gran número de pacientes hospitalarios. La farmacología de los BNM es bien conocida, pero el uso de estos agentes puede ser controvertido. Los BNM son comunes en situaciones quirúrgicas e intubación de secuencia rápida, pero otras indicaciones, como el síndrome de dificultad respiratoria aguda, la hipotermia terapéutica y la presión intracraneal elevada, son algo divisivas. Es esencial que los farmacéuticos estén familiarizados con las implicaciones clínicas y los resultados asociados con el uso de los BNM. Además, es importante comprender las consideraciones concurrentes, como la sedación, el monitoreo y la reversión. Los farmacéuticos en el entorno hospitalario deben estar familiarizados con el nuevo y recientemente aprobado agente de reversión directa sugammadex (Bridion).
Los bloqueadores neuromusculares (BNM) desempeñan un papel importante en el manejo de un gran número de pacientes hospitalarios. Además de su uso rutinario en anestesia quirúrgica, los BNM pueden ser valiosos en muchas situaciones de cuidados críticos nuevas y en evolución. Por lo tanto, es esencial que el farmacéutico del hospital se familiarice con las implicaciones clínicas y los resultados asociados con el uso y la reversión de BNM.
Farmacología
Los BNM ejercen sus efectos farmacológicos modulando la transmisión de señales en el músculo esquelético. Los potenciales de acción (cambios en el potencial eléctrico asociados con el paso de un impulso a lo largo de la membrana de un músculo o una célula nerviosa) que alcanzan el músculo esquelético activan la liberación de acetilcolina en las placas terminales motoras. La acetilcolina se une a los receptores nicotínicos en la placa final, lo que resulta en la liberación de Na+ (sodio) en las fibras musculares, lo que desencadena el potencial de acción muscular. Los iones de calcio se liberan en el retículo sarcoplásmico, provocando la unión de la miosina a la actina. La miosina continuará uniéndose y moviéndose a lo largo de los sitios de actina, acortando el sarcómero, siempre y cuando el calcio esté presente en la célula. Los BNM funcionan de dos maneras para bloquear este proceso.
Los BNM despolarizantes actúan como agonistas en los receptores nicotínicos.1 Mantienen abiertos los canales controlados por iones, lo que conduce a la fasciculación muscular hasta que el potencial iónico se agota, y luego a la parálisis.2 La succinilcolina es el único NMBA despolarizante disponible. Los BNM no despolarizantes son antagonistas competitivos en los receptores nicotínicos, bloqueando la acetilcolina en la placa terminal motora.1 Esto evita que el potencial de acción se extienda, lo que hace que las células musculares sean insensibles a los impulsos nerviosos motores. La parálisis muscular ocurre de forma secuencial, comenzando con músculos pequeños y de contracción rápida en los ojos y la laringe y progresando a las extremidades, el tronco, las vías respiratorias, los músculos intercostales y el diafragma. La recuperación del bloqueo neuromuscular ocurre en orden inverso.2
Como resultado de sus efectos mecanicistas sobre la acetilcolina, los BNM exhiben muchos efectos secundarios. La acetilcolina desempeña un papel en la liberación de histamina, la activación muscarínica, la acción vagolítica y la liberación de norepinefrina. Como resultado, se han observado efectos secundarios como taquicardia y bradicardia, hipertensión e hipotensión, broncodilatación y broncoespasmo con su uso (TABLA 1).
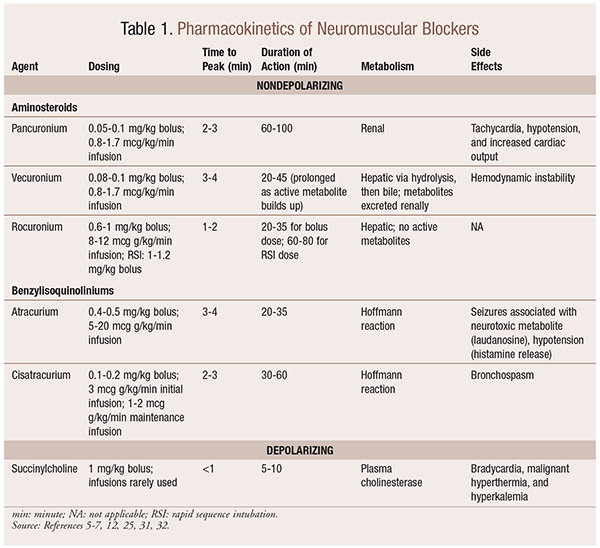
Farmacocinética
Dependiendo de la situación, es útil tener una variedad de perfiles cinéticos disponible cuando un NMBA se selecciona. El inicio rápido y la duración corta son útiles para indicaciones como la intubación de secuencia rápida (RSI), mientras que aquellos con una duración más larga son de mayor valor en cirugía. Ver en la TABLA 1 una breve descripción de los perfiles cinéticos, incluida la dosificación y los efectos adversos frecuentes.
Uso clínico
Quirúrgico: Los BNM han sido un elemento básico de la anestesiología y la cirugía desde la introducción de la succinilcolina en 1952.3-7 La elección del agente y la dosificación varían ampliamente dependiendo del procedimiento quirúrgico y también del uso de agentes alternativos, incluidos los anestésicos generales, los anestésicos locales y los sedantes intravenosos. La principal preocupación en el uso quirúrgico de los BNM es lograr niveles adecuados de bloqueo muscular sin inducir efectos secundarios cardiovasculares ni alargar la duración total del bloqueo más allá del período de tiempo del procedimiento quirúrgico.4 Aunque una discusión completa sobre la selección de agentes y la dosificación para indicaciones quirúrgicas está más allá del alcance de este artículo, se abordará la reversión clínica de estos efectos. La monitorización clínica de un paciente que ha recibido un BNM de acción intermedia a prolongada durante un procedimiento quirúrgico debe incluir la prueba de estimulación de los nervios periféricos (SNP) (que se discutirá más adelante).1,4
ISR: El ISR es un proceso emergente utilizado para asegurar la vía aérea de un paciente inestable. Los protocolos de ISR implican la administración de un agente de inducción de sedación profunda (por ejemplo, propofol, etomidato, midazolam) con la administración casi simultánea de un ABNM. El resultado deseado es que el paciente desarrolle tanto sedación amnésica como relajación muscular profunda, mejorando así la probabilidad de una intubación exitosa.8,9 La selección de los agentes adecuados debe basarse en la farmacocinética específica del agente y en variables clínicas específicas del paciente.
Un agente ideal para la ISR es uno con un inicio rápido y un desplazamiento rápido, lo que disminuye el tiempo desde la administración hasta la intubación y también reduce la duración general de la parálisis.10 Un retraso prolongado en la aparición del fármaco aumenta el riesgo general de hipoxia para el paciente. A medida que el tiempo de inicio se alarga, debe pasar más tiempo entre la última respiración a través de la bolsa y las primeras respiraciones a través del tubo endotraqueal. El aumento de la duración de la parálisis aumenta el riesgo de intubación fallida.10,11 En lugar de la rápida recuperación observada con la succinilcolina, los agentes de mayor duración, como el rocuronio, pueden requerir asistencia respiratoria durante más de 90 minutos.12
Una amplia revisión Cochrane publicada en 2015 demostró que la succinilcolina era superior al rocuronio con respecto a las condiciones de intubación favorables. Estos hallazgos probablemente reflejan el perfil cinético favorable de la succinilcolina.13 Sin embargo, existen varias contraindicaciones importantes para el uso de succinilcolina en la práctica clínica. En pacientes con antecedentes de hipertermia maligna o en aquellos con alto riesgo de desarrollar hiperpotasemia, el rocuronio sigue siendo un agente viable de ISR.
Cuidados intensivos
Síndrome de Dificultad Respiratoria Aguda (SDRA): Una de las principales preocupaciones clínicas para los pacientes que desarrollan SDRA es reducir la presión y el estrés en los pulmones, reduciendo así la inflamación adicional más allá del daño o insulto inicial. Debido a sus efectos sobre el tono diafragmático, se ha sugerido que los BNM sean un método para disminuir la asincronía del ventilador y las presiones pulmonares. Se han publicado tres estudios primarios en inglés que evaluaron el uso de los BNM en la fase temprana del SDRA.14-16 Cada estudio demostró un aumento de la oxigenación en pacientes tratados precozmente con una perfusión continua de cisatracurio de 48 horas. Un metanálisis de 2013 de los datos agrupados de estos estudios mostró que la administración temprana de cisatracurio produjo una reducción del barotrauma (P = .02) y disminución de la mortalidad hospitalaria (P = .005), pero no tuvo efecto sobre la duración de la ventilación mecánica (P=.57).17
Con base en estos hallazgos, es razonable considerar los BNM para el tratamiento del SDRA agudo en pacientes que se presentan a la UCI.4 Si bien el mecanismo de acción para todos los BNM no despolarizantes debería contribuir al mecanismo de beneficio clínico propuesto en el SDRA, los ensayos aleatorizados y controlados publicados utilizaron cisatracurio solo en el grupo intervencionista. No se ha abordado en la literatura si otros agentes tendrían un efecto en estos resultados.
Hipotermia terapéutica: Los BNM se han propuesto como parte de muchos algoritmos de tratamiento para pacientes sometidos a hipotermia terapéutica después de un paro cardíaco.18 Al controlar los escalofríos, los BNM pueden disminuir el consumo total de oxígeno. Aunque esto no se ha estudiado en cuidados intensivos, estos cambios fisiológicos se han demostrado en pacientes quirúrgicos sometidos a hipotermia durante el bypass cardiopulmonar.19,20 En un estudio retrospectivo de 111 pacientes sometidos a hipotermia terapéutica (18 con BNM frente a 93 sin hipotermia), hubo una mejora en la supervivencia hospitalaria (P = .004) que siguieron siendo significativas después del análisis multivariado de posibles factores de confusión basales (IC 95%, 1,56-33,38).21 También se observó una tendencia a mejorar el aclaramiento de lactato y los resultados funcionales en los pacientes que recibían ABNM continuo.
Otro estudio retrospectivo abordó la selección de BNM en pacientes sometidos a hipotermia terapéutica post paro cardíaco.22 Mediante un análisis multivariado, los investigadores compararon a 201 pacientes que recibieron hipotermia terapéutica (29,9% con cisatracurio frente a 17,9% con vecuronio). El cisatracurio fue el único predictor positivo independiente de supervivencia con buen desenlace neurológico (P = .014). Debido a la naturaleza retrospectiva y al pequeño tamaño de la muestra de este estudio, es difícil evaluar la potencia general para detectar cualquier diferencia ofrecida por el vecuronio similar a la observada con el cisatracurio. Es posible que las variables de confusión puedan tener una influencia más fuerte que el agente neuroblockade seleccionado en los resultados generales.22
Presión Intracraneal elevada (PIC): La PIC se maneja de forma rutinaria mediante sedación y analgesia profundas, lo que reduce el consumo de oxígeno y el metabolismo cerebral, al tiempo que controla el dolor, el movimiento y la asincronía del ventilador.2 La adición de BNM se considera solo cuando la sedación profunda es insuficiente para controlar aumentos peligrosos de la PIC, a menudo como resultado de tos, succión o escalofríos.2,12 Se ha demostrado que el uso temprano de ABNM conduce a una disminución de la mortalidad, pero a costa de un aumento de la morbilidad. Hsiang y sus colegas revisaron de forma retrospectiva los datos de una cohorte de 514 pacientes del Banco de Datos de Coma Traumático para evaluar el uso temprano de ABNM extendido versus el uso de ABNM de corta duración. La estancia en la UCI fue en promedio de 3 días más larga, más pacientes desarrollaron neumonía y hubo una tendencia hacia un mayor riesgo de sepsis en pacientes con BNM extendido. Además, a pesar de que hubo más muertes en el grupo de no-ABNM, el grupo de ABNM tuvo una mayor incidencia de sobrevivientes vegetativos o con discapacidades graves.23 El uso de BNM en el aumento de la PIC conduce a dificultades significativas en el control de la función neurológica y la actividad convulsiva.24
Agentes de reversión
Aunque poco frecuentes en la UCI, la reversión de los BNM es una parte importante del manejo quirúrgico de los pacientes que reciben paralíticos. Históricamente, esto ha ocurrido a través del uso de neostigmina en el postoperatorio.4 La neostigmina es un inhibidor de la acetilcolinesterasa (IAchE) que reduce la descomposición de la acetilcolina en la placa terminal motora, causando un aumento en la concentración de acetilcolina. Debido a que los BNM no despolarizantes son antagonistas competitivos del receptor nicotínico, la neostigmina aumenta la presión competitiva de la acetilcolina en el sitio de acción del fármaco. Aunque la neostigmina es eficaz para mejorar los tiempos de recuperación después de la administración de BNM, puede ser poco fiable debido a su mecanismo de acción indirecto.4,25 Si las concentraciones de MBNM son lo suficientemente altas, el antagonismo no puede superarse independientemente de la dosis de anticolinesterasa administrada. Se ha demostrado que el fracaso en revertir completamente los BNM en el postoperatorio aumenta las tasas de debilidad residual y disfagia y el riesgo de aspiración.4,25 Además, la neostigmina tiene sus propios efectos secundarios a través de su acción sobre los receptores nicotínicos y muscarínicos. Mientras que el receptor nicotínico se bloquea a través del BNM, el efecto de la neostigmina sobre el receptor muscarínico resulta en un aumento de los broncoespasmos, la motilidad gástrica, las secreciones y la bradicardia.Para reducir estos riesgos, se debe utilizar un agonista antimuscarínico como atropina o glicopirrolato con neostigmina para compensar el aumento de la activación muscarínica.
En diciembre de 2015, la FDA aprobó el sugammadex (Bridion), un novedoso agente de reversión directa para rocuronio y vecuronio. Clasificado como gamma-ciclodextrina, el sugammadex crea un complejo farmacológico con NMBA libre, reduciendo así las concentraciones de agentes disponibles. Estos efectos farmacocinéticos sobre la concentración de BNM son rápidos y completos. Sin embargo, debido a su tamaño, el cisatracurio, el atracurio y la succinilcolina no se ven afectados por el sugammadex.El beneficio principal de sugammadex, en comparación con la neostigmina, es la velocidad a la que se produce la reversión (2 minutos frente a 17 minutos).27 A diferencia de la ACheIs, el sugammadex no tiene efecto techo; es decir, con una dosis de sugammadex lo suficientemente grande, cualquier profundidad de parálisis puede revertirse rápidamente.26,28 Por último, el uso de sugammadex no tiene efecto farmacodinámico sobre los receptores muscarínicos, disminuyendo significativamente el perfil de efectos secundarios del medicamento y evitando la necesidad de coadministrar agentes antimuscarínicos. La dosificación de sugammadex se basa en el nivel de bloqueo neuromuscular, que varía de 2 mg/kg para el bloqueo moderado a 16 mg/kg para la reversión inmediata.26,28
Sedación
Es extremadamente importante reconocer que, aunque los BNM previenen el movimiento muscular, no tienen ningún efecto en el nivel de conciencia o la capacidad del paciente para percibir dolor o malestar, lo que resulta en un fenómeno descrito como conciencia no intencional.1 Ya sea para indicaciones quirúrgicas o médicas, los pacientes pueden estar en riesgo de sedación o analgesia insuficiente. Una serie de casos demostró que hasta el 18% de los pacientes mantienen algún grado de conciencia mientras están paralizados.29 Estos pacientes reportan sensaciones que van desde un estado onírico hasta una conciencia explícita. No hay ensayos que proporcionen orientación específica sobre el manejo de la conciencia no intencional durante el bloqueo neuromuscular. Independientemente de ello, se considera práctica estándar establecer y mantener niveles adecuados de analgesia y sedación profunda antes y durante el bloqueo neuromuscular.1
Monitoreo
El monitoreo de los pacientes con BNM es imperativo, pero los métodos a menudo se complican por el curso clínico, la administración conjunta de sedantes y analgésicos y las modalidades terapéuticas adicionales (por ejemplo, hipotermia terapéutica). El SNP es comúnmente considerado como el método de monitoreo de elección, pero tiene limitaciones. Los parámetros de monitoreo adicionales incluyen respiración espontánea y tendencias en los signos vitales.2
El SNP se recomienda de forma independiente para pacientes en perfusión continua de BNM y como coadyuvante en otras situaciones clínicas.1 Un dispositivo de tren de cuatro unido al orbicularis oculi, al nervio cubital o al nervio peroneo administra cuatro estímulos eléctricos sucesivos. En ausencia de bloqueo neuromuscular, se observará una respuesta de contracción igual para los cuatro estímulos, resultando en una relación T4/T1 de 1. En un paciente paralizado, la respuesta de contracción se debe observar con el primer estímulo, pero esto debe disminuir debido al bloqueo de las neuronas motoras. El objetivo es lograr una relación T4/T1 de aproximadamente 0,25.1
Complicaciones
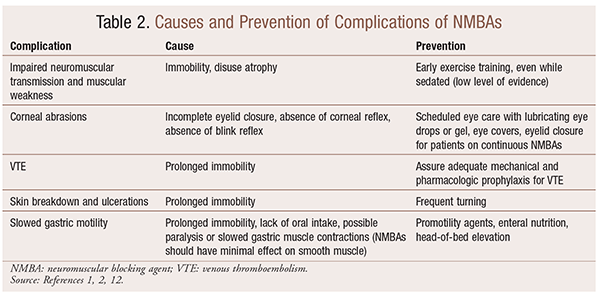
Aunque hay beneficios significativos en el uso de BNM en situaciones particulares, también hay complicaciones a corto y largo plazo. En el entorno agudo, el uso de BNM puede conducir a un aumento de la estancia en la UCI, ventilación mecánica prolongada, tromboembolismo venoso, desgarro y ulceraciones de la piel, infección, daño corneal y anafilaxia. La administración a largo plazo puede provocar inmovilidad o un aumento del tiempo de recuperación debido a la transmisión neuromuscular alterada y la debilidad muscular.30 En la TABLA 2 se describen varias recomendaciones para prevenir estos efectos.
Conclusión
El farmacéutico puede jugar un importante papel en la regulación y el uso de Abnm a través de una amplia gama de la clínica-sitios de práctica. Al comprender el mecanismo de acción, las indicaciones terapéuticas, la literatura de apoyo y los efectos secundarios clínicos de esta clase de medicamentos de alta alerta, el farmacéutico puede tener un efecto invaluable en la atención y la seguridad del paciente.
1. Murray MJ, Desbloqu H, Erstad B, et al. Guías de práctica clínica para el bloqueo neuromuscular sostenido en el paciente adulto en estado crítico. Medicina de Hematocrito. 2016;44:2079-2103.
2. Warr J, Thiboutot Z, Rose L, et al. Usos terapéuticos actuales, farmacología y consideraciones clínicas de los agentes bloqueantes neuromusculares para adultos en estado crítico. Ann Pharmacother. 2011;45:1116-1126.
3. Foldes FF, McNall PG, Borrego-Hinojosa JM. Succinilcolina: un nuevo enfoque de la relajación muscular en anestesiología. N Engl J Med. 1952;247:596-600.
4. Naguib M, Lien CA. Farmacología de los relajantes musculares y sus antagonistas. En: Anestesia Miller. 7th ed. Miller RD, Eriksson LI, Fleisher LA, et al, eds. Philadelphia, PA: Churchill Livingstone; 2010.
5. Anectine (succinilcolina) el inserto del paquete. Princeton, NJ: Sandoz Inc; septiembre de 2010.
6. Prospecto de rocuronio. Irvine, CA: Teva Parenteral Medicines, Inc; noviembre de 2008.
7. Prospecto de Nimbex (cisatracurio). North Chicago, IL: Abbott Laboratories; 2010.
8. Sakles JC, Laurin EG, Rantapaa AA, Panacek EA. Manejo de la vía aérea en el servicio de urgencias; estudio de un año de 610 intubaciones traqueales. Ann Emerg Med. 1998;31:325-332.
9. Tayal VS, Riggs RW, Marx JA, et al. Intubación de secuencia rápida en una residencia de medicina de emergencia: tasa de éxito y eventos adversos durante un período de dos años. Acad Emerg Med. 1999;6:31-37.
10. Li J, Murphy-Lavoie H, Bugas C, et al. Complicaciones de la intubación de emergencia con y sin parálisis. Am J Emerg Med. 1999;17:141-143.
11. Naguib M, Samarkandi AH, El-Din ME, et al. La dosis de succinilcolina necesaria para condiciones de intubación endotraqueal excelentes. Anesth Analg. 2006;102:151-155.12. Greenberg SB, Vender J. El uso de bloqueadores neuromusculares en la UCI: ¿dónde estamos ahora? Medicina de Hematocrito. 2013;41:1332-1344.13. Tran DT, Newton EK, Mount VA, et al. Rocuronio versus succinilcolina para intubación de inducción de secuencia rápida. Cochrane Database Syst Rev. 2015; (10): CD002788.14. Gainnier M, Roch A, Forel JM, et al. Efecto de los bloqueantes neuromusculares sobre el intercambio gaseoso en pacientes con síndrome de dificultad respiratoria aguda. Medicina de Hematocrito. 2004;32:113-119.15. Forel JM, Roch A, Marin V, et al. Los bloqueantes neuromusculares disminuyen la respuesta inflamatoria en pacientes que presentan síndrome de dificultad respiratoria aguda. Medicina de Hematocrito. 2006;34:2749-2757.16. Papazian L, Forel JM, Gacouin A, et al. Bloqueadores neuromusculares en el síndrome de distrés respiratorio agudo temprano. N Engl J Med. 2010;363:1107-1116.17. Alhazzani W, Alshahrani M, Jaeschke R, et al. Agentes bloqueantes neuromusculares en el síndrome de dificultad respiratoria aguda: una revisión sistémica y metanálisis de ensayos controlados aleatorios. Cuidado de Hematocrito. 2013; 17: R43.18. Chamorro C, Borrallo JM, Romera MA, et al. Protocolo de anestesia y analgesia durante la hipotermia terapéutica después de un paro cardíaco: una revisión sistemática. Anesth Analg. 2010;110:1328-1335.19. Cruise C, MacKinnon J, Tough J, Houston P. Comparación de meperidina y pancuronio para el tratamiento de temblores después de cirugía cardíaca. Puede J Anaesth. 1992;39:563-568.20. Sladen RN, Berend JZ, Fassero JS, et al. Comparación de vecuronio y meperidina sobre los efectos clínicos y metabólicos de los temblores después de la circulación extracorpórea hipotermal. J Cardiothorac Vasc Anesth. 1995;9:147-153.21. Salciccioli JD, Cocchi MN, Rittenberger JC, et al. El bloqueo neuromuscular continuo se asocia con una disminución de la mortalidad en pacientes post paro cardíaco. Resucitación. 2013;84:1728-1733.22. Baker WL, Geronila G, Kallur R, et al. Efecto de los bloqueantes neuromusculares en los resultados en pacientes que reciben hipotermia terapéutica tras un paro cardíaco. Analg Resusc Curr Res. 2013; S1.23. Hsiang JK, Chesnut RM, Crisp CB, et al. Parálisis temprana de rutina para el control de la presión intracraneal en lesiones craneales graves: ¿es necesario? Medicina de Hematocrito. 1994;22:1471-1476.24. Rangel-Castilla L, Gopinath S, Robertson CS. Manejo de la hipertensión intracraneal. Neurol Clin. 2008;26:521-541.25. Caldwell JE. Limitaciones clínicas de los antagonistas de la acetilcolinesterasa. Cuidado de Hematocrito J. 2009;24:21-28.
26. Bridion (sugammadex) package insert. Whitehouse Station, NJ: Merck & Co, Inc; July 2015.
27. Sacan O, White PF, Tufanogullari B, Klein K. Sugammadex reversal of rocuronium-induced neuromuscular blockade: a comparison with neostigmine-glycopyrrolate and edrophonium-atropine. Anesth Analg. 2007;10:569-574.
28. Meistelman C, Donati F. Do we really need sugammadex as an antagonist of muscle relaxants in anesthesia? Curr Opin Anaesthesiol. 2016;29:462-467.
29. Arnot-Smith J, Smith AF. Patient safety incidents involving neuromuscular blockade: análisis de los datos del Sistema Nacional de Presentación de Informes y Aprendizaje del Reino Unido de 2006 a 2008. Anestesia. 2010;65:1106-1113.30. Price DR, Mikkelsen ME, Umscheid CA, Armstrong EJ. Bloqueantes neuromusculares y disfunción neuromuscular adquirida en enfermedad crítica: revisión sistemática y metanálisis. Medicina de Hematocrito. 2016;44:2070-2078.31. Prielipp RC, Coursin DB, Scuderi PE, et al. Comparación de los requisitos de perfusión y los perfiles de recuperación de vecuronio y cisatracurio 51W89 en pacientes de la unidad de cuidados intensivos. Anesth Analg. 1995;81:3-12.32. Sparr HJ, Wierda JM, Proost JH, et al. Farmacodinámica y farmacocinética del rocuronio en pacientes de cuidados intensivos. Hermano Anaesth. 1997;78:267-273.