US Pharm. 2017; 42 (1): HS16-HS20.
abstrakt: neuromuskulære blokeringsmidler (NMBA ‘ er) spiller en vigtig rolle i forvaltningen af et stort antal hospitalspatienter. Farmakologien af NMBAs forstås godt, men brugen af disse midler kan være kontroversiel. NMBA ‘ er er almindelige i kirurgiske situationer og hurtig sekvensintubation, men andre indikationer, såsom akut respiratorisk nødsyndrom, terapeutisk hypotermi og forhøjet intrakranielt tryk, er noget splittende. Det er vigtigt for farmaceuter at være bekendt med kliniske implikationer og resultater forbundet med brugen af NMBAs. Derudover er det vigtigt at forstå samtidige overvejelser som sedation, overvågning og reversering. Apotekere på hospitalet skal være bekendt med det nyligt godkendte nye direkte reverseringsmiddel sugammadeks (Bridion).
neuromuskulære blokeringsmidler (NMBAs) spiller en vigtig rolle i forvaltningen af et stort antal hospitalspatienter. Ud over deres rutinemæssige anvendelse i kirurgisk anæstesi kan NMBA ‘ er være værdifulde i mange nye og udviklende kritiske plejesituationer. Derfor er det vigtigt for hospitalets Farmaceut at blive fortrolig med de kliniske implikationer og resultater forbundet med NMBA-brug og reversering.
farmakologi
NMBAs udøver deres farmakologiske virkninger ved at modulere signaloverførsel i skeletmuskulatur. Handlingspotentialer (ændringer i elektrisk potentiale forbundet med passage af en impuls langs membranen i en muskel eller nervecelle), der når skeletmuskulaturen, aktiverer frigivelsen af acetylcholin i motorens endeplader. Acetylcholin binder til nikotinreceptorer ved endepladen, hvilket resulterer i frigivelse af Na+ (natrium) i muskelfibre, hvilket udløser det muskulære handlingspotentiale. Calciumioner frigives derefter i det sarkoplasmatiske retikulum, hvilket fremkalder bindingen af myosin til actin. Myosin vil fortsætte med at binde og bevæge sig langs actinsteder, forkorte sarkomeren, så længe calcium er til stede i cellen. NMBAs arbejder på to måder for at blokere denne proces.
depolariserende NMBA ‘ er virker som agonister ved nikotinreceptorer.1 De holder de ion-gatede kanaler åbne, hvilket fører til muskulær fascikulation, indtil ionpotentialet er udtømt og derefter til lammelse.2 succinylcholin er den eneste depolariserende NMBA, der er tilgængelig. Nondepolariserende NMBA ‘ er er konkurrencedygtige antagonister ved nikotinreceptorer, der blokerer acetylcholin ved motorens endeplade.1 Dette forhindrer handlingspotentialet i at sprede sig, hvilket gør muskelceller ufølsomme over for motoriske nerveimpulser. Muskellammelse forekommer sekventielt, begyndende med små, hurtige muskler i øjnene og strubehovedet og udvikler sig til lemmer, bagagerum, luftvej, interkostale muskler og membran. Gendannelse fra neuromuskulær blokering forekommer i omvendt rækkefølge.2
som et resultat af deres mekanistiske virkninger på acetylcholin udviser NMBAs mange bivirkninger. Acetylcholin spiller en rolle i histaminfrigivelse, muskarinaktivering, vagolytisk virkning og norepinephrinfrigivelse. Som følge heraf er der set bivirkninger som takykardi og bradykardi, hypertension og hypotension samt bronchodilation og bronkospasme ved deres anvendelse (tabel 1).
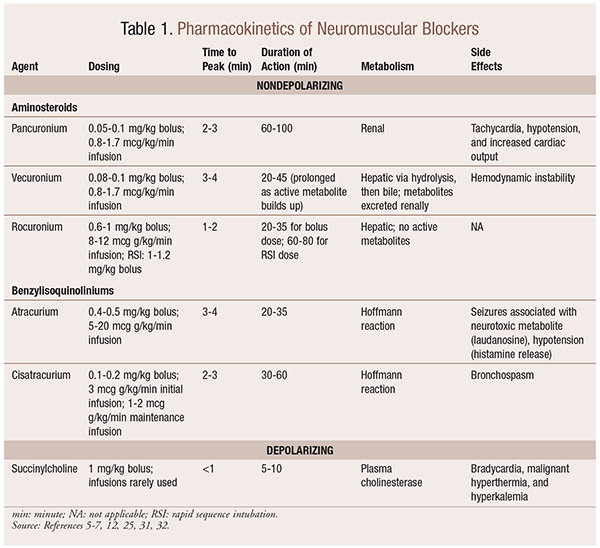
farmakokinetik
afhængigt af situationen er det nyttigt at have en række kinetiske profiler tilgængelige, når en NMBA vælges. Hurtig indtræden og kort varighed er nyttige til indikationer såsom hurtig sekvensintubation (RSI), mens de med længere varighed er af mere værdi i operationen. Se tabel 1 for en kort oversigt over kinetiske profiler, herunder dosering og almindelige bivirkninger.
klinisk anvendelse
kirurgisk: NMBA ‘ er har været en hæfteklammer til anæstesiologi og kirurgi siden introduktionen af succinylcholin i 1952.3-7 valget af middel og dosering varierer meget afhængigt af den kirurgiske procedure og også på brugen af alternative midler, herunder generelle anæstetika, lokalbedøvelsesmidler og IV-sedationsmedicin. Af primær bekymring ved kirurgisk brug af NMBAs er at opnå passende niveauer af muskelblokade uden at inducere kardiovaskulære bivirkninger eller forlænge den samlede varighed af blokade ud over tidsrammen for den kirurgiske procedure.4 selvom en fuldstændig diskussion af agentvalg og dosering til kirurgiske indikationer er uden for denne artikels anvendelsesområde, vil den kliniske vending af disse effekter blive behandlet. Klinisk overvågning af en patient, der har modtaget en Mellem – til langtidsvirkende NMBA under en kirurgisk procedure, bør omfatte perifer nervestimulering (PNS) test (diskuteret senere).1,4
RSI: RSI er en fremvoksende proces, der bruges til at sikre luftvejene hos en ustabil patient. RSI-protokoller involverer administration af et induktionsmiddel med dyb sedation (f.eks. Det ønskede resultat er, at patienten udvikler både amnestisk sedation og dyb muskelafslapning og derved forbedrer sandsynligheden for en vellykket intubation.8,9 valget af passende midler bør baseres på agentspecifik farmakokinetik og patientspecifikke kliniske variabler.
et ideelt middel til RSI er et med både en hurtig indtræden og en hurtig forskydning, hvilket reducerer tiden fra administration til intubation og reducerer også den samlede varighed af lammelse.10 en lang forsinkelse i lægemiddelindtræden øger den samlede risiko for hypoksi for patienten. Efterhånden som starttiden forlænges, skal der gå mere tid mellem det sidste åndedrag via posen og de første vejrtrækninger, der leveres via endotrachealrøret. Øget varighed af lammelse øger risikoen for mislykket intubation.10,11 i stedet for den hurtige bedring, der ses med succinylcholin, kan midler med længere varighed, såsom rocuronium, kræve åndedrætsstøtte i mere end 90 minutter.12
en stor Cochrane-gennemgang offentliggjort i 2015 viste, at succinylcholin var bedre end rocuronium med hensyn til gunstige intubationsbetingelser. Disse fund afspejler sandsynligvis den gunstige kinetiske profil af succinylcholin.13 Der findes imidlertid flere vigtige kontraindikationer for brugen af succinylcholin i klinisk praksis. Hos patienter med en historie med ondartet hypertermi eller hos dem med høj risiko for at udvikle hyperkalæmi forbliver rocuronium et levedygtigt RSI-middel.
kritisk pleje
akut respiratorisk nødsyndrom (ARDS): en af de primære kliniske bekymringer for patienter, der udvikler ARDS, er at reducere tryk og stress på lungerne og derved reducere yderligere betændelse ud over den oprindelige skade eller fornærmelse. På grund af deres virkninger på diafragmatisk tone er NMBA ‘ er blevet foreslået som en metode til faldende ventilatorasynkroni og lungetryk. Tre primære undersøgelser er blevet offentliggjort på engelsk, der evaluerede brugen af NMBAs i den tidlige fase af ARDS.14-16 hver undersøgelse viste øget iltning hos patienter behandlet tidligt med en 48-timers kontinuerlig infusion af cisatracurium. En metaanalyse fra 2013 af samlede data fra disse undersøgelser viste, at tidlig administration af cisatracurium resulterede i reduceret barotrauma (P = .02) og nedsat hospitalsdødelighed (P = .005), men havde ingen effekt på varigheden af mekanisk ventilation (P = .57).17
baseret på disse fund er det rimeligt at overveje NMBAs til behandling af akut ARDS hos patienter, der præsenterer for ICU.4 mens virkningsmekanismen for alle ikke-depolariserende NMBA ‘ er bør bidrage til den foreslåede mekanisme til klinisk fordel i ARDS, offentliggjorte randomiserede, kontrollerede forsøg anvendte kun cisatracurium i interventionsgruppen. Hvorvidt andre agenter ville have en effekt på disse resultater er ikke blevet behandlet i litteraturen.
terapeutisk hypotermi: NMBA ‘ er er blevet foreslået som en del af mange behandlingsalgoritmer til patienter, der gennemgår terapeutisk hypotermi efter hjertestop.18 ved at kontrollere rystelser kan NMBAs reducere det samlede iltforbrug. Selvom dette ikke er undersøgt i kritisk pleje, er disse fysiologiske ændringer blevet påvist hos kirurgiske patienter, der gennemgår hypotermi under kardiopulmonal bypass.19,20 i en retrospektiv undersøgelse af 111 patienter, der gennemgik terapeutisk hypotermi (18 med NMBA vs. 93 uden), var der en forbedring i hospitalets overlevelse (P = .004), der forblev signifikant efter multivariat analyse af potentielle baseline confounders (95% CI, 1,56-33,38).21 en tendens mod forbedringer i laktatclearance og funktionelle resultater blev også bemærket hos patienter, der fik kontinuerlig NMBA.
en anden retrospektiv undersøgelse behandlede udvælgelsen af NMBAs hos patienter, der gennemgik terapeutisk hypotermi efter hjertestop.22 ved hjælp af en multivariat analyse sammenlignede forskerne 201 patienter, der fik terapeutisk hypotermi (29,9% med cisatracurium vs. 17,9% med vecuronium). Cisatracurium var den eneste uafhængige positive forudsigelse for overlevelse med godt neurologisk resultat (P = .014). På grund af den retrospektive karakter og lille stikprøvestørrelse af denne undersøgelse er det vanskeligt at vurdere den samlede styrke til at detektere enhver forskel, der tilbydes af vecuronium svarende til det, der blev observeret med cisatracurium. Det er muligt, at forvirrende variabler kan have en stærkere indflydelse end det valgte neuroblockade-middel på de samlede resultater.22
forhøjet intrakranielt tryk (ICP): ICP styres rutinemæssigt af dyb sedation og analgesi, hvilket reducerer iltforbruget og cerebral metabolisme, mens man kontrollerer smerte, bevægelse og ventilatorasynkroni.2 tilsætningen af NMBAs overvejes kun, når dyb sedation er utilstrækkelig til at kontrollere farlige stigninger i ICP, ofte et resultat af hoste, sugning eller rysten.2,12 tidlig anvendelse af NMBA har vist sig at føre til nedsat dødelighed, men på bekostning af øget sygelighed. Hsiang og kolleger gennemgik retrospektivt data om en kohorte på 514 patienter fra den traumatiske koma-databank for at evaluere brugen af tidlig forlænget NMBA-brug versus kortvarig NMBA-brug. ICU-opholdet var i gennemsnit 3 dage længere, flere patienter udviklede lungebetændelse, og der var en tendens mod øget risiko for sepsis hos patienter med forlænget NMBA. Derudover, selvom der var flere dødsfald i ikke-NMBA-gruppen, havde NMBA-gruppen en større forekomst af vegetative eller alvorligt handicappede overlevende.23 anvendelse af NMBAs i øget ICP fører til betydelige vanskeligheder med at overvåge neurologisk funktion og anfaldsaktivitet.24
Reverseringsmidler
selvom det ikke er almindeligt i ICU, er reversering af NMBAs en vigtig del af den kirurgiske behandling af patienter, der får lammelser. Historisk set er dette sket ved brug af neostigmin postoperativt.4 Neostigmin er en acetylcholinesterasehæmmer (ACheI), der reducerer nedbrydningen af acetylcholin i den motoriske endeplade, hvilket forårsager en stigning i koncentrationen af acetylcholin. Fordi nondepolariserende NMBA ‘ er er konkurrencedygtige antagonister af nikotinreceptoren, øger neostigmin konkurrencetrykket af acetylcholin på stedet for lægemiddelvirkning. Selvom neostigmin er effektiv til at forbedre genopretningstiderne efter NMBA-administration, kan det være upålideligt på grund af dets indirekte virkningsmekanisme.4,25 hvis NMBA-koncentrationerne er høje nok, kan antagonismen ikke overvindes uanset den indgivne anticholinesterase-dosis. Manglende fuldstændig reversering af nmbas postoperativt har vist sig at øge antallet af resterende svaghed og dysfagi og risikoen for aspiration.4,25 derudover har neostigmin sine egne bivirkninger gennem sin virkning på både nikotinreceptorerne og muskarinreceptorerne. Mens nikotinreceptoren blokeres via NMBA, resulterer neostigmins virkning på den muskarinreceptor i øgede bronchospasmer, gastrisk motilitet, sekretioner og bradykardi.25 for at reducere disse risici skal en antimuskarinagonist, såsom atropin eller glycopyrrolat, anvendes sammen med neostigmin for at udligne den øgede muskarinaktivering.
i December 2015 godkendte FDA sugammadeks (Bridion), et nyt direkte reverseringsmiddel til rocuronium og vecuronium. Klassificeret som et gamma-cyclodekstrin skaber sugammadeks et lægemiddel-lægemiddelkompleks med fri NMBA, hvorved de tilgængelige middelkoncentrationer reduceres. Disse farmakokinetiske virkninger på NMBA-koncentrationen er både hurtige og fuldstændige. På grund af deres størrelse påvirkes cisatracurium, atracurium og succinylcholin imidlertid ikke af sugammadeks.26 den primære fordel ved sugammadeks sammenlignet med neostigmin er den hastighed, hvormed reversering sker (2 minutter mod 17 minutter).27 i modsætning til ACheIs har sugammadeks ingen loftseffekt; dvs.med en tilstrækkelig stor sugammadeksdosis kan enhver lammelsesdybde hurtigt vendes.26,28 endelig har anvendelsen af sugammadeks ingen farmakodynamisk virkning på muskarinreceptorer, hvilket signifikant mindsker lægemidlets bivirkningsprofil og undgår behovet for samtidig administration af antimuskarinmidler. Dosering sugammadeks baseret på niveauet af neuromuskulær blokade, der spænder fra 2 mg/kg til moderat blokade til 16 mg / kg til øjeblikkelig reversering.26,28
Sedation
det er ekstremt vigtigt at erkende, at selvom NMBA ‘ er forhindrer muskelbevægelse, har de ingen effekt på patientens bevidsthedsniveau eller evne til at opfatte smerte eller ubehag, hvilket resulterer i et fænomen beskrevet som utilsigtet bevidsthed.1 uanset om det er kirurgisk eller til medicinske indikationer, kan patienter være i fare for utilstrækkelig sedation eller analgesi. En case-serie viste, at op til 18% af patienterne opretholder en vis grad af bevidsthed, mens de er lammet.29 disse patienter rapporterer fornemmelser, der spænder fra en drømmeagtig tilstand til eksplicit bevidsthed. Der er ingen forsøg, der giver specifik vejledning om håndtering af utilsigtet bevidsthed under neuromuskulær blokade. Uanset hvad betragtes det som standardpraksis at etablere og opretholde passende niveauer af analgesi og dyb sedation før og under neuromuskulær blokade.1
overvågning
overvågning af patienter på NMBAs er bydende nødvendigt, men metoder kompliceres ofte af klinisk forløb, samtidig administration af beroligende midler og analgetika og yderligere terapeutiske modaliteter (f.eks. terapeutisk hypotermi). PNS betragtes almindeligvis som den valgte overvågningsmetode, men den har begrænsninger. Yderligere overvågningsparametre inkluderer spontan vejrtrækning og tendenser i vitale tegn.2
PNS anbefales uafhængigt til patienter i kontinuerlig infusion af NMBAs og som et supplement i andre kliniske situationer.1 En tog-af-fire enhed fastgjort ved orbicularis oculi, ulnar nerve eller peroneal nerve leverer fire på hinanden følgende elektriske stimuli. I fravær af neuromuskulær blokade observeres et lige trækrespons for alle fire stimuli, hvilket resulterer i et T4/T1-forhold på 1. I en lammet patient skal trækresponsen observeres med den første stimulus, men dette bør mindskes på grund af blokaden af motorneuroner. Målet er at opnå et T4 / T1-forhold på cirka 0,25.1
komplikationer
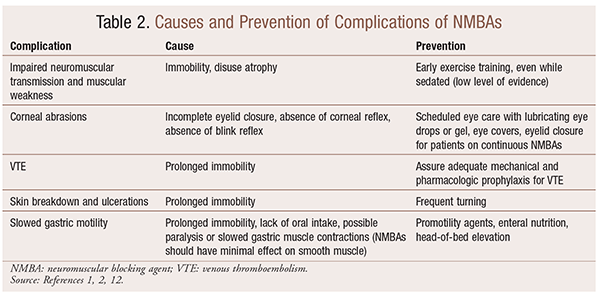
selvom der er betydelige fordele ved brugen af NMBAs i særlige situationer, er der også kortsigtede og langsigtede komplikationer. I den akutte indstilling kan brugen af NMBAs føre til øget ICU-ophold, langvarig mekanisk ventilation, venøs tromboembolisme, hudrivning og ulcerationer, infektion, hornhindeskade og anafylaksi. Langvarig administration kan føre til immobilitet eller øget restitutionstid på grund af nedsat neuromuskulær transmission og muskelsvaghed.30 flere anbefalinger til forebyggelse af disse virkninger er beskrevet i tabel 2.
konklusion
apotekeren kan spille en meget vigtig rolle i reguleringen og brugen af NMBAs på tværs af en lang række kliniske praksissteder. Ved at forstå virkningsmekanismen, Terapeutiske indikationer, understøttende litteratur og kliniske bivirkninger af denne medicin med høj alarmklasse kan Farmaceut have en uvurderlig effekt på patientpleje og patientsikkerhed.
1. Murray MJ, DeBlock H, Erstad B, et al. Retningslinjer for klinisk praksis for vedvarende neuromuskulær blokade hos den voksne kritisk syge patient. Crit Care Med. 2016;44:2079-2103.
2 . J, Thiboutot å, Rose L, et al. Nuværende terapeutiske anvendelser, farmakologi og kliniske overvejelser af neuromuskulære blokeringsmidler til kritisk syge voksne. Ann Pharmacother. 2011;45:1116-1126.
3. Foldes FF, McNall PG, Borrego-Hinojosa JM. Succinylcholin: en ny tilgang til muskelafslapning i anæstesiologi. N Engl J Med. 1952;247:596-600.
4. Naguib M, Lien CA. Farmakologi af muskelafslappende midler og deres antagonister. I: Miller ‘ s anæstesi. 7. udgave. Miller RD, Eriksson LI, Fleisher LA, et al, eds. Philadelphia, PA: Churchill Livingstone; 2010.
5. Anectine (succinylcholin) indlægsseddel. Princeton, NJ: Sandos Inc; September 2010.
6. Rocuronium indlægsseddel. Irvine, CA: Teva parenteral Medicines, Inc; November 2008.
7. Indlægsseddel (cisatracurium). North Chicago, IL: Abbott Laboratories; 2010.
8. Sakles JC, Laurin f. eks, Rantapaa AA, Panacek EA. Luftvejsstyring i akutafdelingen; en etårig undersøgelse af 610 trakealintubationer. Ann Emerg Med. 1998;31:325-332.
9. Tayal VS, Riggs RV, Ja, Et Al. Hurtig sekvens intubation ved et akutmedicinsk ophold: succesrate og bivirkninger i en periode på to år. Acad Emerg Med. 1999;6:31-37.
10. Li J, Murphy-Lavoie H, Bugas C, et al. Komplikationer af akut intubation med og uden lammelse. Am J Emerg Med. 1999;17:141-143.
11. Naguib M, Samarkandi AH, El-Din ME, et al. Den dosis succinylcholin, der kræves til fremragende endotracheal intubationsbetingelser. Anesth Analg. 2006;102:151-155.
12. Greenberg SB, Vender J. anvendelsen af neuromuskulære blokeringsmidler i ICU: hvor er vi nu? Crit Care Med. 2013;41:1332-1344.
13. Tran DT, Nyborg EK, Mount VA, et al. Rocuronium versus succinylcholin til hurtig sekvensinduktionsintubation. Cochrane Database Syst Rev. 2015;(10):CD002788.
14. Gainnier M, Roch A, Forel JM, et al. Effekt af neuromuskulære blokeringsmidler på gasudveksling hos patienter med akut respiratorisk nødsyndrom. Crit Care Med. 2004;32:113-119.
15. Forel JM, Roch A, Marin V, et al. Neuromuskulære blokeringsmidler reducerer inflammatorisk respons hos patienter med akut respiratorisk nødsyndrom. Crit Care Med. 2006;34:2749-2757.
16. Papasian L, Forel JM, Gacouin A, et al. Neuromuskulære blokkere i tidligt akut respiratorisk nødsyndrom. N Engl J Med. 2010;363:1107-1116.
17. Alshahrani M, Jaeschke R, et al. Neuromuskulære blokeringsmidler ved akut respiratorisk nødsyndrom: en systemisk gennemgang og metaanalyse af randomiserede kontrollerede forsøg. Crit Care. 2013; 17: R43.
18. Chamorro C, Borrallo JM, Romera MA, et al. Anæstesi og analgesi protokol under terapeutisk hypotermi efter hjertestop: en systematisk gennemgang. Anesth Analg. 2010;110:1328-1335.
19. Cruise C, MacKinnon J, Tough J, Houston P. sammenligning af meperidin og pancuronium til behandling af rystelser efter hjertekirurgi. Kan J Anaesth. 1992;39:563-568.
20. Sladen RN, Berend JS, Fassero JS, et al. Sammenligning af vecuronium og meperidin på de kliniske og metaboliske virkninger af rystelser efter hypotermisk kardiopulmonal bypass. J Cardiothorac Vasc Anesth. 1995;9:147-153.
21. Salciccioli JD, Cocchi MN, Rittenberger JC, et al. Kontinuerlig neuromuskulær blokade er forbundet med nedsat dødelighed hos patienter efter hjertestop. Genoplivning. 2013;84:1728-1733.
22. Baker VL, Geronila G, Kallur R, et al. Effekt af neuromuskulære blokkere på resultater hos patienter, der får terapeutisk hypotermi efter hjertestop. 2013; S1.
23. Hsiang JK, Chesnut RM, Crisp CB, et al. Tidlig rutinemæssig lammelse for intrakranielt tryk kontrol ved alvorlig hovedskade: er det nødvendigt? Crit Care Med. 1994;22:1471-1476.
24. Rangel-Castilla L, Gopinath S, Robertson CS. Behandling af intrakraniel hypertension. Neurol Clin. 2008;26:521-541.
25. Je. Kliniske begrænsninger af acetylcholinesteraseantagonister. J Crit Pleje. 2009;24:21-28.
26. Bridion (sugammadex) package insert. Whitehouse Station, NJ: Merck & Co, Inc; July 2015.
27. Sacan O, White PF, Tufanogullari B, Klein K. Sugammadex reversal of rocuronium-induced neuromuscular blockade: a comparison with neostigmine-glycopyrrolate and edrophonium-atropine. Anesth Analg. 2007;10:569-574.
28. Meistelman C, Donati F. Do we really need sugammadex as an antagonist of muscle relaxants in anesthesia? Curr Opin Anaesthesiol. 2016;29:462-467.
29. Arnot-Smith J, Smith AF. Patient safety incidents involving neuromuscular blockade: analyse af det britiske nationale rapporterings-og Læringssystemdata fra 2006 til 2008. Anæstesi. 2010;65:1106-1113.
30. Pris DR, Mikkelsen mig, Umscheid CA, Armstrong EJ. Neuromuskulære blokeringsmidler og neuromuskulær dysfunktion erhvervet ved kritisk sygdom: en systematisk gennemgang og metaanalyse. Crit Care Med. 2016;44:2070-2078.
31. Prielipp RC, Coursin DB, Scuderi PE, et al. Sammenligning af infusionsbehov og genopretningsprofiler for vecuronium og cisatracurium 51V89 hos patienter med intensivafdeling. Anesth Analg. 1995;81:3-12.
32. Sparr HJ, Jm, Proost JH, et al. Farmakodynamik og farmakokinetik af rocuronium hos intensivpatienter. Br J Anaesth. 1997;78:267-273.