US Pharm. 2017; 42(1):HS16-HS20.
ABSTRACT: Gli agenti bloccanti neuromuscolari (NMBA) svolgono un ruolo importante nella gestione di un gran numero di pazienti ospedalieri. La farmacologia di NMBAs è ben compresa, ma l’uso di questi agenti può essere controverso. NMBAs sono comuni in situazioni chirurgiche e intubazione rapida sequenza, ma altre indicazioni, come la sindrome da distress respiratorio acuto, ipotermia terapeutica e pressione intracranica elevata, sono un po ‘ divisive. È essenziale per i farmacisti avere familiarità con le implicazioni cliniche e gli esiti associati all’uso di NMBAs. Inoltre, è importante comprendere considerazioni concomitanti come la sedazione, il monitoraggio e l’inversione. I farmacisti in ambiente ospedaliero devono avere familiarità con il nuovo agente di inversione diretta sugammadex (Bridion) recentemente approvato.
Gli agenti bloccanti neuromuscolari (NMBA) svolgono un ruolo importante nella gestione di un gran numero di pazienti ospedalieri. Oltre al loro uso di routine in anestesia chirurgica, NMBAs può essere utile in molte situazioni critiche nuove e in evoluzione. Pertanto, è essenziale per il farmacista ospedaliero acquisire familiarità con le implicazioni cliniche e gli esiti associati all’uso e all’inversione di NMBA.
Farmacologia
Gli NMBA esercitano i loro effetti farmacologici modulando la trasmissione del segnale nel muscolo scheletrico. Potenziali d’azione (cambiamenti nel potenziale elettrico associati al passaggio di un impulso lungo la membrana di un muscolo o di una cellula nervosa) raggiungendo il muscolo scheletrico attiva il rilascio di acetilcolina nelle piastre terminali del motore. L’acetilcolina si lega ai recettori nicotinici all’estremità, con conseguente rilascio di Na +(sodio) nelle fibre muscolari, che innesca il potenziale d’azione muscolare. Gli ioni di calcio vengono quindi rilasciati nel reticolo sarcoplasmatico, provocando il legame della miosina con l’actina. La miosina continuerà a legarsi e muoversi lungo i siti di actina, accorciando il sarcomero, finché il calcio è presente nella cellula. Gli NMBA funzionano in due modi per bloccare questo processo.
Gli NMBA depolarizzanti agiscono come agonisti nei recettori nicotinici.1 Tengono aperti i canali ionici, portando alla fascicolazione muscolare fino a quando il potenziale ionico non si esaurisce e quindi alla paralisi.2 Succinilcolina è l’unico NMBA depolarizzante disponibile. NNBAs Nondepolarizing sono antagonisti competitivi a recettori nicotinic, bloccando acetilcolina alla piastra terminale del motore.1 Ciò impedisce la diffusione del potenziale d’azione, rendendo così le cellule muscolari insensibili agli impulsi nervosi motori. La paralisi muscolare si verifica in sequenza, a partire da piccoli muscoli a contrazione rapida negli occhi e nella laringe e progredendo fino agli arti, al tronco, alle vie aeree, ai muscoli intercostali e al diaframma. Il recupero dal blocco neuromuscolare avviene nell’ordine inverso.2
Come risultato dei loro effetti meccanicistici sull’acetilcolina, gli NMBA presentano molti effetti collaterali. L’acetilcolina svolge un ruolo nel rilascio di istamina, attivazione muscarinica, azione vagolitica e rilascio di noradrenalina. Di conseguenza, sono stati osservati effetti collaterali come tachicardia e bradicardia, ipertensione e ipotensione e broncodilatazione e broncospasmo con il loro uso (TABELLA 1).
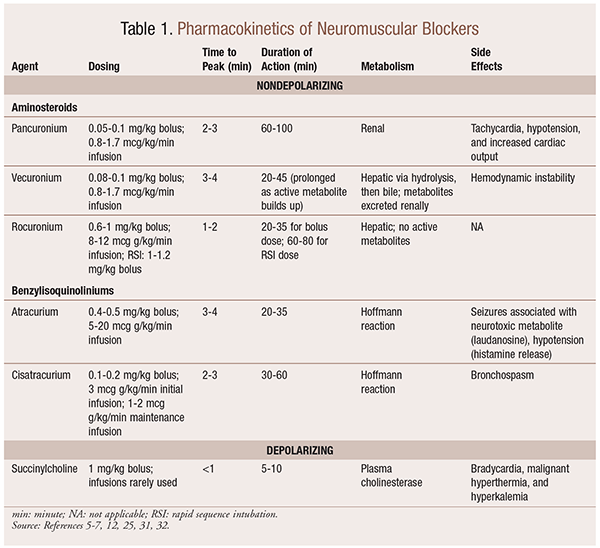
Farmacocinetica
A seconda della situazione, è utile avere una varietà di profili cinetici disponibili quando viene selezionato un NMBA. L’inizio rapido e la breve durata sono utili per le indicazioni quale l’intubazione rapida di sequenza (RSI), mentre quelli con una durata più lunga sono di più valore nella chirurgia. Vedere la TABELLA 1 per una breve panoramica dei profili cinetici, compreso il dosaggio e gli effetti indesiderati comuni.
Uso clinico
Chirurgico: NMBAs sono stati un fiocco di anestesiologia e chirurgia dall’introduzione di succinilcolina in 1952.3 – 7 La scelta di agente e dosaggio varia ampiamente a seconda della procedura chirurgica e anche sull’uso di agenti alternativi, tra cui anestetici generali, anestetici locali e farmaci di sedazione IV. Di primaria preoccupazione nell’uso chirurgico di NMBAs è quello di raggiungere livelli appropriati di blocco muscolare senza indurre effetti collaterali cardiovascolari o allungare la durata totale del blocco oltre il periodo di tempo della procedura chirurgica.4 Sebbene una discussione completa sulla selezione e il dosaggio degli agenti per le indicazioni chirurgiche vada oltre lo scopo di questo articolo, verrà affrontata l’inversione clinica di questi effetti. Il monitoraggio clinico di un paziente che ha ricevuto una NMBA da intermedia a lunga durata d’azione durante una procedura chirurgica dovrebbe includere il test di stimolazione del nervo periferico (PNS) (discusso più avanti).1,4
RSI: RSI è un processo emergente utilizzato per proteggere le vie aeree di un paziente instabile. I protocolli RSI comportano la somministrazione di un agente di induzione di sedazione profonda (ad esempio, propofol, etomidato, midazolam) con la somministrazione quasi simultanea di un NMBA. Il risultato desiderato è che il paziente sviluppi sia la sedazione amnestica che il rilassamento muscolare profondo, migliorando così la probabilità di un’intubazione di successo.8,9 La selezione degli agenti appropriati deve essere basata sulla farmacocinetica agente-specifica e sulle variabili cliniche paziente-specifiche.
Un agente ideale per RSI è uno con sia un inizio rapido che un offset rapido, che diminuisce il tempo dalla somministrazione all’intubazione e riduce anche la durata complessiva della paralisi.10 Un lungo ritardo nell’insorgenza del farmaco aumenta il rischio complessivo di ipossia per il paziente. Man mano che il tempo di insorgenza si allunga, deve passare più tempo tra l’ultimo respiro attraverso la sacca e i primi respiri erogati attraverso il tubo endotracheale. L’aumento della durata della paralisi aumenta il rischio di intubazione fallita.10,11 Invece del rapido recupero osservato con succinilcolina, agenti di durata più lunga come il rocuronio possono richiedere supporto respiratorio per più di 90 minuti.12
Una grande recensione di Cochrane pubblicata nel 2015 ha dimostrato che la succinilcolina era superiore al rocuronio per quanto riguarda le condizioni di intubazione favorevoli. Questi risultati probabilmente riflettono il profilo cinetico favorevole di succinilcolina.13 Tuttavia, nella pratica clinica esistono diverse importanti controindicazioni all’uso di succinilcolina. Nei pazienti con una storia di ipertermia maligna o in quelli ad alto rischio di sviluppare iperkaliemia, il rocuronio rimane un agente RSI vitale.
Critical Care
Sindrome da distress respiratorio acuto (ARDS): una delle preoccupazioni cliniche primarie per i pazienti che sviluppano ARDS è ridurre la pressione e lo stress sui polmoni, riducendo così l’infiammazione aggiuntiva oltre il danno iniziale o l’insulto. A causa dei loro effetti sul tono diaframmatico, gli NMBA sono stati suggeriti come metodo per ridurre l’asincronia del ventilatore e le pressioni polmonari. Tre studi primari sono stati pubblicati in inglese che hanno valutato l’uso di NMBAs nella fase iniziale di ARDS.14-16 Ogni studio ha dimostrato un aumento dell’ossigenazione in pazienti trattati precocemente con infusione continua di cisatracurio per 48 ore. Una meta-analisi del 2013 dei dati raccolti da questi studi ha mostrato che la somministrazione precoce di cisatracurium ha determinato una riduzione del barotrauma (P = .02) e diminuzione della mortalità ospedaliera (P = .005), ma non ha avuto alcun effetto sulla durata della ventilazione meccanica (P = .57).17
Sulla base di questi risultati, è ragionevole prendere in considerazione NMBAs per il trattamento della ARDS acuta nei pazienti che si presentano in terapia intensiva.4 Mentre il meccanismo d’azione per tutti NMBAS non depolarizzanti dovrebbe contribuire al meccanismo proposto di beneficio clinico in ARDS, pubblicato randomizzato, studi controllati utilizzati cisatracurium solo nel gruppo interventistico. Se altri agenti avrebbero un effetto su questi risultati non è stato affrontato in letteratura.
Ipotermia terapeutica: NMBAs sono stati proposti come parte di molti algoritmi di trattamento per i pazienti sottoposti a ipotermia terapeutica post arresto cardiaco.18 Controllando i brividi, gli NMBA possono ridurre il consumo totale di ossigeno. Sebbene questo non sia stato studiato in terapia intensiva, questi cambiamenti fisiologici sono stati dimostrati in pazienti chirurgici sottoposti a ipotermia durante il bypass cardiopolmonare.19,20 In uno studio retrospettivo su 111 pazienti sottoposti a ipotermia terapeutica (18 con NMBA contro 93 senza), c’è stato un miglioramento della sopravvivenza ospedaliera (P = .004) che è rimasto significativo dopo l’analisi multivariata dei potenziali confondenti al basale (IC al 95%, 1,56-33,38).21 Una tendenza verso miglioramenti nella clearance del lattato e nei risultati funzionali è stata anche notata nei pazienti che ricevevano NMBA continuo.
Un altro studio retrospettivo ha affrontato la selezione di NMBA in pazienti sottoposti a ipotermia terapeutica dopo arresto cardiaco.22 Utilizzando un’analisi multivariata, i ricercatori hanno confrontato 201 pazienti trattati con ipotermia terapeutica (29,9% con cisatracurio contro 17,9% con vecuronio). Cisatracurium era l’unico predittore positivo indipendente di sopravvivenza con un buon esito neurologico (P = .014). A causa della natura retrospettiva e delle piccole dimensioni del campione di questo studio, è difficile valutare la potenza complessiva di rilevare qualsiasi differenza offerta dal vecuronio simile a quanto osservato con cisatracurio. È possibile che le variabili confondenti possano avere un’influenza più forte dell’agente neuroblockade selezionato sui risultati complessivi.22
Pressione intracranica elevata (ICP): L’ICP è gestito di routine da sedazione profonda e analgesia, riducendo il consumo di ossigeno e il metabolismo cerebrale, controllando il dolore, il movimento e l’asincronia del ventilatore.2 L’aggiunta di NMBAS è considerata solo quando la sedazione profonda è insufficiente per controllare aumenti pericolosi di ICP, spesso a causa di tosse, aspirazione o brividi.2,12 L’uso precoce di NMBA ha dimostrato di portare a una diminuzione della mortalità, ma a costo di una maggiore morbilità. Hsiang e colleghi hanno esaminato retrospettivamente i dati su una coorte di pazienti 514 dalla banca dati del coma traumatico per valutare l’uso di NMBA esteso precoce rispetto all’uso di NMBA di breve durata. La degenza in terapia intensiva è stata in media di 3 giorni in più, più pazienti hanno sviluppato polmonite e c’è stata una tendenza verso un aumento del rischio di sepsi nei pazienti con NMBA estesa. Inoltre, sebbene ci fossero più morti nel gruppo non-NMBA, il gruppo NMBA aveva una maggiore incidenza di sopravvissuti vegetativi o gravemente disabili.23 L’uso di NMBAs in ICP aumentato porta a difficoltà significative nel monitoraggio della funzione neurologica e dell’attività convulsiva.
Agenti di inversione
Sebbene non comuni in terapia intensiva, l ‘ inversione degli NMBAS è una parte importante della gestione chirurgica dei pazienti trattati con paralitici. Storicamente, questo si è verificato attraverso l’uso di neostigmina postoperatoria.4 La neostigmina è un inibitore dell’acetilcolinesterasi (ACheI) che riduce la degradazione dell’acetilcolina nella piastra terminale del motore, causando un aumento della concentrazione di acetilcolina. Poiché i NMBA non depolarizzanti sono antagonisti competitivi del recettore nicotinico, la neostigmina aumenta la pressione competitiva dell’acetilcolina nel sito di azione del farmaco. Sebbene la neostigmina sia efficace nel migliorare i tempi di recupero dopo la somministrazione di NMBA, può essere inaffidabile a causa del suo meccanismo d’azione indiretto.4,25 Se le concentrazioni di NMBA sono abbastanza elevate, l’antagonismo non può essere superato indipendentemente dalla dose di anticolinesterasi somministrata. La mancata inversione completa della NMBAS postoperatoria ha dimostrato di aumentare i tassi di debolezza residua e disfagia e il rischio di aspirazione.4,25 Inoltre, la neostigmina ha i suoi effetti collaterali attraverso la sua azione sia sui recettori nicotinici che su quelli muscarinici. Mentre il ricevitore nicotinico è bloccato via il NMBA, l’effetto della neostigmina sui risultati del ricevitore muscarinico nei broncospasmi aumentati, nella motilità gastrica, nelle secrezioni e nella bradicardia.Per ridurre questi rischi, un agonista antimuscarinico come atropina o glicopirrolato deve essere usato con neostigmina per compensare l ‘ aumentata attivazione muscarinica.
Nel dicembre 2015, la FDA ha approvato sugammadex (Bridion), un nuovo agente di inversione diretta per rocuronio e vecuronio. Classificato come gamma-ciclodestrina, sugammadex crea un complesso farmaco-farmaco con NMBA libero, riducendo così le concentrazioni di agenti disponibili. Questi effetti farmacocinetici sulla concentrazione di NMBA sono sia rapidi che completi. Tuttavia, a causa delle loro dimensioni, cisatracurio, atracurio e succinilcolina non sono influenzati da sugammadex.Il beneficio principale di sugammadex, rispetto alla neostigmina, è la velocità con cui si verifica l’inversione (2 minuti contro 17 minuti).27 A differenza di ACheIs, sugammadex non ha alcun effetto massimale; cioè, con una dose di sugammadex abbastanza grande, qualsiasi profondità di paralisi può essere rapidamente invertita.26,28 Infine, l’uso di sugammadex non ha alcun effetto farmacodinamico sui recettori muscarinici, diminuendo significativamente il profilo degli effetti collaterali del farmaco ed evitando la necessità di somministrare agenti antimuscarinici. Il dosaggio di sugammadex si basa sul livello di blocco neuromuscolare, che varia da 2 mg / kg per il blocco moderato a 16 mg/kg per l’inversione immediata.26,28
Sedazione
È estremamente importante riconoscere che, sebbene gli NMBA impediscano il movimento muscolare, non hanno alcun effetto sul livello di coscienza o sulla capacità del paziente di percepire dolore o disagio, con conseguente fenomeno descritto come consapevolezza involontaria.1 Sia per indicazioni chirurgiche che mediche, i pazienti possono essere a rischio di sedazione o analgesia insufficiente. Una serie di casi ha dimostrato che fino al 18% dei pazienti mantiene un certo grado di consapevolezza mentre è paralizzato.29 Questi pazienti riportano sensazioni che vanno da uno stato onirico a una consapevolezza esplicita. Non ci sono studi che forniscono una guida specifica sulla gestione della consapevolezza involontaria durante il blocco neuromuscolare. Indipendentemente da ciò, è considerata pratica standard stabilire e mantenere livelli appropriati di analgesia e sedazione profonda prima e durante il blocco neuromuscolare.1
Monitoraggio
Il monitoraggio dei pazienti con NMBAs è imperativo, ma i metodi sono spesso complicati dal decorso clinico, dalla somministrazione concomitante di sedativi e analgesici e da ulteriori modalità terapeutiche (ad esempio, ipotermia terapeutica). PNS è comunemente considerato come il metodo di monitoraggio di scelta, ma ha limitazioni. Ulteriori parametri di monitoraggio includono la respirazione spontanea e le tendenze nei segni vitali.2
PNS è raccomandato indipendentemente per i pazienti in infusione continua di NMBAs e come aggiunta in altre situazioni cliniche.1 Un treno-di-quattro dispositivo collegato al orbicularis oculi, nervo ulnare, o nervo peroneo fornisce quattro stimoli elettrici successivi. In assenza di blocco neuromuscolare, si osserverà una risposta di contrazione uguale per tutti e quattro gli stimoli, con conseguente rapporto T4/T1 di 1. In un paziente paralizzato, la risposta a contrazione deve essere osservata con il primo stimolo, ma questo dovrebbe diminuire a causa del blocco dei motoneuroni. L’obiettivo è ottenere un rapporto T4/T1 di circa 0,25.1
Complicazioni
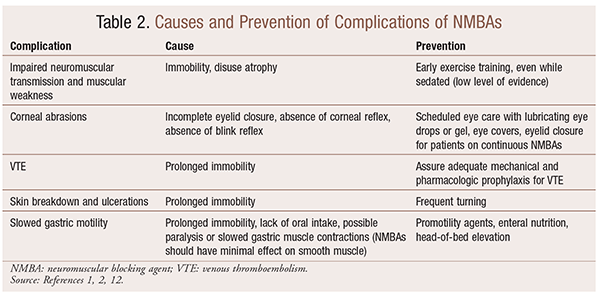
Sebbene ci siano benefici significativi per l’uso di NMBAs in situazioni particolari, ci sono anche complicazioni a breve e lungo termine. Nel contesto acuto, l’uso di NMBAs può portare ad un aumento della degenza in terapia intensiva, ventilazione meccanica prolungata, tromboembolia venosa, lacrimazione e ulcerazioni della pelle, infezione, danno corneale e anafilassi. La somministrazione a lungo termine può portare all’immobilità o all’aumento del tempo di recupero a causa della ridotta trasmissione neuromuscolare e della debolezza muscolare.30 Diverse raccomandazioni per prevenire questi effetti sono illustrate nella TABELLA 2.
Conclusione
Il farmacista può svolgere un ruolo molto importante nella regolazione e nell’uso di NMBA in un’ampia gamma di siti di pratica clinica. Comprendendo il meccanismo d’azione, le indicazioni terapeutiche, la letteratura di supporto e gli effetti collaterali clinici di questa classe di farmaci ad alta allerta, il farmacista può avere un effetto inestimabile sulla cura del paziente e sulla sicurezza del paziente.
1. Per maggiori informazioni:
2. Il suo nome deriva dal greco antico, “War”, “War”, “Th”, “Th”, “Rose”, “Rose”. Usi terapeutici attuali, farmacologia e considerazioni cliniche degli agenti bloccanti neuromuscolari per adulti criticamente malati. Ann Pharmacother. 2011;45:1116-1126.
3. Foldes FF, McNall PG, Borrego-Hinojosa JM. Succinilcolina: un nuovo approccio al rilassamento muscolare in anestesiologia. N Ingl J Med. 1952;247:596-600.
4. Naguib M, Pegno CA. Farmacologia dei miorilassanti e dei loro antagonisti. In: L’anestesia di Miller. 7a ed. Miller RD, Eriksson LI, Fleisher LA, et al, eds. Filadelfia, PA: Churchill Livingstone; 2010.
5. Anectina (succinilcolina) foglietto illustrativo. Nel 2010 si trasferisce in Italia.
6. Foglietto illustrativo in rocuronio. Irvine, CA: Teva Parenteral Medicines, Inc; Novembre 2008.
7. Foglietto illustrativo Nimbex (cisatracurium). North Chicago, IL: Abbott Laboratories; 2010.
8. Il nostro obiettivo è quello di migliorare la qualità della vita. Gestione delle vie aeree nel pronto soccorso; uno studio di un anno su 610 intubazioni tracheali. Ann Emerg Med. 1998;31:325-332.
9. Tayal VS, Riggs RW, Marx JA, et al. Intubazione rapida-sequenza ad una residenza di medicina di emergenza: tasso di successo ed eventi avversi durante un periodo di due anni. Acad Emerg Med. 1999;6:31-37.
10. Li J, Murphy-Lavoie H, Bugas C, et al. Complicazioni di intubazione di emergenza con e senza paralisi. Am J Emerg Med. 1999;17:141-143.
11. Naguib M, Samarkandi AH, El-Din ME, et al. La dose di succinilcolina necessaria per eccellenti condizioni di intubazione endotracheale. Anesth Analg. 2006;102:151-155.
12. Greenberg SB, Vender J. L’uso di agenti bloccanti neuromuscolari in terapia intensiva: dove siamo adesso? Crit Cura Med. 2013;41:1332-1344.
13. Per maggiori informazioni:
14. Gainnier M, Roch A, Forel JM, et al. Effetto degli agenti bloccanti neuromuscolari sullo scambio gassoso in pazienti che presentano sindrome da distress respiratorio acuto. Crit Cura Med. 2004;32:113-119.
15. Forel JM, Roch A, Marin V, et al. I bloccanti neuromuscolari riducono la risposta infiammatoria nei pazienti che presentano sindrome da distress respiratorio acuto. Crit Cura Med. 2006;34:2749-2757.
16. Papazian L, Forel JM, Gacouin A, et al. Bloccanti neuromuscolari nella sindrome da distress respiratorio acuto precoce. N Ingl J Med. 2010;363:1107-1116.
17. Alhazzani W, Alshahrani M, Jaeschke R, et al. Agenti bloccanti neuromuscolari nella sindrome da distress respiratorio acuto: una revisione sistemica e meta-analisi di studi randomizzati controllati. Cura critica. 2013;17: R43.
18. Chamorro C, Borrallo JM, Romera MA, et al. Protocollo di anestesia e analgesia durante l’ipotermia terapeutica dopo arresto cardiaco: una revisione sistematica. Anesth Analg. 2010;110:1328-1335.
19. Cruise C, MacKinnon J, Tough J, Houston P. Confronto tra meperidina e pancuronio per il trattamento del brivido dopo la chirurgia cardiaca. Può J Anaesth. 1992;39:563-568.
20. I nostri servizi sono sempre disponibili. Confronto tra vecuronio e meperidina sugli effetti clinici e metabolici del brivido dopo bypass cardiopolmonare ipotermico. J Cardiothorac Vasc Anesth. 1995;9:147-153.
21. Salciccioli JD, Cocchi MN, Rittenberger JC, et al. Il blocco neuromuscolare continuo è associato a una diminuzione della mortalità nei pazienti con arresto post-cardiaco. Rianimazione. 2013;84:1728-1733.
22. I nostri servizi sono a vostra disposizione. Effetto dei bloccanti neuromuscolari sugli esiti in pazienti sottoposti a ipotermia terapeutica a seguito di arresto cardiaco. 2013; S1.
23. I nostri servizi sono a vostra disposizione. Paralisi precoce di routine per il controllo della pressione intracranica in gravi lesioni alla testa: è necessario? Crit Cura Med. 1994;22:1471-1476.
24. Rangel-Castilla L, Gopinath S, Robertson CS. Gestione dell’ipertensione intracranica. Neurol Clin. 2008;26:521-541.
25. Caldwell JE. Limitazioni cliniche degli antagonisti dell’acetilcolinesterasi. J Crit Cura. 2009;24:21-28.
26. Bridion (sugammadex) package insert. Whitehouse Station, NJ: Merck & Co, Inc; July 2015.
27. Sacan O, White PF, Tufanogullari B, Klein K. Sugammadex reversal of rocuronium-induced neuromuscular blockade: a comparison with neostigmine-glycopyrrolate and edrophonium-atropine. Anesth Analg. 2007;10:569-574.
28. Meistelman C, Donati F. Do we really need sugammadex as an antagonist of muscle relaxants in anesthesia? Curr Opin Anaesthesiol. 2016;29:462-467.
29. Arnot-Smith J, Smith AF. Patient safety incidents involving neuromuscular blockade: analisi dei dati del sistema nazionale di segnalazione e apprendimento del Regno Unito dal 2006 al 2008. Anestesia. 2010;65:1106-1113.
30. Prezzo DR, Mikkelsen ME, Umscheid CA, Armstrong EJ. Agenti bloccanti neuromuscolari e disfunzione neuromuscolare acquisita in malattia critica: una revisione sistematica e meta-analisi. Crit Cura Med. 2016;44:2070-2078.
31. Prielipp RC, Coursin DB, Scuderi PE, et al. Confronto dei requisiti di infusione e dei profili di recupero di vecuronio e cisatracurio 51W89 nei pazienti dell’unità di terapia intensiva. Anesth Analg. 1995;81:3-12.
32. Il sito è stato pubblicato nel 2007. Farmacodinamica e farmacocinetica del rocuronio in pazienti in terapia intensiva. Br J Anaesth. 1997;78:267-273.