US Pharm. 2017; 42 (1): HS16-HS20.
abstrakt: neuromuskulární blokátory (NMBA) hrají důležitou roli při léčbě velkého počtu nemocničních pacientů. Farmakologie NMBAs je dobře pochopena, ale použití těchto látek může být kontroverzní. NMBA jsou běžné v chirurgických situacích a rychlé sekvenční intubaci, ale jiné indikace, jako je syndrom akutní respirační tísně, terapeutická hypotermie a zvýšený intrakraniální tlak, jsou poněkud rozporuplné. Je nezbytné, aby lékárníci byli obeznámeni s klinickými důsledky a výsledky spojenými s používáním NMBA. Kromě toho je důležité porozumět souběžným úvahám, jako je sedace, monitorování a zvrácení. Lékárníci v nemocničním prostředí by měli být obeznámeni s nedávno schválenou novelu přímé-obrácení agent sugammadex (Bridion).
neuromuskulární blokátory (NMBA) hrají důležitou roli při léčbě velkého počtu nemocničních pacientů. Kromě jejich rutinního použití v chirurgické anestezii mohou být NMBA cenné v mnoha nových a vyvíjejících se situacích kritické péče. Proto je nezbytné, aby se nemocniční lékárník seznámil s klinickými důsledky a výsledky spojenými s použitím a zvratem NMBA.
farmakologie
NMBA vykazují své farmakologické účinky modulací přenosu signálu v kosterním svalu. Akční potenciály (změny elektrického potenciálu spojené s průchodem impulsu podél membrány svalové nebo nervové buňky) dosažení kosterním svalu aktivuje uvolňování acetylcholinu do motoru endplates. Acetylcholin se váže na nikotinové receptory na desky, což má za následek uvolnění Na+ (sodíku) do svalových vláken, která vyvolá svalový akční potenciál. Ionty vápníku se pak uvolňují do sarkoplazmatického retikula, což vyvolává vazbu myosinu na aktin. Myosin se bude i nadále vázat a pohybovat se podél aktinových míst, což zkracuje sarkomeru, pokud je v buňce přítomen vápník. NMBA pracují na blokování tohoto procesu dvěma způsoby.
depolarizující NMBA působí jako agonisté na nikotinových receptorech.1 drží otevřené iontově řízené kanály, což vede ke svalové fascikulaci, dokud není iontový potenciál vyčerpán, a poté k paralýze.2 sukcinylcholin je jediným dostupným depolarizujícím NMBA. Nedepolarizující NMBA jsou kompetitivní antagonisté nikotinových receptorů, blokující acetylcholin na motorické koncové desce.1 tím se zabrání šíření akčního potenciálu, čímž se svalové buňky stanou necitlivými na motorické nervové impulsy. Ochrnutí svalů dochází postupně, počínaje s malým, rychle-škubnutí svaly v očích a hrtanu a postupuje na končetiny, trup, dýchacích cest, mezižeberní svaly a bránice. Obnova z neuromuskulárního zablokování nastává v opačném pořadí.2
v důsledku jejich mechanických účinků na acetylcholin vykazují NMBA mnoho vedlejších účinků. Acetylcholin hraje roli při uvolňování histaminu, muskarinové aktivaci, vagolytickém účinku a uvolňování norepinefrinu. V důsledku toho byly při jejich použití pozorovány vedlejší účinky, jako je tachykardie a bradykardie, hypertenze a hypotenze a bronchodilatace a bronchospasmus (tabulka 1).
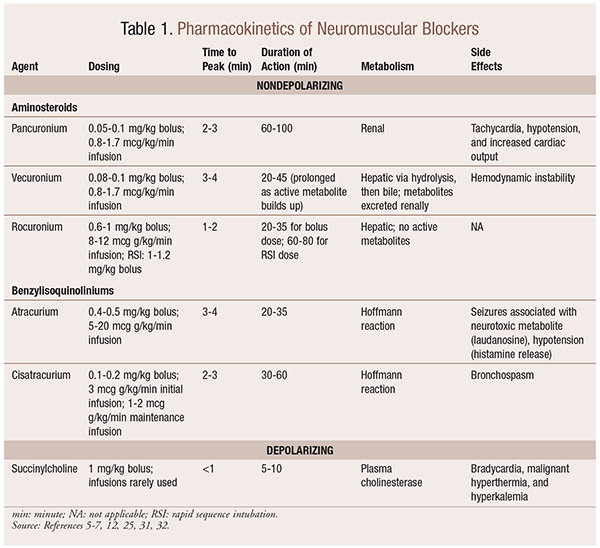
Farmakokinetika
v Závislosti na situaci, je užitečné mít různé kinetické profily k dispozici, když je NMBA je vybrán. Rychlý nástup a krátké trvání jsou užitečné pro indikace, jako je rychlá sekvenční intubace (RSI), zatímco ty s delším trváním mají v chirurgii větší hodnotu. Stručný přehled kinetických profilů včetně dávkování a častých nežádoucích účinků naleznete v tabulce 1.
Klinické Použití
Chirurgické: NMBAs byly běžné anesteziologie a chirurgie od zavedení sukcinylcholinu v 1952.3-7 volba agenta a dávkování se velmi liší v závislosti na chirurgické proceduře a také na použití alternativních látek, včetně celková anestetika, lokální anestetika, a IV sedace léky. Primární význam v chirurgické použití NMBAs je dosažení odpovídající úrovně svalové blokády bez vyvolání kardiovaskulárních nežádoucích účinků nebo prodloužení celkové doby trvání blokády mimo časový rámec chirurgický zákrok.4 ačkoli úplná diskuse o výběru agenta a dávkování pro chirurgické indikace je nad rámec tohoto článku, bude řešeno klinické zvrácení těchto účinků. Klinické monitorování pacienta, který se dostal střední – dlouhodobě působící NMBA během chirurgického zákroku by měl obsahovat periferní nervová stimulace (PNS), testování (popsáno později).1,4
RSI: RSI je naléhavý proces používaný k zajištění dýchacích cest nestabilního pacienta. Propofol, etomidát, midazolam) s téměř současným podáním NMBA. Požadovaným výsledkem je, že pacient vyvine jak amnestickou sedaci, tak hlubokou svalovou relaxaci, čímž se zlepší pravděpodobnost úspěšné intubace.8,9 výběr vhodných látek by měl být založen na farmakokinetice specifické pro danou látku a na klinických proměnných specifických pro pacienta.
ideálním prostředkem pro RSI je prostředek s rychlým nástupem i rychlým posunem, který zkracuje dobu od podání do intubace a také snižuje celkové trvání paralýzy.10 dlouhé zpoždění nástupu léku zvyšuje celkové riziko hypoxie u pacienta. Jak se doba nástupu prodlužuje, musí uplynout více času mezi posledním dechem vakem a prvními dechy dodanými endotracheální trubicí. Zvýšené trvání paralýzy zvyšuje riziko selhání intubace.10,11 Namísto rychlého zotavení viděn s sukcinylcholin, delší trvání látky jako rokuronia může vyžadovat respirační podpora pro více než 90 minut.12,
velké Cochrane review publikoval v roce 2015 ukázala, že sukcinylcholin byl lepší rokuronia s ohledem na příznivé intubační podmínky. Tato zjištění pravděpodobně odrážejí příznivý kinetický profil sukcinylcholinu.13 v klinické praxi však existuje několik důležitých kontraindikací pro použití sukcinylcholinu. U pacientů s anamnézou maligní hypertermie nebo u pacientů s vysokým rizikem vzniku hyperkalemie zůstává rokuronium životaschopným činidlem RSI.
Kritické
Syndrom Akutní Respirační Tísně (ARDS): Jedním z hlavních klinických problémů pro pacienty, kteří rozvoji ARDS je snížit tlak a stres na plicích, čímž se snižuje další zánět nad rámec původní poškodit nebo urazit. Vzhledem k jejich účinkům na membránový tón byly NMBA navrženy jako metoda pro snížení asynchronie ventilátoru a plicních tlaků. V angličtině byly publikovány tři primární studie, které hodnotily použití NMBA v rané fázi ARDS.14-16 každá studie prokázala zvýšenou okysličení u pacientů léčených brzy 48hodinovou kontinuální infuzí cisatrakuria. Metaanalýza shromážděných údajů z těchto studií z roku 2013 ukázala, že včasné podání cisatrakuria vedlo ke snížení barotrauma (P = .02) a snížená nemocniční úmrtnost (P = .005), ale nemělo žádný vliv na dobu trvání mechanické ventilace (P = .57).17
na základě těchto zjištění je rozumné zvážit NMBA pro léčbu akutních ARDS u pacientů prezentujících se na JIP.4 Zatímco mechanismus účinku u všech nedepolarizujících NMBAs by měla přispět k navrhovaný mechanismus klinický přínos v ARDS, publikovaných randomizovaných, kontrolovaných studiích používá cisatracurium pouze v intervenční skupině. Zda by jiné látky měly vliv na tyto výsledky, nebylo v literatuře řešeno.
terapeutická hypotermie: NMBA byly navrženy jako součást mnoha léčebných algoritmů pro pacienty podstupující terapeutickou hypotermii po zástavě srdce.18 řízením třesu mohou NMBA snížit celkovou spotřebu kyslíku. I když to nebylo studováno v intenzivní péči, tyto fyziologické změny byly prokázány u chirurgických pacientů podstupujících podchlazení během kardiopulmonální bypass.19,20 v retrospektivní studii u 111 pacientů, kteří podstoupili terapeutickou hypotermii (18 s NMBA vs. 93 bez), došlo ke zlepšení přežití v nemocnici (P = .004), které zůstaly významné po multivariační analýzy potenciálních základní confounders (95% CI, 1.56-33.38).21 trend ke zlepšení clearance laktátu a funkčních výsledků byl také zaznamenán u pacientů léčených kontinuálně NMBA.
Další retrospektivní studie se zabývala výběrem NMBA u pacientů podstupujících terapeutickou hypotermii po zástavě srdce.22 pomocí multivariační analýzy vědci porovnali 201 pacientů léčených terapeutickou hypotermií(29,9% s cisatrakuriem vs. 17,9% s vekuroniem). Cisatrakurium bylo jediným nezávislým pozitivním prediktorem přežití s dobrým neurologickým výsledkem (p = .014). Vzhledem k retrospektivní povaze a malé velikosti vzorku této studie, je obtížné posoudit celkový výkon odhalit případné rozdíly nabízených vekuronia podobné tomu, co bylo pozorováno s cisatracurium. Je možné, že matoucí proměnné mohou mít silnější vliv než vybrané činidlo neuroblokády na celkové výsledky.22
zvýšený intrakraniální tlak (ICP): ICP je rutinně řízen hlubokou sedací a analgezií, snižuje spotřebu kyslíku a metabolismus mozku při kontrole bolesti, pohyb, a asynchronie ventilátoru.2 přidání NMBAs je považován pouze tehdy, když hluboké sedace je nedostatečné pro kontrolu nebezpečné zvýšení ICP, často výsledkem kašel, odsávání, nebo třes.2,12 bylo prokázáno, že časné užívání NMBA vede ke snížení mortality, ale za cenu zvýšené morbidity. Hsiang a kolegy zpětně přezkoumal údaje o kohorty 514 pacientů z Traumatické Coma Data Bank k vyhodnocení používání brzy rozšířena NMBA použít versus krátkodobá NMBA použití. Pobyt na JIP byl v průměru o 3 dny delší, u více pacientů se vyvinula pneumonie a u pacientů s prodlouženou NMBA byl trend ke zvýšenému riziku sepse. Dodatečně, ačkoli ve skupině bez NMBA bylo více úmrtí, skupina NMBA měla větší výskyt vegetativních nebo těžce postižených přeživších.23 použití NMBA při zvýšené ICP vede k významným obtížím při sledování neurologických funkcí a záchvatové aktivity.24
Obrácení Agenti
i když méně časté v JIP, obrácení NMBAs je důležitou součástí chirurgické léčbě pacientů, přijímání paralytics. Historicky k tomu došlo při použití neostigminu po operaci.4 Neostigmin je inhibitor acetylcholinesterázy (ACheI), které snižuje odbourávání acetylcholinu v motoru, zavazadlového prostoru, což způsobuje zvýšení koncentrace acetylcholinu. Protože nedepolarizující NMBA jsou kompetitivními antagonisty nikotinového receptoru, neostigmin zvyšuje konkurenční tlak acetylcholinu v místě působení léčiva. Ačkoli je neostigmin účinný při zlepšování doby zotavení po podání NMBA, může být nespolehlivý kvůli nepřímému mechanismu účinku.4,25 pokud jsou koncentrace NMBA dostatečně vysoké, nelze antagonismus překonat bez ohledu na podanou dávku anticholinesterázy. Ukázalo se, že selhání úplného zvrácení NMBA po operaci zvyšuje míru zbytkové slabosti a dysfagie a riziko aspirace.4,25 kromě toho má neostigmin své vlastní vedlejší účinky působením na nikotinové i muskarinové receptory. Zatímco nikotinový receptor je blokován NMBA, účinek neostigminu na muskarinový receptor má za následek zvýšené bronchospazmy, motilitu žaludku, sekreci a bradykardii.25 Ke snížení těchto rizik, antimuskarinové agonisty jako je atropin nebo glykopyrrolát musí být používán s neostigmin k vyrovnání zvýšené muskarinové aktivace.
v prosinci 2015 FDA schválila sugammadex (Bridion), nové činidlo pro přímé obrácení rokuronia a vekuronia. Klasifikován jako gama-cyklodextrinu, sugammadex vytváří lék-lék komplex s zdarma NMBA, čímž se snižuje k dispozici agent koncentrace. Tyto farmakokinetické účinky na koncentraci NMBA jsou rychlé a úplné. Vzhledem k jejich velikosti však cisatrakurium, atrakurium a sukcinylcholin nejsou sugammadexem ovlivněny.26 primárním přínosem sugammadexu ve srovnání s neostigminem je rychlost, při které dochází ke zvratu (2 minuty vs. 17 minut).27 na Rozdíl od ACheIs, sugammadex má stropní účinek, tj. s dostatečně velkou sugammadex dávky, žádnou hloubku ochrnutí může být rychle zvrátit.26,28 a Konečně, použít sugammadex nemá žádný farmakodynamický efekt na muskarinové receptory, výrazně snižuje léky vedlejší účinek profil a vyhnout se nutnosti coadminister antimuskarinik. Dávkování sugammadexu je založeno na úrovni neuromuskulární blokády, v rozmezí od 2 mg / kg pro střední blokádu do 16 mg / kg pro okamžité zvrácení.26,28
Sedace
je velmi důležité si uvědomit, že i když NMBAs se zabránilo svalové pohyb nemají žádný dopad na pacienta úrovni vědomí nebo schopnost vnímat bolest nebo nepohodlí, což má za následek jev popsal jako neúmyslné povědomí.1 ať už pro chirurgické nebo lékařské indikace, pacienti mohou být vystaveni riziku nedostatečné sedace nebo analgezie. Série případů prokázala, že až 18% pacientů si udržuje určitý stupeň povědomí, zatímco je paralyzováno.29 tito pacienti hlásí pocity od snového stavu až po explicitní vědomí. Neexistují žádné testy poskytují konkrétní pokyny pro řízení neúmyslné povědomí během neuromuskulární blokády. Bez ohledu na to se považuje za standardní praxi stanovit a udržovat vhodné úrovně analgezie a hluboké sedace před a během neuromuskulární blokády.1
monitorování
monitorování pacientů na NMBA je nezbytné, ale metody jsou často komplikovány klinickým průběhem, současným podáváním sedativ a analgetik a dalšími terapeutickými modalitami(např. PNS je běžně považován za monitorovací metodu volby, ale má omezení. Mezi další monitorovací parametry patří spontánní dýchání a trendy vitálních funkcí.2
PNS se doporučuje Samostatně u pacientů na kontinuální infuzi NMBA a jako doplněk v jiných klinických situacích.1 zařízení vlaku ze čtyř připojené na orbicularis oculi, ulnární nerv nebo peroneální nerv dodává čtyři po sobě jdoucí elektrické podněty. Při absenci neuromuskulární blokády bude pozorována stejná reakce záškubu pro všechny čtyři podněty, což má za následek poměr T4/T1 1. U paralyzovaného pacienta by měla být pozorována reakce záškubu s prvním podnětem, ale to by se mělo snížit kvůli blokádě motorických neuronů. Cílem je dosáhnout poměru T4/T1 přibližně 0,25.1
komplikace
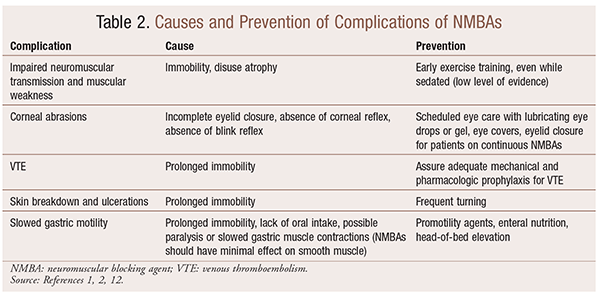
ačkoli existují významné přínosy pro použití NMBA v konkrétních situacích, existují také krátkodobé a dlouhodobé komplikace. V akutní nastavení, použití NMBAs může vést ke zvýšení JIP, mechanické větrání, žilní tromboembolie, kůže trhá a ulcerace, infekce, poškození rohovky, a anafylaxe. Dlouhodobé podávání může vést k nehybnosti nebo zvýšit dobu zotavení z důvodu poruchy nervosvalového přenosu a svalová slabost.30 několik doporučení pro prevenci těchto účinků je uvedeno v tabulce 2.
Závěr
lékárník může hrát velmi důležitou roli v regulaci a použití NMBAs napříč širokou škálou klinických-praxe stránek. Tím, pochopení, mechanismus účinku, terapeutické indikace, podpora literatury a klinické nežádoucí účinky této high-alert třída léků, lékárník může mít neocenitelný vliv na péči o pacienta a bezpečí pacienta.
1. Murray MJ, DeBlock H, Erstad B, et al. Pokyny pro klinickou praxi pro trvalou neuromuskulární blokádu u dospělého kriticky nemocného pacienta. Crit Care Med. 2016;44:2079-2103.
2. Warr J, Thiboutot Z, Rose L, et al. Současná terapeutická použití, farmakologie a klinické úvahy neuromuskulárních blokátorů pro kriticky nemocné dospělé. Annina. 2011;45:1116-1126.
3. Foldes FF, McNall PG, Borrego-Hinojosa JM. Sukcinylcholin: nový přístup k svalové relaxaci v anesteziologii. N Engl J Med. 1952;247:596-600.
4. Naguib M, Lien CA. Farmakologie svalových relaxancií a jejich antagonistů. V: Millerova anestezie. 7.vydání. Miller RD, Eriksson LI, Fleisher LA, et al, eds. Philadelphia, PA: Churchill Livingstone; 2010.
5. Anektin (sukcinylcholin) příbalová informace. Princeton, NJ: Sandoz Inc; září 2010.
6. Rokuronium příbalová informace. Irvine, CA: Teva Parenteral Medicines, Inc; listopad 2008.
7. Nimbex (cisatrakurium) příbalová informace. Severní Chicago, IL: Abbott Laboratories; 2010.
8. Sakles JC, Laurin EG, Rantapaa AA, panáček EA. Řízení dýchacích cest na pohotovostním oddělení; jednoletá studie 610 tracheálních intubací. Ann Emergová. 1998;31:325-332.
9. Tayal VS, Riggs RW, Marx JA, et al. Rychlá sekvenční intubace v rezidenci urgentní medicíny: úspěšnost a nežádoucí účinky během dvouletého období. Acad Emerged. 1999;6:31-37.
10. Li J, Murphy-Lavoie H, Bugas C, et al. Komplikace nouzové intubace s paralýzou a bez ní. Am J Emerg Med. 1999;17:141-143.
11. Naguib M, Samarkandi AH, El-Din ME, et al. Dávka sukcinylcholinu potřebná pro vynikající endotracheální intubační podmínky. Anesth Analg. 2006;102:151-155.
12. Greenberg SB, Vender J. použití neuromuskulárních blokátorů na JIP: kde jsme teď? Crit Care Med. 2013;41:1332-1344.
13. Tran DT, Newton EK, Mount VA, et al. Rokuronium versus sukcinylcholin pro rychlou sekvenční indukční intubaci. Cochrane Database Syst Rev. 2015; (10): CD002788.
14. Gainnier M, Roch A, Forel JM, et al. Účinek neuromuskulárních blokátorů na výměnu plynů u pacientů se syndromem akutní respirační tísně. Crit Care Med. 2004;32:113-119.
15. Forel JM, Roch A, Marin V, et al. Neuromuskulární blokátory snižují zánětlivou odpověď u pacientů se syndromem akutní respirační tísně. Crit Care Med. 2006;34:2749-2757.
16. Papazian L, Forel JM, Gacouin A, et al. Neuromuskulární blokátory u syndromu časné akutní respirační tísně. N Engl J Med. 2010;363:1107-1116.
17. Alhazzani W, Alshahrani M, Jaeschke R, et al. Neuromuskulární blokátory u syndromu akutní respirační tísně: systémový přehled a metaanalýza randomizovaných kontrolovaných studií. Crit Care. 2013; 17: R43.
18. Chamorro C, Borrallo JM, Romera MA, et al. Protokol anestezie a analgezie během terapeutické hypotermie po zástavě srdce: systematický přehled. Anesth Analg. 2010;110:1328-1335.
19. Cruise C, MacKinnon J, Tough J, Houston P. srovnání meperidinu a pankuronia pro léčbu třesu po operaci srdce. Can J Anaesth. 1992;39:563-568.
20. Sladen RN, Berend JZ, Fassero JS, et al. Srovnání vekuronia a meperidin na klinické a metabolické účinky chvění po podchlazení kardiopulmonální bypass. J. Kardiothorac Vasc Anesth. 1995;9:147-153.
21. Salciccioli JD, Cocchi MN, Rittenberger JC, et al. Kontinuální neuromuskulární blokáda je spojena se sníženou mortalitou u pacientů po zástavě srdce. Resuscitace. 2013;84:1728-1733.
22. Baker WL, Geronila G, Kallur R, et al. Účinek neuromuskulárních blokátorů na výsledky u pacientů léčených terapeutickou hypotermií po zástavě srdce. Analg Resusc Curr Res.2013;S1.
23. Hsiang JK, Chesnut RM, Crisp CB, et al. Včasná rutinní paralýza pro kontrolu intrakraniálního tlaku při těžkém poranění hlavy: je to nutné? Crit Care Med. 1994;22:1471-1476.
24. Rangel-Castilla L, Gopinath S, Robertson CS. Léčba intrakraniální hypertenze. Neurol Clin. 2008;26:521-541.
25. Caldwell JE. Klinická omezení antagonistů acetylcholinesterázy. J Crit Péče. 2009;24:21-28.
26. Bridion (sugammadex) package insert. Whitehouse Station, NJ: Merck & Co, Inc; July 2015.
27. Sacan O, White PF, Tufanogullari B, Klein K. Sugammadex reversal of rocuronium-induced neuromuscular blockade: a comparison with neostigmine-glycopyrrolate and edrophonium-atropine. Anesth Analg. 2007;10:569-574.
28. Meistelman C, Donati F. Do we really need sugammadex as an antagonist of muscle relaxants in anesthesia? Curr Opin Anaesthesiol. 2016;29:462-467.
29. Arnot-Smith J, Smith AF. Patient safety incidents involving neuromuscular blockade: analýza údajů britského národního systému výkaznictví a učení v letech 2006 až 2008. Anestezie. 2010;65:1106-1113.
30. Cena DR, Mikkelsen ME, Umscheid CA, Armstrong EJ. Neuromuskulární blokátory a neuromuskulární dysfunkce získané při kritickém onemocnění: systematický přehled a metaanalýza. Crit Care Med. 2016;44:2070-2078.
31. Prielipp RC, Coursin DB, Scuderi PE, et al. Porovnání požadavků na infuzi a rekonvalescenčních profilů vekuronia a cisatrakuria 51W89 u pacientů na jednotce intenzivní péče. Anesth Analg. 1995;81:3-12.
32. Sparr HJ, Wierda JM, Proost JH, et al. Farmakodynamika a farmakokinetika rokuronia u pacientů na jednotce intenzivní péče. Br J Anaesth. 1997;78:267-273.