US Pharm. 2017; 42(1): HS16-HS20.
RÉSUMÉ: Les agents de blocage neuromusculaire (ANMN) jouent un rôle important dans la prise en charge d’un grand nombre de patients hospitalisés. La pharmacologie des ANMN est bien comprise, mais l’utilisation de ces agents peut être controversée. Les ANMN sont fréquents dans les situations chirurgicales et l’intubation séquentielle rapide, mais d’autres indications, telles que le syndrome de détresse respiratoire aiguë, l’hypothermie thérapeutique et l’élévation de la pression intracrânienne, sont quelque peu clivantes. Il est essentiel que les pharmaciens connaissent les implications cliniques et les résultats associés à l’utilisation des ANMN. De plus, il est important de comprendre des considérations concomitantes telles que la sédation, la surveillance et l’inversion. Les pharmaciens en milieu hospitalier doivent connaître le nouveau sugammadex (Bridion), un agent d’inversion directe récemment approuvé.
Les agents de blocage neuromusculaire (ANMN) jouent un rôle important dans la prise en charge d’un grand nombre de patients hospitalisés. En plus de leur utilisation de routine en anesthésie chirurgicale, les ANMN peuvent être utiles dans de nombreuses situations de soins intensifs nouvelles et évolutives. Par conséquent, il est essentiel que le pharmacien hospitalier se familiarise avec les implications cliniques et les résultats associés à l’utilisation et à l’inversion de la NMBA.
Pharmacologie
Les ANMN exercent leurs effets pharmacologiques en modulant la transmission du signal dans le muscle squelettique. Les potentiels d’action (changements du potentiel électrique associés au passage d’une impulsion le long de la membrane d’un muscle ou d’une cellule nerveuse) atteignant le muscle squelettique activent la libération d’acétylcholine dans les plaques terminales motrices. L’acétylcholine se lie aux récepteurs nicotiniques au niveau de la plaque terminale, ce qui entraîne la libération de Na + (sodium) dans les fibres musculaires, ce qui déclenche le potentiel d’action musculaire. Les ions calcium sont ensuite libérés dans le réticulum sarcoplasmique, provoquant la liaison de la myosine à l’actine. La myosine continuera à se lier et à se déplacer le long des sites d’actine, raccourcissant le sarcomère, tant que le calcium est présent dans la cellule. Les ANM fonctionnent de deux manières pour bloquer ce processus.
Les ANM dépolarisants agissent en tant qu’agonistes au niveau des récepteurs nicotiniques.1 Ils maintiennent ouverts les canaux ioniques, conduisant à une fasciculation musculaire jusqu’à épuisement du potentiel ionique, puis à une paralysie.2 La succinylcholine est le seul NMBA dépolarisant disponible. Les ANM non dépolarisants sont des antagonistes compétitifs au niveau des récepteurs nicotiniques, bloquant l’acétylcholine au niveau de la plaque terminale du moteur.1 Cela empêche le potentiel d’action de se propager, rendant ainsi les cellules musculaires insensibles à l’influx nerveux moteur. La paralysie musculaire se produit de manière séquentielle, en commençant par de petits muscles à contraction rapide dans les yeux et le larynx et en progressant vers les membres, le tronc, les voies respiratoires, les muscles intercostaux et le diaphragme. La récupération du blocage neuromusculaire se produit dans l’ordre inverse.2
En raison de leurs effets mécanistes sur l’acétylcholine, les ANMN présentent de nombreux effets secondaires. L’acétylcholine joue un rôle dans la libération d’histamine, l’activation muscarinique, l’action vagolytique et la libération de noradrénaline. En conséquence, des effets secondaires tels que tachycardie et bradycardie, hypertension et hypotension, bronchodilatation et bronchospasme ont été observés lors de leur utilisation (TABLEAU 1).
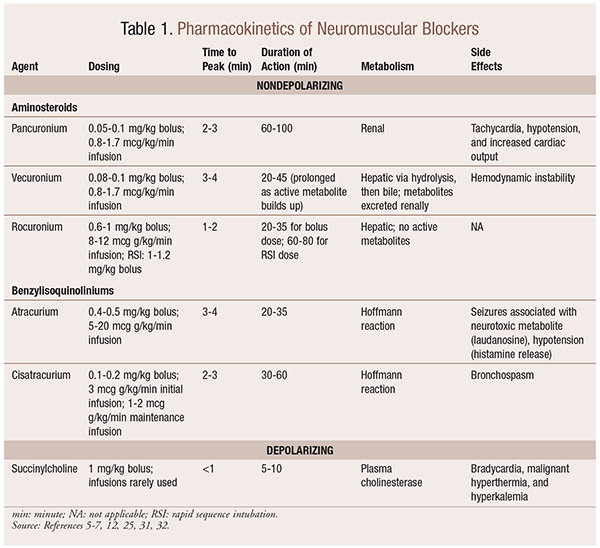
Pharmacocinétique
Selon la situation, il est utile d’avoir une variété de profils cinétiques disponibles lorsqu’un NMBA est sélectionné. L’apparition rapide et la courte durée sont utiles pour des indications telles que l’intubation séquentielle rapide (RSI), tandis que celles d’une durée plus longue sont plus utiles en chirurgie. Voir le TABLEAU 1 pour un bref aperçu des profils cinétiques, y compris la posologie et les effets indésirables courants.
Utilisation clinique
Chirurgicale: Les ANMN sont un aliment de base de l’anesthésiologie et de la chirurgie depuis l’introduction de la succinylcholine en 1952.3-7 Le choix de l’agent et de la posologie varie considérablement en fonction de l’intervention chirurgicale et de l’utilisation d’agents alternatifs, y compris les anesthésiques généraux, les anesthésiques locaux et les médicaments de sédation intraveineuse. La principale préoccupation dans l’utilisation chirurgicale des ANMN est d’atteindre des niveaux appropriés de blocage musculaire sans induire d’effets secondaires cardiovasculaires ni allonger la durée totale du blocage au-delà de la période de l’intervention chirurgicale.4 Bien qu’une discussion complète de la sélection de l’agent et de la posologie pour les indications chirurgicales dépasse le cadre de cet article, l’inversion clinique de ces effets sera abordée. La surveillance clinique d’un patient qui a reçu un NMBA à action intermédiaire à longue au cours d’une intervention chirurgicale doit inclure un test de stimulation nerveuse périphérique (SNP) (discuté plus loin).1,4
RSI: Le RSI est un processus émergent utilisé pour sécuriser les voies respiratoires d’un patient instable. Les protocoles RSI impliquent l’administration d’un agent d’induction de sédation profonde (par exemple, propofol, étomidate, midazolam) avec l’administration quasi simultanée d’un NMBA. Le résultat souhaité est que le patient développe à la fois une sédation amnésique et une relaxation musculaire profonde, améliorant ainsi la probabilité d’une intubation réussie.8,9 La sélection des agents appropriés doit être basée sur la pharmacocinétique spécifique à l’agent et les variables cliniques spécifiques au patient.
Un agent idéal pour le RSI est celui avec à la fois un début rapide et un décalage rapide, ce qui diminue le temps entre l’administration et l’intubation et réduit également la durée globale de la paralysie.10 Un long retard dans l’apparition du médicament augmente le risque global d’hypoxie pour le patient. À mesure que le temps d’apparition s’allonge, plus de temps doit s’écouler entre la dernière respiration via le sac et les premières respirations délivrées via le tube endotrachéal. L’augmentation de la durée de la paralysie augmente le risque d’échec de l’intubation.10,11 Au lieu de la récupération rapide observée avec la succinylcholine, des agents de plus longue durée tels que le rocuronium peuvent nécessiter une assistance respiratoire pendant plus de 90 minutes.12
Une vaste revue Cochrane publiée en 2015 a démontré que la succinylcholine était supérieure au rocuronium en ce qui concerne les conditions d’intubation favorables. Ces résultats reflètent probablement le profil cinétique favorable de la succinylcholine.13 Cependant, plusieurs contre-indications importantes à l’utilisation de la succinylcholine existent dans la pratique clinique. Chez les patients ayant des antécédents d’hyperthermie maligne ou chez ceux à haut risque de développer une hyperkaliémie, le rocuronium reste un agent RSI viable.
Soins intensifs
Syndrome de détresse respiratoire aiguë (SDRA): L’une des principales préoccupations cliniques des patients qui développent un SDRA est de réduire la pression et le stress sur les poumons, réduisant ainsi l’inflammation supplémentaire au-delà des dommages initiaux ou de l’insulte. En raison de leurs effets sur le tonus diaphragmatique, les ANMN ont été suggérées comme méthode pour diminuer l’asynchronie du ventilateur et les pressions pulmonaires. Trois études primaires ont été publiées en anglais qui ont évalué l’utilisation des ANMN dans la phase précoce du SDRA.14-16 Chaque étude a montré une oxygénation accrue chez les patients traités précocement par une perfusion continue de cisatracurium de 48 heures. Une méta-analyse de 2013 des données regroupées de ces études a montré que l’administration précoce de cisatracurium entraînait une réduction du barotraumatisme (P =.02) et une diminution de la mortalité hospitalière (P =.005), mais n’a eu aucun effet sur la durée de la ventilation mécanique (P =.57).17
Sur la base de ces résultats, il est raisonnable d’envisager des ANMN pour le traitement du SDRA aigu chez les patients se présentant à l’USI.4 Alors que le mécanisme d’action de tous les ANM non dépolarisants devrait contribuer au mécanisme de bénéfice clinique proposé dans les SDRA, des essais randomisés et contrôlés publiés ont utilisé le cisatracurium uniquement dans le groupe interventionnel. La question de savoir si d’autres agents auraient un effet sur ces résultats n’a pas été abordée dans la littérature.
Hypothermie thérapeutique: Les ANMN ont été proposés dans le cadre de nombreux algorithmes de traitement pour les patients subissant une hypothermie thérapeutique après un arrêt cardiaque.18 En contrôlant les frissons, les ANMN peuvent diminuer la consommation totale d’oxygène. Bien que cela n’ait pas été étudié en soins intensifs, ces changements physiologiques ont été démontrés chez des patients chirurgicaux subissant une hypothermie lors d’un pontage cardiopulmonaire.19,20 Dans une étude rétrospective de 111 patients ayant subi une hypothermie thérapeutique (18 avec NMBA contre 93 sans), il y a eu une amélioration de la survie à l’hôpital (P =.004) qui sont restées significatives après analyse multivariée des facteurs de confusion potentiels de base (IC à 95 %, 1,56-33,38).21 Une tendance à l’amélioration de la clairance du lactate et des résultats fonctionnels a également été notée chez les patients recevant une NMBA continue.
Une autre étude rétrospective a porté sur la sélection des ANMN chez les patients subissant une hypothermie thérapeutique après un arrêt cardiaque.22 À l’aide d’une analyse multivariée, les chercheurs ont comparé 201 patients recevant une hypothermie thérapeutique (29,9% avec le cisatracurium contre 17,9% avec le vecuronium). Le cisatracurium était le seul prédicteur positif indépendant de la survie avec un bon résultat neurologique (P =.014). En raison de la nature rétrospective et de la petite taille de l’échantillon de cette étude, il est difficile d’évaluer le pouvoir global de détecter une différence offerte par le vecuronium similaire à ce qui a été observé avec le cisatracurium. Il est possible que les variables confusionnelles aient une influence plus forte que l’agent de neuroblockade sélectionné sur les résultats globaux.22
Pression Intracrânienne élevée (PIC): La PCI est systématiquement gérée par sédation profonde et analgésie, réduisant la consommation d’oxygène et le métabolisme cérébral tout en contrôlant la douleur, le mouvement et l’asynchronie du ventilateur.2 L’ajout d’ANMN n’est envisagé que lorsque la sédation profonde est insuffisante pour contrôler les augmentations dangereuses de la PCI, souvent dues à la toux, à l’aspiration ou aux frissons.2,12 Il a été démontré que l’utilisation précoce de NMBA entraînait une diminution de la mortalité, mais au prix d’une morbidité accrue. Hsiang et ses collègues ont examiné rétrospectivement les données d’une cohorte de 514 patients de la Banque de données sur le coma traumatique pour évaluer l’utilisation d’une utilisation prolongée précoce de NMBA par rapport à une utilisation de courte durée de NMBA. Le séjour en USI était en moyenne de 3 jours de plus, un plus grand nombre de patients ont développé une pneumonie et il y avait une tendance à un risque accru de septicémie chez les patients atteints de NMBA prolongée. De plus, bien qu’il y ait eu plus de décès dans le groupe non NMBA, le groupe NMBA avait une plus grande incidence de survivants végétatifs ou gravement handicapés.23 L’utilisation des ANMN dans l’augmentation de la PCI entraîne des difficultés importantes dans la surveillance de la fonction neurologique et de l’activité épileptique.24
Agents d’inversion
Bien que rare en USI, l’inversion des ANMN est une partie importante de la prise en charge chirurgicale des patients paralysés. Historiquement, cela s’est produit grâce à l’utilisation de la néostigmine en postopératoire.4 La néostigmine est un inhibiteur de l’acétylcholinestérase (ACheI) qui réduit la dégradation de l’acétylcholine dans la plaque d’extrémité du moteur, entraînant une augmentation de la concentration d’acétylcholine. Étant donné que les ANM non dépolarisants sont des antagonistes compétitifs du récepteur nicotinique, la néostigmine augmente la pression concurrentielle de l’acétylcholine au site d’action du médicament. Bien que la néostigmine soit efficace pour améliorer les temps de récupération après l’administration de NMBA, elle peut être peu fiable en raison de son mécanisme d’action indirect.4,25 Si les concentrations de NMBA sont suffisamment élevées, l’antagonisme ne peut être surmonté quelle que soit la dose d’anticholinestérase administrée. Il a été démontré que l’échec de l’inversion complète des ANMN postopératoires augmentait les taux de faiblesse résiduelle et de dysphagie et le risque d’aspiration.4,25 De plus, la néostigmine a ses propres effets secondaires par son action à la fois sur les récepteurs nicotiniques et muscariniques. Alors que le récepteur nicotinique est bloqué par le NMBA, l’effet de la néostigmine sur le récepteur muscarinique entraîne une augmentation des bronchospasmes, de la motilité gastrique, des sécrétions et de la bradycardie.25 Pour réduire ces risques, un agoniste antimuscarinique tel que l’atropine ou le glycopyrrolate doit être utilisé avec la néostigmine pour compenser l’activation muscarinique accrue.
En décembre 2015, la FDA a approuvé le sugammadex (Bridion), un nouvel agent d’inversion directe du rocuronium et du vecuronium. Classé comme gamma-cyclodextrine, le sugammadex crée un complexe médicamenteux avec du NMBA libre, réduisant ainsi les concentrations d’agents disponibles. Ces effets pharmacocinétiques sur la concentration en NMBA sont à la fois rapides et complets. Cependant, en raison de leur taille, le cisatracurium, l’atracurium et la succinylcholine ne sont pas affectés par le sugammadex.26 Le principal avantage du sugammadex, comparé à la néostigmine, est la vitesse à laquelle l’inversion se produit (2 minutes contre 17 minutes).27 Contrairement à ACheIs, le sugammadex n’a pas d’effet de plafond; c’est-à-dire qu’avec une dose de sugammadex suffisamment importante, toute profondeur de paralysie peut être rapidement inversée.26,28 Enfin, l’utilisation de sugammadex n’a aucun effet pharmacodynamique sur les récepteurs muscariniques, diminuant considérablement le profil d’effets secondaires du médicament et évitant la nécessité de coadministrer des agents antimuscariniques. Le dosage de sugammadex est basé sur le niveau de blocage neuromusculaire, allant de 2 mg / kg pour un blocage modéré à 16 mg / kg pour une inversion immédiate.26,28
Sédation
Il est extrêmement important de reconnaître que bien que les ANMN empêchent les mouvements musculaires, elles n’ont aucun effet sur le niveau de conscience ou la capacité du patient à percevoir la douleur ou l’inconfort, ce qui entraîne un phénomène décrit comme une conscience involontaire.1 Que ce soit pour des indications chirurgicales ou médicales, les patients peuvent présenter un risque de sédation ou d’analgésie insuffisante. Une série de cas a démontré que jusqu’à 18% des patients maintiennent un certain degré de conscience lorsqu’ils sont paralysés.29 Ces patients rapportent des sensations allant d’un état onirique à une conscience explicite. Il n’y a pas d’essais fournissant des conseils spécifiques sur la gestion de la conscience involontaire pendant le blocage neuromusculaire. Quoi qu’il en soit, il est considéré comme une pratique courante d’établir et de maintenir des niveaux appropriés d’analgésie et de sédation profonde avant et pendant le blocage neuromusculaire.1
Surveillance
La surveillance des patients sous AMNC est impérative, mais les méthodes sont souvent compliquées par l’évolution clinique, la coadministration de sédatifs et d’analgésiques et des modalités thérapeutiques supplémentaires (par exemple, hypothermie thérapeutique). La SNP est généralement considérée comme la méthode de surveillance de choix, mais elle a des limites. Les paramètres de surveillance supplémentaires incluent la respiration spontanée et les tendances des signes vitaux.2
Le SNP est recommandé indépendamment chez les patients sous perfusion continue d’ANMN et en complément dans d’autres situations cliniques.1 Un dispositif en train de quatre fixé au niveau des orbiculaires, du nerf ulnaire ou du nerf péronier délivre quatre stimuli électriques successifs. En l’absence de blocage neuromusculaire, une réponse de contraction égale sera observée pour les quatre stimuli, ce qui donne un rapport T4 / T1 de 1. Chez un patient paralysé, la réponse à la contraction doit être observée avec le premier stimulus, mais cela devrait diminuer en raison du blocage des motoneurones. L’objectif est d’atteindre un ratio T4/T1 d’environ 0,25.1
Complications
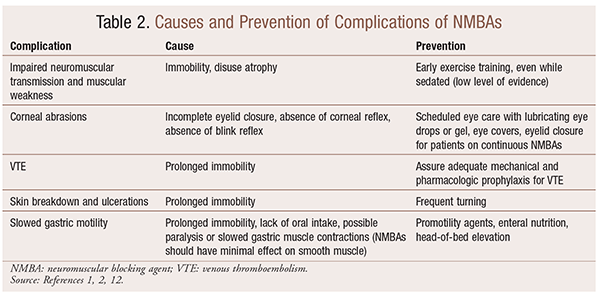
Bien qu’il existe des avantages significatifs à l’utilisation des ANMN dans des situations particulières, il existe également des complications à court et à long terme. Dans le cadre aigu, l’utilisation d’ANMBA peut entraîner une augmentation du séjour aux soins intensifs, une ventilation mécanique prolongée, une thromboembolie veineuse, des déchirures et des ulcérations cutanées, une infection, des lésions cornéennes et une anaphylaxie. L’administration à long terme peut entraîner une immobilité ou une augmentation du temps de récupération en raison d’une altération de la transmission neuromusculaire et d’une faiblesse musculaire.30 Plusieurs recommandations pour prévenir ces effets sont présentées dans le TABLEAU 2.
Conclusion
Le pharmacien peut jouer un rôle très important dans la réglementation et l’utilisation des ANMN dans un large éventail de sites de pratique clinique. En comprenant le mécanisme d’action, les indications thérapeutiques, la documentation à l’appui et les effets secondaires cliniques de cette classe de médicaments hautement alertes, le pharmacien peut avoir un effet inestimable sur les soins et la sécurité des patients.
1. Murray MJ, DeBlock H, Erstad B, et coll. Clinical practice guidelines for sustained neuromuscular blockade in the adult critically ill patient. Soins Critiques Med. 2016;44:2079-2103.
2. Warr J, Thiboutot Z, Rose L, et coll. Utilisations thérapeutiques actuelles, pharmacologie et considérations cliniques des agents de blocage neuromusculaire chez les adultes gravement malades. Ann Pharmacother. 2011;45:1116-1126.
3. Foldes FF, McNall PG, Borrego-Hinojosa JM. Succinylcholine: une nouvelle approche de la relaxation musculaire en anesthésiologie. En anglais J Med. 1952;247:596-600.
4. Naguib M, Lien CA. Pharmacologie des myorelaxants et de leurs antagonistes. Dans: L’anesthésie de Miller. 7e éd. Miller RD, Eriksson LI, Fleisher LA, et coll., dir. Philadelphie, Pennsylvanie : Churchill Livingstone; 2010.
5. Notice d’emballage d’anectine (succinylcholine). Il y a des gens qui ont des problèmes de santé et qui ont des problèmes de santé.
6. Notice d’emballage en rocuronium. Irvine, CA: Teva Parenteral Medicines, Inc; Novembre 2008.
7. Notice de Nimbex (cisatracurium). Les laboratoires Abbott; 2010.
8. Sakles JC, Laurin EG, Rantapaa AA, Panacek EA. Gestion des voies respiratoires au service des urgences; une étude d’un an sur 610 intubations trachéales. Ann Emerg Med. 1998;31:325-332.
9. Tayal VS, Riggs RW, Marx JA, et al. Intubation à séquence rapide en résidence en médecine d’urgence : taux de réussite et effets indésirables sur une période de deux ans. Acad Emerg Med. 1999;6:31-37.
10. Li J, Murphy-Lavoie H, Bugas C, et coll. Complications de l’intubation d’urgence avec et sans paralysie. Am J Emerg Med. 1999;17:141-143.
11. Naguib M, Samarkandi AH, El-Din ME, et al. La dose de succinylcholine requise pour d’excellentes conditions d’intubation endotrachéale. Analgésique anesthésique. 2006;102:151-155.
12. Greenberg SB, Vender J. L’utilisation d’agents de blocage neuromusculaire en USI: où en sommes-nous maintenant ? Soins Critiques Med. 2013;41:1332-1344.
13. Tran DT, Newton EK, Mont VA, et al. Rocuronium versus succinylcholine pour une intubation rapide par induction de séquence. Système de base de données Cochrane Rév. 2015; (10): CD002788.
14. Gainnier M, Roch A, Forel JM, et coll. Effect of neuromuscular blocking agents on gas exchange in patients presenting with acute respiratory distress syndrome. Soins Critiques Med. 2004;32:113-119.
15. Forel JM, Roch A, Marin V et coll. Les agents de blocage neuromusculaire diminuent la réponse inflammatoire chez les patients présentant un syndrome de détresse respiratoire aiguë. Soins Critiques Med. 2006;34:2749-2757.
16. Papazian L, Forel JM, Gacouin A, et al. Bloqueurs neuromusculaires dans le syndrome de détresse respiratoire aiguë précoce. En anglais J Med. 2010;363:1107-1116.
17. Alhazzani W, Alshahrani M, Jaeschke R, et al. Neuromuscular blocking agents in acute respiratory distress syndrome: a systemic review and meta-analysis of randomized controlled trials. Soins critiques. 2013; 17: R43.
18. Chamorro C, Borrallo JM, Romera MA, et al. Protocole d’anesthésie et d’analgésie pendant l’hypothermie thérapeutique après un arrêt cardiaque: une revue systématique. Analgésique anesthésique. 2010;110:1328-1335.
19. Cruise C, MacKinnon J, Tough J, Houston P. Comparaison de la mépéridine et du pancuronium pour le traitement des frissons après une chirurgie cardiaque. Je peux anesthésier. 1992;39:563-568.
20. Sladen RN, Berend JZ, Fassero JS, et al. Comparaison du vecuronium et de la mépéridine sur les effets cliniques et métaboliques du frisson après un pontage cardiopulmonaire hypothermique. J Cardiothorac Vasc Anesthésique. 1995;9:147-153.
21. Salciccioli JD, Cocchi MN, Rittenberger JC, et al. Le blocage neuromusculaire continu est associé à une diminution de la mortalité chez les patients post-arrêt cardiaque. Réanimation. 2013;84:1728-1733.
22. Baker WL, Geronila G, Kallur R, et coll. Effect of neuromuscular blockers on outcomes in patients receiving therapeutic hypothermia following cardiac arrest. Res. 2013; S1.
23. Hsiang JK, Chesnut RM, Crisp CB, et al. Paralysie précoce et de routine pour le contrôle de la pression intracrânienne en cas de blessure grave à la tête: est-ce nécessaire? Soins Critiques Med. 1994;22:1471-1476.
24. Rangel- Castilla L , Gopinath S, Robertson CS. Prise en charge de l’hypertension intracrânienne. Neurol Clin. 2008;26:521-541.
25. Caldwell JE. Limites cliniques des antagonistes de l’acétylcholinestérase. J Soins Critiques. 2009;24:21-28.
26. Bridion (sugammadex) package insert. Whitehouse Station, NJ: Merck & Co, Inc; July 2015.
27. Sacan O, White PF, Tufanogullari B, Klein K. Sugammadex reversal of rocuronium-induced neuromuscular blockade: a comparison with neostigmine-glycopyrrolate and edrophonium-atropine. Anesth Analg. 2007;10:569-574.
28. Meistelman C, Donati F. Do we really need sugammadex as an antagonist of muscle relaxants in anesthesia? Curr Opin Anaesthesiol. 2016;29:462-467.
29. Arnot-Smith J, Smith AF. Patient safety incidents involving neuromuscular blockade: analyse des données du Système national de Reporting et d’apprentissage du Royaume-Uni de 2006 à 2008. Anesthésie. 2010;65:1106-1113.
30. Prix DR, Mikkelsen ME, Umscheid CA, Armstrong EJ. Neuromuscular blocking agents and neuromuscular dysfunction acquired in critical illness: a systematic review and meta-analysis. Soins Critiques Med. 2016;44:2070-2078.
31. Prielipp RC, Coursin DB, Scuderi PE, et al. Comparaison des besoins en perfusion et des profils de récupération du vecuronium et du cisatracurium 51W89 chez les patients des unités de soins intensifs. Analgésique anesthésique. 1995;81:3-12.
32. Sparr HJ, Wierda JM, Proost JH, et coll. Pharmacodynamique et pharmacocinétique du rocuronium chez les patients en soins intensifs. Br J Anaesth. 1997;78:267-273.