US Pharm. 2017; 42 (1): HS16-HS20.
SAMMENDRAG: Nevromuskulære blokkerende midler (NMBAs) spiller en viktig rolle i behandlingen av et stort antall sykehuspasienter. Farmakologien Til NMBAs er godt forstått, men bruken av disse midlene kan være kontroversiell. NMBAs er vanlig i kirurgiske situasjoner og rask sekvensintubasjon, men andre indikasjoner, som akutt respiratorisk nødsyndrom, terapeutisk hypotermi og forhøyet intrakranielt trykk, er noe splittende. Det er viktig for farmasøyter å være kjent med kliniske implikasjoner og utfall knyttet Til Bruk Av NMBAs. I tillegg er det viktig å forstå samtidige hensyn som sedasjon, overvåking og reversering. Farmasøyter i sykehus bør være kjent med den nylig godkjente romanen direkte reversering agent sugammadex (Bridion).
Neuromuskulære blokkerende midler (NMBAs) spiller en viktig rolle i styringen av et stort antall sykehuspasienter. I tillegg til rutinemessig bruk i kirurgisk anestesi, Kan NMBAs være verdifullt i mange nye og utviklende kritiske omsorgssituasjoner. Derfor er det viktig for sykehusfarmasøyten å bli kjent med de kliniske implikasjonene og utfallene forbundet MED NMBA-bruk og reversering.
Farmakologi
Nmbaer utøver sine farmakologiske effekter ved å modulere signaloverføring i skjelettmuskulatur. Handlingspotensialer (endringer i elektrisk potensial assosiert med passering av en impuls langs membranen til en muskel eller nervecelle) som når skjelettmuskulatur aktiverer frigivelsen av acetylkolin i motorens endeplater. Acetylkolin binder seg til nikotinreseptorer på endeplaten, noe Som resulterer I frigjøring Av Na + (natrium) i muskelfibre, noe som utløser muskelvirkningspotensialet. Kalsiumioner frigjøres deretter i sarkoplasmatisk retikulum, noe som provoserer bindingen av myosin til aktin. Myosin vil fortsette å binde og bevege seg langs aktinsteder, forkorte sarkomeren, så lenge kalsium er tilstede i cellen. NMBAs jobber på to måter for å blokkere denne prosessen.
Depolariserende NMBAs virker som agonister ved nikotinreseptorer.1 de holder åpne ion-gated kanaler, fører til muskel fasciculation til ion potensialet er oppbrukt, og deretter til lammelse.2 Succinylkolin er den eneste depolariserende NMBA tilgjengelig. Nondepolariserende Nmbaer er konkurrerende antagonister ved nikotinreseptorer, som blokkerer acetylkolin ved motorens endeplate.1 dette forhindrer handlingspotensialet i å spre seg, og derved gjør muskelceller ufølsomme for motoriske nerveimpulser. Muskellammelse oppstår sekvensielt, begynner med små, raske muskler i øynene og strupehodet og utvikler seg til lemmer, trunk, luftveier, intercostal muskler og membran. Gjenoppretting fra nevromuskulær blokkering skjer i omvendt rekkefølge.2
Som et resultat av deres mekanistiske effekter på acetylkolin, Viser NMBAs mange bivirkninger. Acetylkolin spiller en rolle i histaminfrigivelse, muskarinaktivering, vagolytisk virkning og frigjøring av norepinefrin. Som et resultat har bivirkninger som takykardi og bradykardi, hypertensjon og hypotensjon, samt bronkodilatasjon og bronkospasme blitt sett ved bruk av disse (TABELL 1).
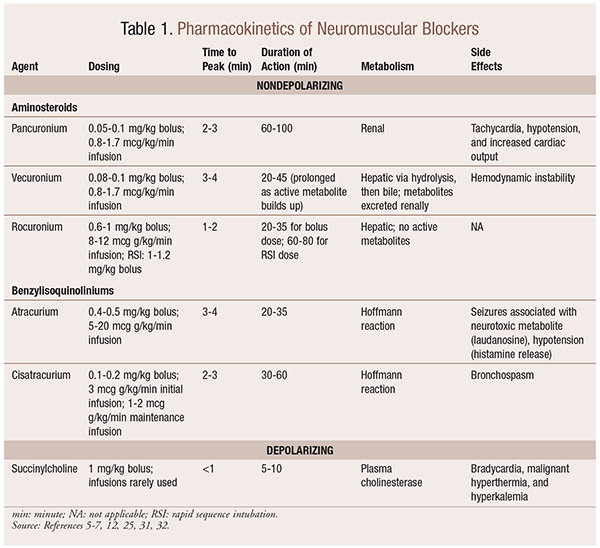
Farmakokinetikk
Avhengig av situasjonen er det nyttig å ha en rekke kinetiske profiler tilgjengelig når EN NMBA velges. Rask innsettende og kort varighet er nyttig for indikasjoner som rask sekvens intubasjon (RSI), mens de med lengre varighet er av mer verdi i kirurgi. Se TABELL 1 for en kort oversikt over kinetiske profiler, inkludert dosering og vanlige bivirkninger.
Klinisk Bruk
Kirurgisk: NMBAs har vært en stift av anestesiologi og kirurgi siden introduksjonen av succinylkolin i 1952.3-7 valget av middel og dosering varierer mye avhengig av kirurgisk prosedyre og også på bruk av alternative midler, inkludert generelle anestetika, lokalbedøvelse og IV sedasjonsmedisiner. Primær bekymring ved kirurgisk bruk Av NMBAs er å oppnå passende nivåer av muskelblokade uten å indusere kardiovaskulære bivirkninger eller forlenge den totale varigheten av blokaden utover tidsrammen for den kirurgiske prosedyren.4 Selv om en fullstendig drøfting av agensutvelgelse og dosering for kirurgiske indikasjoner er utenfor omfanget av denne artikkelen, vil den kliniske reverseringen av disse effektene bli behandlet. Klinisk monitorering av en pasient som har fått MELLOM – og langtidsvirkende NMBA under et kirurgisk inngrep, bør inkludere testing av perifer nervestimulering (pns) (drøftet senere).1,4
RSI: RSI er en fremvoksende prosess som brukes til å sikre luftveiene til en ustabil pasient. Rsi-protokoller involverer administrering av et dypsedasjonsinduksjonsmiddel (f. eks. propofol, etomidat, midazolam) med nesten samtidig administrering AV EN NMBA. Det ønskede resultatet er at pasienten utvikler både amnestisk sedasjon og dyp muskelavslapping, og dermed forbedrer sannsynligheten for en vellykket intubasjon.8,9 valg av egnede midler bør baseres på agensspesifikk farmakokinetikk og pasientspesifikke kliniske variabler.en ideell agent for RSI er en med både en rask innsettende og en rask offset, som reduserer tiden fra administrasjon til intubasjon og reduserer også den totale varigheten av lammelse.10 en lang forsinkelse i legemiddelutbrudd øker den totale risikoen for hypoksi for pasienten. Som utbruddet tid forlenger, må mer tid passere mellom siste åndedrag via posen og de første åndedrag levert via endotrakealtuben. Økt varighet av lammelse øker risikoen for mislykket intubasjon.10,11 I Stedet for den raske utvinningen sett med succinylkolin, kan langvarige midler som rokuronium kreve respiratorisk støtte i mer enn 90 minutter.12
En Stor Cochrane-gjennomgang publisert i 2015 viste at succinylkolin var bedre enn rokuronium med hensyn til gunstige intubasjonsforhold. Disse funnene reflekterer sannsynligvis den gunstige kinetiske profilen til succinylkolin.13 imidlertid finnes det flere viktige kontraindikasjoner for bruk av succinylkolin i klinisk praksis. Hos pasienter med malign hypertermi i anamnesen eller hos pasienter med høy risiko for å utvikle hyperkalemi, forblir rokuronium et levedyktig RSI-middel.Akutt Respiratorisk Distress Syndrom (ARDS): En av de primære kliniske bekymringene for pasienter som utvikler ARDS er å redusere trykk og stress på lungene, og dermed redusere ytterligere betennelse utover den første skaden eller fornærmelsen. På grunn av deres effekter på diafragmatisk tone, Har NMBAs blitt foreslått som en metode for å redusere ventilator asynkroni og lungetrykk. Det er publisert tre primærstudier på engelsk som evaluerte Bruken Av NMBAs i TIDLIG FASE av ARDS.14-16 hver studie viste økt oksygenering hos pasienter behandlet tidlig med en 48-timers kontinuerlig infusjon av cisatracurium. En 2013 meta-analyse av samlede data fra disse studiene viste at tidlig administrasjon av cisatracurium resulterte i redusert barotrauma (P = .02) og redusert sykehusdødelighet (P = .005), men hadde ingen effekt på varigheten av mekanisk ventilasjon (P = .57).17
Basert på disse funnene er Det rimelig å vurdere NMBAs for behandling av akutt ARDS hos pasienter som presenterer FOR ICU.4 mens virkningsmekanismen for Alle Ikke-depolariserende Nmbaer skal bidra til den foreslåtte mekanismen for klinisk nytte i ARDS, publiserte randomiserte, kontrollerte studier som bare brukte cisatracurium i intervensjonsgruppen. Hvorvidt andre agenter ville ha effekt på disse utfallene, har ikke blitt adressert i litteraturen.
Terapeutisk Hypotermi: NMBAs er foreslått som en del av mange behandlingsalgoritmer for pasienter som gjennomgår terapeutisk hypotermi etter hjertestans.18 Ved å kontrollere skjelving kan NMBAs redusere det totale oksygenforbruket. Selv om dette ikke er undersøkt i akuttbehandling, er disse fysiologiske endringene påvist hos kirurgiske pasienter som gjennomgår hypotermi ved kardiopulmonal bypass.19,20 i en retrospektiv studie av 111 pasienter som gjennomgikk terapeutisk hypotermi (18 MED NMBA vs 93 uten), var det en forbedring i sykehusoverlevelse (P = .004) som forble signifikant etter multivariat analyse av potensielle baseline confounders (95% KI, 1,56-33,38).21 en trend mot forbedringer i laktatclearance og funksjonelle utfall ble også observert hos pasienter som fikk kontinuerlig NMBA.
En annen retrospektiv studie adresserte utvelgelsen Av NMBAs hos pasienter som gjennomgår terapeutisk hypotermi etter hjertestans.22 ved hjelp av en multivariat analyse sammenlignet forskerne 201 pasienter som fikk terapeutisk hypotermi (29,9% med cisatracurium vs 17,9% med vekuronium). Cisatracurium var den eneste uavhengige positive prediktoren for overlevelse med godt nevrologisk utfall (P = .014). På grunn av den retrospektive naturen og den lille prøvestørrelsen i denne studien, er det vanskelig å vurdere den samlede effekten for å oppdage eventuelle forskjeller som vekuronium gir i likhet med det som ble observert med cisatracurium. Det er mulig at konfunderende variabler kan ha sterkere innflytelse enn det valgte neuroblockademidlet på generelle utfall.22
Forhøyet Intrakranielt Trykk (ICP): ICP styres rutinemessig av dyp sedasjon og analgesi, reduserer oksygenforbruk og cerebral metabolisme mens du kontrollerer smerte, bevegelse og ventilator asynkroni.2 tillegg Av NMBAs vurderes bare når dyp sedasjon er utilstrekkelig for å kontrollere farlige økninger I ICP, ofte et resultat av hoste, suging eller rystelse.2,12 TIDLIG NMBA bruk har vist seg å føre til redusert dødelighet, men på bekostning av økt sykelighet. Hsiang og kollegaer gjennomgikk i ettertid data på en kohort på 514 pasienter fra Traumatic Coma Data Bank for å evaluere bruken av tidlig utvidet NMBA-bruk versus kortvarig NMBA-bruk. ICU-oppholdet var i gjennomsnitt 3 dager lenger, flere pasienter utviklet lungebetennelse, og det var en trend mot økt risiko for sepsis hos pasienter med UTVIDET NMBA. I tillegg, selv om det var flere dødsfall i ikke-NMBA-gruppen, HADDE NMBA-gruppen en større forekomst av vegetative eller alvorlig funksjonshemmede overlevende.23 Bruk Av NMBAs i økt ICP fører til betydelige vanskeligheter med å overvåke nevrologisk funksjon og anfallsaktivitet.24
Reverseringsmidler
selv om det er uvanlig ved INTENSIVAVDELINGEN, er reversering Av NMBAs en viktig del av den kirurgiske behandlingen av pasienter som får paralyserte legemidler. Historisk sett har dette skjedd ved bruk av neostigmin postoperativt.4 Neostigmin er en acetylkolinesterasehemmer (ACheI) som reduserer nedbrytningen av acetylkolin i motorendeplaten, noe som forårsaker en økning i konsentrasjonen av acetylkolin. Fordi Ikke-depolariserende Nmbaer er konkurrerende antagonister av nikotinreseptoren, øker neostigmin konkurransetrykket av acetylkolin på stedet for legemiddelvirkning. Selv om neostigmin er effektiv til å forbedre restitusjonstiden etter NMBA-administrasjon, kan det være upålitelig på grunn av den indirekte virkningsmekanismen.4,25 HVIS NMBA-konsentrasjonene er høye nok, kan antagonismen ikke overvinnes uavhengig av administrert antikolinesterasedose. Manglende fullstendig reversering Av NMBAs postoperativt har vist seg å øke forekomsten av gjenværende svakhet og dysfagi og risikoen for aspirasjon.4,25 i tillegg har neostigmin sine egne bivirkninger gjennom sin virkning på både nikotinsyre og muskarinreseptorer. Mens nikotinreseptoren blokkeres VIA NMBA, resulterer neostigmins effekt på muskarinreseptoren i økte bronkospasmer, gastrisk motilitet, sekresjoner og bradykardi.25 for å redusere disse risikoene må en antimuskarin agonist som atropin eller glykopyrrolat brukes sammen med neostigmin for å kompensere for økt muskarinaktivering.i desember 2015 godkjente FDA sugammadex (Bridion), et nytt direkte reverseringsmiddel for rokuronium og vekuronium. Klassifisert som et gamma-cyklodekstrin, skaper sugammadex et legemiddelkompleks med fri NMBA, og reduserer dermed de tilgjengelige agenskonsentrasjonene. Disse farmakokinetiske effektene på NMBA-konsentrasjonen er både raske og fullstendige. På grunn av deres størrelse er cisatracurium, atracurium og succinylcholin upåvirket av sugammadex.26 den primære fordelen med sugammadex, sammenlignet med neostigmin, er reverseringshastigheten (2 minutter vs. 17 minutter).27 i Motsetning Til ACheIs har sugammadex ingen himlingseffekt, dvs. med en stor nok sugammadexdose kan enhver lammelsesdybde raskt reverseres.26,28 til Slutt har bruken av sugammadex ingen farmakodynamisk effekt på muskarinreseptorer, noe som signifikant reduserer medisinens bivirkningsprofil og unngår behovet for å samtidig administrere antimuskariniske midler. Dosering av sugammadex er basert på nivået av nevromuskulær blokade, fra 2 mg/kg for moderat blokade til 16 mg/kg for umiddelbar reversering.26,28
Sedasjon
Det er ekstremt viktig å erkjenne at Selv Om Nmbaer forhindrer muskelbevegelse, har De ingen effekt på pasientens bevissthetsnivå eller evne til å oppleve smerte eller ubehag, noe som resulterer i et fenomen beskrevet som utilsiktet bevissthet.1 enten det gjelder kirurgiske eller medisinske indikasjoner, kan pasienter være utsatt for utilstrekkelig sedasjon eller analgesi. En case-serie viste at opptil 18% av pasientene opprettholder en viss grad av bevissthet mens de er lammet.29 disse pasientene rapporterer følelser som spenner fra en drømmelignende tilstand til eksplisitt bevissthet. Det er ingen studier som gir spesifikk veiledning om håndtering av utilsiktet bevissthet under nevromuskulær blokade. Uansett anses det som standard praksis å etablere og opprettholde passende nivåer av analgesi og dyp sedasjon før og under nevromuskulær blokade.1
Monitorering
monitorering av Pasienter på NMBAs er viktig, men metoder kompliseres ofte av klinisk forløp, samtidig administrering av sedativer og analgetika, og ytterligere terapeutiske modaliteter (f.eks. terapeutisk hypotermi). PNS er ofte ansett som overvåkingsmetoden av valget, men det har begrensninger. Ytterligere overvåkingsparametere inkluderer spontan pust og trender i vitale tegn.2
PNS anbefales uavhengig av hverandre for pasienter som får Kontinuerlig Infusjon Av NMBAs og som tillegg i andre kliniske situasjoner.1 en tog-av-fire enhet festet på orbicularis oculi, ulnar nerve, eller peroneal nerve leverer fire påfølgende elektriske stimuli. I fravær av nevromuskulær blokade vil det bli observert en lik twitch-respons for alle fire stimuli, noe som resulterer I Et t4 / T1-forhold på 1. I en lammet pasient bør tråkkresponsen observeres med den første stimulansen, men dette bør reduseres på grunn av blokkaden av motorneuroner. Målet er å oppnå Et t4 / T1-forhold på omtrent 0,25.1
Komplikasjoner
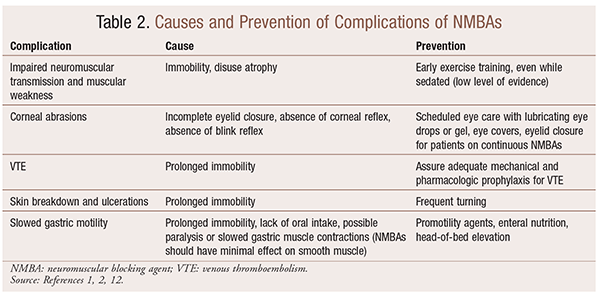
Selv om Det er betydelige fordeler ved Bruk Av NMBAs i spesielle situasjoner, er det også kortsiktige og langsiktige komplikasjoner. I den akutte innstillingen kan Bruk Av NMBAs føre til økt ICU-opphold, langvarig mekanisk ventilasjon, venøs tromboembolisme, hudskader og sår, infeksjon, hornhinneskader og anafylaksi. Langvarig administrasjon kan føre til immobilitet eller økt restitusjonstid på grunn av nedsatt nevromuskulær overføring og muskelsvakhet.30 Flere anbefalinger for å forhindre disse effektene er skissert i TABELL 2.
Konklusjon
apoteket kan spille en svært viktig rolle i regulering og bruk Av Nmbaer på tvers av et bredt spekter av kliniske praksissteder. Ved å forstå virkningsmekanismen, terapeutiske indikasjoner, støttende litteratur og kliniske bivirkninger av denne høyvarslende klassen av medisiner, kan apoteket ha en uvurderlig effekt på pasientbehandling og pasientsikkerhet.
1. Murray MJ, DeBlock H, Erstad B, et al. Klinisk praksis retningslinjer for vedvarende nevromuskulær blokade hos voksne kritisk syke pasienter. Crit Care Med. 2016;44:2079-2103.
2. Dr. med. j, Thiboutot Z, Rose L, et al. Nåværende terapeutisk bruk, farmakologi og kliniske hensyn til nevromuskulære blokkerende midler for kritisk syke voksne. Ann Pharmacother. 2011;45:1116-1126.
3. Foldes FF, McNall PG, Borrego-Hinojosa JM. Succinylkolin: en ny tilnærming til muskelavslapping i anestesiologi. N Engl J Med. 1952;247:596-600.
4. Naguib M, Lien CA. Farmakologi av muskelavslappende midler og deres antagonister. I: Millers Anestesi. 7.utg. Miller RD, Eriksson LI, Fleisher LA, et al, eds. Philadelphia, PA: Churchill Livingstone; 2010.
5. Anektin (succinylkolin) pakningsvedlegg. Princeton, NJ: Sandoz Inc; September 2010.
6. Rocuronium pakningsvedlegg. Irvine, CA: Teva Parenteral Medicines, Inc; November 2008.
7. Nimbex (cisatracurium) pakningsvedlegg. Nord-Chicago, IL: Abbott Laboratories; 2010.
8. Sakles JC, Laurin EG, Rantapaa AA, Panacek EA. Luftveisadministrasjon i akuttmottaket; en ettårig studie av 610 trakeal intubasjoner. Ann Emerg Med. 1998;31:325-332.
9. Tayal VS, Riggs RW, Marx JA, et al. Rapid-sekvens intubasjon på et akuttmedisinsk bosted: suksessrate og bivirkninger i løpet av en toårsperiode. Acad Emerg Med. 1999;6:31-37.
10. Li J, Murphy-Lavoie H, Bugas C, Et al. Komplikasjoner av akutt intubasjon med og uten lammelse. Am J Emerg Med. 1999;17:141-143.
11. Jørgensen M, Samarkandi AH, El-Din ME, et al. Dosen av succinylkolin kreves for gode endotracheal intuberende forhold. Anesth Analg. 2006;102:151-155.
12. Greenberg SB, Vender J. bruken av nevromuskulære blokkerende midler i ICU: hvor er vi nå? Crit Care Med. 2013;41:1332-1344.
13. Tran DT, Newton EK, Mount VA, et al. Rokuronium versus succinylkolin for rask sekvensinduksjon intubasjon. Cochrane Database Syst Rev. 2015; (10): CD002788.
14. J. j. j., et al. Effekt av nevromuskulære blokkerende midler på gassutveksling hos pasienter med akutt respiratorisk distress syndrom. Crit Care Med. 2004;32:113-119.
15. Forel JM, Roch A, Marin V, et al. Neuromuskulære blokkerende midler reduserer inflammatorisk respons hos pasienter med akutt respiratorisk distress syndrom. Crit Care Med. 2006;34:2749-2757.
16. Papazian L, Forel JM, Gacouin A, et al. Nevromuskulære blokkere i tidlig akutt respiratorisk nødsyndrom. N Engl J Med. 2010;363:1107-1116.
17. Alhazzani W, Alshahrani M, Jaeschke R, et al. Neuromuskulære blokkerende midler i akutt respiratorisk nødsyndrom: en systemisk gjennomgang og meta-analyse av randomiserte kontrollerte studier. Crit Omsorg. 2013; 17: R43.
18. Jm, R. M., R. M., Et al. Anestesi og analgesi protokoll under terapeutisk hypotermi etter hjertestans: en systematisk oversikt. Anesth Analg. 2010;110:1328-1335.
19. Cruise C, MacKinnon J, Tough J, Houston P. Sammenligning av meperidin og pancuronium for behandling av skjelving etter hjertekirurgi. Kan J Anaesth. 1992;39:563-568.
20. Sladen RN, Berend JZ, Fassero JS, et al. Sammenligning av vekuronium og meperidin på de kliniske og metabolske effektene av skjelving etter hypotermisk kardiopulmonal bypass. J Cardiothorac Vasc Anesth. 1995;9:147-153.
21. Salciccioli JD, Cocchi MN, Rittenberger JC, et al. Kontinuerlig nevromuskulær blokade er assosiert med redusert dødelighet hos pasienter etter hjertestans. Gjenoppliving. 2013;84:1728-1733.
22. Baker WL, Geronila G, Kallur R, et al. Effekt av nevromuskulære blokkere på utfall hos pasienter som får terapeutisk hypotermi etter hjertestans. Analg Resusc Currr Res. 2013; S1.
23. Hsiang JK, Chesnut RM, Crisp CB, et al. Tidlig, rutinemessig lammelse for intrakraniell trykkkontroll ved alvorlig hodeskade: er det nødvendig? Crit Care Med. 1994;22:1471-1476.
24. Rangel-Castilla L, Gopinath S, Robertson CS. Behandling av intrakraniell hypertensjon. Neurol Clin. 2008;26:521-541.
25. Caldwell JE. Kliniske begrensninger av acetylkolinesteraseantagonister. J Crit Omsorg. 2009;24:21-28.
26. Bridion (sugammadex) package insert. Whitehouse Station, NJ: Merck & Co, Inc; July 2015.
27. Sacan O, White PF, Tufanogullari B, Klein K. Sugammadex reversal of rocuronium-induced neuromuscular blockade: a comparison with neostigmine-glycopyrrolate and edrophonium-atropine. Anesth Analg. 2007;10:569-574.
28. Meistelman C, Donati F. Do we really need sugammadex as an antagonist of muscle relaxants in anesthesia? Curr Opin Anaesthesiol. 2016;29:462-467.
29. Arnot-Smith J, Smith AF. Patient safety incidents involving neuromuscular blockade: analyse AV UK National Reporting And Learning System data fra 2006 til 2008. Anestesi. 2010;65:1106-1113.
30. Pris DR, Mikkelsen MEG, Umscheid CA, Armstrong EJ. Neuromuskulære blokkerende midler og nevromuskulær dysfunksjon oppnådd i kritisk sykdom: en systematisk gjennomgang og meta-analyse. Crit Care Med. 2016;44:2070-2078.
31. Prielipp RC, Coursin DB, Scuderi PE, et al. Sammenligning av infusjonsbehov og gjenvinningsprofiler for vekuronium OG cisatracurium 51W89 hos pasienter med intensivavdeling. Anesth Analg. 1995;81:3-12.
32. Sparr HJ, Wierda JM, Proost JH, et al. Farmakodynamikk og farmakokinetikk av rokuronium hos intensivpasienter. Br J Anaesth. 1997;78:267-273.