us Pharm. 2017; 42 (1): HS16-HS20.resumo: os bloqueadores neuromusculares (NMBAs) desempenham um papel importante no tratamento de um grande número de doentes hospitalares. A farmacologia da NMBAs é bem compreendida, mas o uso destes agentes pode ser controverso. As lmbas são comuns em situações cirúrgicas e intubação de sequência rápida, mas outras indicações, tais como síndrome de dificuldade respiratória aguda, hipotermia terapêutica e pressão intracraniana elevada, são um pouco divisivas. É essencial que os farmacêuticos estejam familiarizados com as implicações clínicas e os resultados associados à utilização de Lmbas. Além disso, é importante entender considerações concomitantes, como sedação, monitoramento e reversão. Os farmacêuticos no hospital devem estar familiarizados com o novo agente de reversão directa recentemente aprovado sugammadex (Bridion).os bloqueadores neuromusculares (Lmbas) desempenham um papel importante no tratamento de um grande número de doentes hospitalares. Além de seu uso de rotina em anestesia cirúrgica, a NMBAs pode ser valiosa em muitas situações de cuidados críticos novos e em evolução. Por conseguinte, é essencial que o farmacêutico hospitalar se familiarize com as implicações clínicas e os resultados associados à utilização e reversão da NMBA.
a farmacologia
NMBAs exercem os seus efeitos farmacológicos através da modulação da transmissão do sinal no músculo esquelético. Potenciais de Acção (alterações no potencial eléctrico associado à passagem de um impulso ao longo da membrana de um músculo ou de uma célula nervosa) atingir o músculo esquelético activa a libertação de acetilcolina nos terminais motores. A acetilcolina liga-se aos receptores nicotínicos do endplato, resultando na libertação de Na+ (sódio) em fibras musculares, o que despoleta o potencial de Acção muscular. Os iões de cálcio são então libertados no retículo sarcoplasmático, provocando a ligação da miosina à actina. A miosina continuará a ligar-se e a mover-se ao longo dos locais de actina, reduzindo o sarcoma, enquanto o cálcio estiver presente na célula. NMBAs trabalham de duas maneiras para bloquear este processo.os NMBAs despolarizantes actuam como agonistas nos receptores nicotínicos.1 Eles mantêm abertos os canais iônicos, levando à fasciculação muscular até que o potencial iônico esteja esgotado, e, em seguida, à paralisia.2 succinilcolina é a única NMBA despolarizante disponível. Os Lmbas não despolarizantes são antagonistas competitivos nos receptores nicotínicos, bloqueando a acetilcolina no endplato motor.1 Isto impede que o potencial de acção se propague, tornando assim as células musculares insensíveis aos impulsos nervosos motores. A paralisia muscular ocorre sequencialmente, começando com músculos pequenos e rápidos nos olhos e laringe e progredindo para os membros, tronco, vias aéreas, músculos intercostais e diafragma. A recuperação do bloqueio neuromuscular ocorre na ordem inversa.Como resultado dos seus efeitos mecanísticos na acetilcolina, a NMBAs exibe muitos efeitos secundários. A acetilcolina desempenha um papel na libertação de histamina, activação muscarínica, acção vagolítica e libertação de norepinefrina. Como resultado, foram observados efeitos secundários como taquicardia e bradicardia, hipertensão e hipotensão, e broncodilatação e broncospasmo com a sua utilização (Tabela 1).
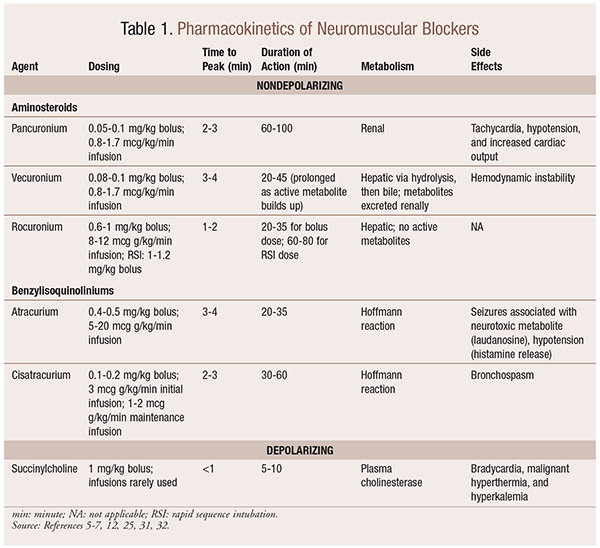
Farmacocinética
Dependendo da situação, é útil ter uma variedade de perfis cinéticos disponíveis quando um NMBA está sendo selecionado. Início rápido e curta duração são úteis para indicações como intubação de sequência rápida (RSI), enquanto aqueles com uma duração mais longa são de maior valor na cirurgia. Ver Quadro 1 para uma breve visão geral dos perfis cinéticos, incluindo Posologia e efeitos secundários frequentes.
Clínicos de Uso
Cirúrgico: NMBAs tem sido um grampo de anestesiologia e cirurgia desde a introdução da succinilcolina em 1952.3-7 A escolha do agente e a dosagem varia amplamente, dependendo do procedimento cirúrgico e também sobre o uso de outros agentes, incluindo anestésicos gerais, anestésicos locais, e IV sedação medicamentos. A principal preocupação no uso cirúrgico de Lmbas é alcançar níveis adequados de bloqueio muscular sem induzir efeitos colaterais cardiovasculares ou alongamento da duração total do bloqueio para além do período de tempo do procedimento cirúrgico.Embora uma discussão completa sobre a seleção de agentes e a dosagem para indicações cirúrgicas esteja fora do âmbito deste artigo, a reversão clínica destes efeitos será abordada. A monitorização clínica de um doente que recebeu um LMBA de Acção intermédia a prolongada durante um procedimento cirúrgico deve incluir testes de estimulação do nervo periférico (PNS) (discutidos posteriormente).1,4
RSI: RSI é um processo emergente usado para proteger as vias aéreas de um paciente instável. Os protocolos RSI envolvem a administração de um agente de indução de sedação profunda (por exemplo, propofol, etomidato, midazolam) com a administração quase simultânea de um NMBA. O resultado desejado é que o paciente desenvolva sedação amnestica e relaxamento muscular profundo, melhorando assim a probabilidade de uma entubação bem sucedida.A selecção dos agentes apropriados deve basear-se numa farmacocinética específica do agente e em variáveis clínicas específicas do doente.
um agente ideal para RSI é um com um início rápido e um deslocamento rápido, o que diminui o tempo da administração para a intubação e também reduz a duração total da paralisia.Um atraso prolongado no início do fármaco aumenta o risco global de hipoxia para o doente. À medida que o tempo de início aumenta, mais tempo deve passar entre a última respiração através do saco e a primeira respiração através do tubo endotraqueal. O aumento da duração da paralisia aumenta o risco de intubação falhada.10, 11 ao invés da rápida recuperação observada com succinilcolina, agentes de maior duração, como o rocurônio, podem necessitar de suporte respiratório por mais de 90 minutos.12
uma grande revisão Cochrane publicada em 2015 demonstrou que a succinilcolina era superior ao rocurónio no que diz respeito a condições favoráveis de intubação. Estes achados provavelmente refletem o perfil cinético favorável da succinilcolina.Contudo, na prática clínica existem várias contra-indicações importantes para o uso da succinilcolina. Em doentes com história de hipertermia maligna ou em doentes com alto risco de desenvolver hipercaliemia, o rocurónio continua a ser um agente RSI viável.síndrome de dificuldade respiratória aguda (SDRA): uma das principais preocupações clínicas dos doentes que desenvolvem SDRA é a redução da pressão e do stress nos pulmões, reduzindo assim a inflamação adicional para além dos danos iniciais ou dos insultos. Devido aos seus efeitos no tom diafragmático, NMBAs foram sugeridos como um método para diminuir a asincronia do ventilador e as pressões pulmonares. Três estudos primários foram publicados em inglês que avaliaram o uso de NMBAs na fase inicial de ARDS.Cada estudo demonstrou um aumento da oxigenação em doentes tratados precocemente com uma perfusão contínua de 48 horas de cisatracúrio. Uma meta-análise de 2013 dos dados agrupados destes estudos mostrou que a administração precoce de cisatracurium resultou numa redução do barotrauma (P = .02) e diminuição da mortalidade hospitalar (P = .005), mas não teve efeito na duração da ventilação mecânica (P = .57).Com base nestes resultados, é razoável considerar as Lmbas para o tratamento de SDRA aguda em doentes que apresentem a UCI.4 Embora o mecanismo de Acção para todos os NMBAs não despolarizantes deva contribuir para o mecanismo proposto de benefício clínico em ARDS, os ensaios aleatorizados e controlados publicados utilizaram o cisatracúrio apenas no grupo Intervencionista. A questão de saber se outros agentes teriam um efeito sobre estes resultados não foi abordada na literatura.hipotermia terapêutica: NMBAs foram propostas como parte de muitos algoritmos de tratamento para pacientes submetidos a hipotermia terapêutica pós-parada cardíaca.18 ao controlar o arrepio, os NMBAs podem diminuir o consumo total de oxigénio. Embora isto não tenha sido estudado nos cuidados críticos, estas alterações fisiológicas foram demonstradas em doentes cirúrgicos submetidos a hipotermia durante o bypass cardiopulmonar.19, 20 num estudo retrospectivo de 111 doentes submetidos a hipotermia terapêutica (18 com NMBA vs. 93 sem), verificou-se uma melhoria na sobrevivência hospitalar (P = .(IC 95%, 1, 56-33, 38).Observou-se também uma tendência para melhorias na depuração de lactato e resultados funcionais em doentes a receber LMBA contínua.outro estudo retrospectivo abordou a selecção de Lmbas em doentes submetidos a hipotermia terapêutica após paragem cardíaca.Utilizando uma análise multivariada, os investigadores compararam 201 doentes a receber hipotermia terapêutica (29, 9% com cisatracurium vs. 17, 9% com vecurónio). O Cisatracurium foi o único preditor positivo independente da sobrevivência com um bom resultado neurológico (P = .014). Devido à natureza retrospectiva e à pequena dimensão da amostra deste estudo, é difícil avaliar a potência global para detectar qualquer diferença oferecida pelo vecurónio semelhante à observada com o cisatracurium. É possível que variáveis confusas possam ter uma influência mais forte do que o agente neuroblockade seleccionado nos resultados globais.Pressão intracraniana elevada (PCI): ICP é rotineiramente gerenciado por sedação profunda e analgesia, reduzindo o consumo de oxigênio e metabolismo cerebral, enquanto controla a dor, o movimento e o ventilador asinchrony.2 a adição de NMBAs é considerada apenas quando a sedação profunda é insuficiente para controlar os aumentos perigosos de ICP, muitas vezes resultado de tosse, sucção ou tremores.Foi demonstrado que o uso precoce de NMBA conduz a uma diminuição da mortalidade, mas à custa de um aumento da morbilidade. Hsiang e colegas analisaram retrospectivamente dados sobre uma coorte de 514 pacientes do banco de dados de Coma traumático para avaliar o uso antecipado de uso prolongado de NMBA versus uso de curta duração de NMBA. A permanência na UCI foi uma média de 3 dias mais, mais pacientes desenvolveram pneumonia, e houve uma tendência para o aumento do risco de septicemia em pacientes com LMBA prolongada. Além disso, apesar de haver mais mortes no grupo não-NMBA, o grupo NMBA teve uma maior incidência de sobreviventes vegetativos ou gravemente incapacitados.A utilização de Lmbas no aumento da PCI conduz a dificuldades significativas na monitorização da função neurológica e da actividade das crises.Agentes de reversão
embora pouco frequentes na UCI, a reversão de Lmbas é uma parte importante do tratamento cirúrgico de doentes que recebem paralíticos. Historicamente, isto ocorreu através do uso de neostigmina no pós-operatório.A neostigmina é um inibidor da acetilcolinesterase (IECA) que reduz a degradação da acetilcolina no endplato motor, causando um aumento na concentração de acetilcolina. Uma vez que os Lmbas não despolarizantes são antagonistas competitivos do receptor nicotínico, a neostigmina aumenta a pressão competitiva da acetilcolina no local da acção do fármaco. Embora a neostigmina seja eficaz na melhoria dos tempos de recuperação após a administração de LMBA, pode ser pouco fiável devido ao seu mecanismo indirecto de Acção.Se as concentrações de LMBA forem suficientemente elevadas, o antagonismo não pode ser ultrapassado independentemente da dose de anticolinesterase administrada. A incapacidade de reverter totalmente a Lmbas no pós-operatório mostrou aumentar as taxas de fraqueza residual e disfagia e o risco de aspiração.Adicionalmente, a neostigmina tem os seus próprios efeitos secundários através da sua acção nos receptores nicotínicos e muscarínicos. Enquanto o receptor nicotínico é bloqueado através da LMBA, o efeito da neostigmina no receptor muscarínico resulta num aumento dos broncospasmos, motilidade gástrica, secreções e bradicardia.Para reduzir estes riscos, deve ser utilizado com neostigmina um agonista antimuscarínico, como a atropina ou o glicopirrolato, para compensar o aumento da activação muscarínica.em dezembro de 2015, a FDA aprovou sugamadex (Bridion), um novo agente de reversão direta para rocurônio e vecurônio. Classificado como gama-ciclodextrina, sugamadex cria um complexo de drogas com NMBA livre, reduzindo assim as concentrações de agentes disponíveis. Estes efeitos farmacocinéticos na concentração de NMBA são rápidos e completos. No entanto, devido ao seu tamanho, cisatracurium, atracurium e succinilcolina não são afetados pelo sugamadex.O principal benefício da sugamadex, em comparação com a neostigmina, é a velocidade a que ocorre a reversão (2 minutos vs. 17 minutos).27 Ao contrário de ACheIs, sugamadex não tem efeito no teto, ou seja, com uma grande dose suficiente de sugamadex, qualquer profundidade de paralisia pode ser rapidamente revertida.Por último, a utilização de sugamadex não tem efeito farmacodinâmico nos receptores muscarínicos, reduzindo significativamente o perfil de efeitos secundários do medicamento e evitando a necessidade de co-administração de agentes antimuscarínicos. A administração de sugamadex é baseada no nível de bloqueio neuromuscular, que varia entre 2 mg/kg para bloqueio moderado e 16 mg / kg para reversão imediata.26,28
sedação
é extremamente importante reconhecer que, embora as Lmbas previnam o movimento muscular, elas não têm efeito no nível de consciência do paciente ou na capacidade de perceber dor ou desconforto, resultando em um fenômeno descrito como consciência não intencional.1 para indicações cirúrgicas ou médicas, os doentes podem estar em risco de sedação ou analgesia insuficientes. Uma série de casos demonstrou que até 18% dos pacientes mantêm algum grau de consciência enquanto paralisados.29 estes pacientes relatam sensações que vão de um estado de sonho a consciência explícita. Não existem ensaios que forneçam orientações específicas sobre a gestão de conscientização não intencional durante o bloqueio neuromuscular. Independentemente disso, é considerada prática padrão estabelecer e manter níveis apropriados de analgesia e sedação profunda antes e durante o bloqueio neuromuscular.1
monitorização
a monitorização dos doentes com Lmbas é imperativa, mas os métodos são muitas vezes complicados pelo curso clínico, co-administração de sedativos e analgésicos, e modalidades terapêuticas adicionais (por exemplo, hipotermia terapêutica). PNS é comumente considerado como o método de monitoramento de escolha, mas tem limitações. Parâmetros adicionais de monitorização incluem respiração espontânea e tendências nos sinais vitais.2
PNS é recomendado independentemente para doentes em perfusão contínua de NMBAs e como adjuvante noutras situações clínicas.1 um dispositivo de trem-de-quatro ligado ao orbicularis oculi, nervo ulnar, ou nervo peroneal fornece quatro estímulos elétricos sucessivos. Na ausência de bloqueio neuromuscular, uma resposta de twitch igual será observada para todos os quatro estímulos, resultando em uma razão T4/T1 de 1. Em um paciente paralisado, a resposta de contração deve ser observada com o primeiro estímulo, mas isso deve diminuir por causa do bloqueio dos neurônios motores. O objetivo é alcançar uma razão T4 / T1 de aproximadamente 0, 25.1
complicações
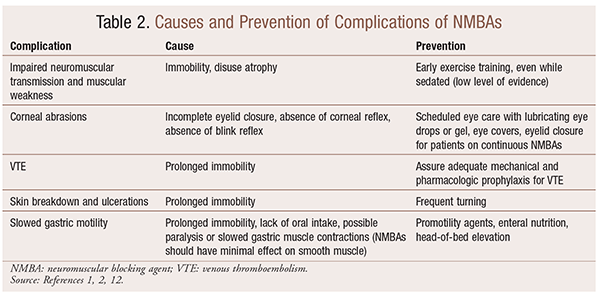
embora haja benefícios significativos para o uso de NMBAs em situações particulares, também há complicações de curto e longo prazo. No contexto agudo, a utilização de Lmbas pode levar ao aumento da permanência na UCI, ventilação mecânica prolongada, tromboembolismo venoso, lacrimejo da pele e ulcerações, infecção, lesões da córnea e anafilaxia. A administração a longo prazo pode levar à imobilidade ou ao aumento do tempo de recuperação devido a transmissão neuromuscular diminuída e fraqueza muscular.No quadro 2 são apresentadas várias recomendações para a prevenção destes efeitos.
Conclusão
O farmacêutico pode desempenhar importante papel na regulação e uso de NMBAs através de uma ampla gama de clínica-locais de prática. Ao compreender o mecanismo de Acção, as indicações terapêuticas, a literatura de apoio e os efeitos secundários clínicos desta classe de medicamentos de elevado nível de alerta, o farmacêutico pode ter um efeito inestimável nos cuidados prestados aos doentes e na segurança dos doentes.1. Murray MJ, DeBlock H, Erstad B, et al. Princípios orientadores da prática clínica para o bloqueio neuromuscular sustentado no doente adulto em estado crítico. Hematócrito Med. 2016;44:2079-2103.
2. Warr J, Thiboutot Z, Rose L, et al. Usos terapêuticos atuais, farmacologia e considerações clínicas de bloqueadores neuromusculares para adultos em estado crítico. Ann Pharmacother. 2011;45:1116-1126.
3. Foldes FF, McNall PG, Borrego-Hinojosa JM. Succinilcolina: uma nova abordagem ao relaxamento muscular na Anestesiologia. N Engl J Med. 1952;247:596-600.
4. Naguib M, Lien CA. Farmacologia dos relaxantes musculares e seus antagonistas. Em: A anestesia do Miller. 7th ed. Miller RD, Eriksson LI, Fleisher LA, et al, eds. Philadelphia, PA: Churchill Livingstone; 2010.
5. Folheto Informativo da anectina (succinilcolina). Princeton, NJ: Sandoz Inc; September 2010.
6. Folheto Informativo de rocurónio. Irvine, CA: Teva Parenteral Medicines, Inc; novembro de 2008.
7. Folheto informativo Nimbex (cisatracurium) North Chicago, IL: Abbott Laboratories; 2010.
8. Sakles JC, Laurin EG, Rantapaa AA, Panacek EA. Gestão das vias aéreas no serviço de emergência; um estudo de um ano de 610 intubações traqueais. Ann Emerg Med. 1998;31:325-332.
9. Tayal VS, Riggs RW, Marx JA, et al. Intubação de sequência rápida numa residência de Medicina de emergência: taxa de sucesso e acontecimentos adversos durante um período de dois anos. Acad Emerg Med. 1999;6:31-37.
10. Li J, Murphy-Lavoie H, Bugas C, et al. Complicações de intubação de emergência com e sem paralisia. Am J Emerg Med. 1999;17:141-143.
11. Naguib M, Samarkandi AH, El-Din ME, et al. A dose de succinilcolina necessária para excelentes condições de intubação endotraqueal. Anesth Analg. 2006;102:151-155.
12. Greenberg SB, Vender J. O uso de agentes bloqueadores neuromusculares na UCI: onde estamos agora? Hematócrito Med. 2013;41:1332-1344.
13. Tran DT, Newton EK, Mount VA, et al. Rocurónio versus succinilcolina para intubação de indução de sequência rápida. Cochrane Database Syst Rev. 2015; (10):CD002788.
14. Gainnier M, Roch a, Forel JM, et al. Efeito dos agentes bloqueadores neuromusculares na troca de gases em doentes com síndrome de dificuldade respiratória aguda. Hematócrito Med. 2004;32:113-119.
15. Forel JM, Roch a, Marin V, et al. Os bloqueadores neuromusculares diminuem a resposta inflamatória em doentes com síndrome de dificuldade respiratória aguda. Hematócrito Med. 2006;34:2749-2757.
16. Papazian L, Forel JM, Gacouin A, et al. Bloqueadores neuromusculares na síndrome de dificuldade respiratória aguda precoce. N Engl J Med. 2010;363:1107-1116.
17. Alhazzani W, Alshahrani M, Jaeschke R, et al. Agentes bloqueadores neuromusculares na síndrome de dificuldade respiratória aguda: revisão sistémica e meta-análise de ensaios controlados aleatórios. Hematócrito. 2013; 17:R43.
18. Chamorro C, Borrallo JM, Romera MA, et al. Protocolo anestésico e analgesia durante a hipotermia terapêutica após paragem cardíaca: uma revisão sistemática. Anesth Analg. 2010;110:1328-1335.
19. Cruise C, MacKinnon J, Tough J, Houston P. Comparison of meperidine and pancuronium for the treatment of shivering after cardiac surgery. Can J Anaesth. 1992;39:563-568.
20. Sladen RN, Berend JZ, Fassero JS, et al. Comparação do vecurónio e da meperidina com os efeitos clínicos e metabólicos do tremor após bypass cardiopulmonar hipotérmico. J Cardiothorac Vasc Anesth. 1995;9:147-153.
21. Salciccioli JD, Cocchi MN, Rittenberger JC, et al. O bloqueio neuromuscular contínuo está associado à diminuição da mortalidade em doentes pós-paragem cardíaca. Reanimacao. 2013;84:1728-1733.
22. Baker WL, Geronila G, Kallur R, et al. Efeito dos bloqueadores neuromusculares nos resultados em doentes a receber hipotermia terapêutica após paragem cardíaca. Analg Resusc Curr Res. 2013;S1.
23. Hsiang JK, Chesnut RM, Crisp CB, et al. Paralisia precoce e rotineira para controle da pressão intracraniana em lesões graves na cabeça: é necessário? Hematócrito Med. 1994;22:1471-1476.
24. Rangel-Castilla L, Gopinath S, Robertson CS. Tratamento da hipertensão intracraniana. Neurol Clin. 2008;26:521-541.
25. Caldwell JE. Limitações clínicas dos antagonistas da acetilcolinesterase. J Crit Care. 2009;24:21-28.
26. Bridion (sugammadex) package insert. Whitehouse Station, NJ: Merck & Co, Inc; July 2015.
27. Sacan O, White PF, Tufanogullari B, Klein K. Sugammadex reversal of rocuronium-induced neuromuscular blockade: a comparison with neostigmine-glycopyrrolate and edrophonium-atropine. Anesth Analg. 2007;10:569-574.
28. Meistelman C, Donati F. Do we really need sugammadex as an antagonist of muscle relaxants in anesthesia? Curr Opin Anaesthesiol. 2016;29:462-467.
29. Arnot-Smith J, Smith AF. Patient safety incidents involving neuromuscular blockade: análise dos dados do Sistema Nacional de informação e aprendizagem do Reino Unido de 2006 a 2008. Anestesia. 2010;65:1106-1113.
30. Price DR, Mikkelsen ME, UMSCHEID CA, Armstrong EJ. Agentes bloqueadores neuromusculares e disfunção neuromuscular adquirida em doenças críticas: a systematic review and meta-analysis. Hematócrito Med. 2016;44:2070-2078.
31. Prielipp RC, Coursin DB, Scuderi PE, et al. Comparação dos Requisitos de perfusão e dos perfis de recuperação do vecurónio e do cisatracurium 51W89 em doentes com unidades de cuidados intensivos. Anesth Analg. 1995;81:3-12.
32. Sparr HJ, Wierda JM, Proost JH, et al. Farmacodinâmica e farmacocinética do rocurónio em doentes com cuidados intensivos. Br J Anaesth. 1997;78:267-273.