È un composto chimico inorganico che esiste naturalmente come un minerale raro. Può dissolversi ugualmente in una soluzione di acido forte o base ed è chiamato un composto anfotero. In condizioni acquose, il composto si dissocia in ioni zinco e idrossido.
Identificazione dell’idrossido di zinco
Numero CAS: 20427-58-1
PubChem: 9812759
ChemSpider: 7988510
Formula di idrossido di zinco
La sua formula chimica è Zn (OH)2.
Proprietà idrossido di zinco
Le seguenti sono alcune delle proprietà uniche del composto:
Aspetto
Appare generalmente come un solido bianco.
Massa molare
Pesa circa 99,424 g / mol.
Stabilità
È stabile e non reattivo in condizioni normali.
Densità
La sua massa per volume è di circa 3,053 g / cm3.
Punto di fusione
Si decompone a 125 gradi Celsius.
Solubilità
È scarsamente solubile in acqua e assolutamente insolubile in alcool. Il suo prodotto di solubilità (Ksp) è 3.0 x 10-17.
Dissoluzione
L’idrossido di zinco si dissolve in ammoniaca acquosa per formare un complesso amminico incolore e solubile in acqua. Quando l’ammoniaca viene aggiunta in eccesso, gli ioni idrossido che si dissociano da Zn (OH) 2 reagiscono con esso per formare un complesso tetra caricato positivamente con un numero di coordinazione di 4. Il prodotto risultante è circondato dal legante dell’ammoniaca, che provoca la dissoluzione.
Idrossido di zinco Termochimica
La sua entalpia standard di formazione o calore standard di formazione è -642 kJ.mol-1.
Struttura di idrossido di zinco
Ecco la struttura del composto anfotero.
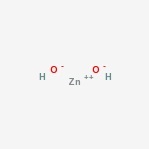
Presenza di idrossido di zinco
Si presenta come tre minerali delle terre rare: Wulfingite, ashoverite e sweetite. Questi minerali rari sono in realtà i polimorfi naturali di Zn (OH)2. Nella scienza dei materiali, qualsiasi materiale solido è polimorfico se esiste in più di una forma come ortorombica o tetragonale.
Preparazione di idrossido di zinco
Viene generalmente preparato aggiungendo quantità moderate di soluzione di idrossido di sodio a una soluzione salina di zinco come cloruro di zinco o solfato di zinco. Questi due composti reagiscono in condizioni normali per formare un precipitato bianco di Zn (OH)2. In questa reazione deve essere utilizzata una soluzione diluita di idrossido di sodio per evitare che il composto inorganico si dissolva. In condizioni normali, il sale di zinco si dissocia per formare uno zinc zinco che si associa a due ioni idrossido dalla soluzione di idrossido di sodio per formare idrossido di zinco.
Zn2++ 2OH- → Zn(OH)2
Se l’eccesso di idrossido di sodio viene aggiunto alla soluzione salina, il precipitato di Zn (OH)2 che è formata inizialmente si dissolvono per formare una forma un gas incolore soluzione di zincate di ioni, come indicato di seguito:
Zn (OH)2 + 2OH– → Zn(OH)42-
Questa proprietà di idrossido di zinco è ampiamente utilizzato per rilevare la presenza di ioni di zinco in soluzione. Tuttavia, non è un metodo unico per testare come ci molti composti di alluminio e piombo che si comportano in modo molto simile.
La proprietà di dissoluzione dell’idrossido di zinco può essere contribuito alla presenza di leganti d’acqua che normalmente circondano lo ion. Quando l’idrossido di sodio in eccesso viene aggiunto alla soluzione, i due ioni idrossido lo riducono a un complesso caricato negativamente, rendendolo così solubile.
Usi idrossido di zinco
Alcuni degli usi comuni di Zn (OH)2 sono:
Medicazioni chirurgiche
Viene utilizzato per medicazioni chirurgiche dove funziona come assorbente. Le grandi bende che vengono utilizzate dopo la chirurgia sono rivestite con il composto di zinco per assorbire il sangue dalla ferita.
Rivestimento protettivo
L’acciaio e il ferro vengono spesso applicati con un rivestimento di zinco attraverso un processo chiamato galvanizzazione. In condizioni umide, uno strato di idrossido di zinco si forma su questi metalli zincati per evitare che si arrugginiscano.
Mordente
L’idrossido di zinco è molto gelatinoso (gelatinoso) e generalmente funziona come mordente che imposta i coloranti su vari tessuti o tessuti. Il colorante è generalmente un reagente chimico, che forma un complesso metallico con Zn (OH)2 e si attacca fortemente ai rivestimenti del tessuto.
Pesticidi
È spesso usato come intermedio per la produzione commerciale di pesticidi e pigmenti.

Soluzioni topiche
La combinazione di Zn (OH) 2 con ossido di zinco è ampiamente utilizzata in creme di calamina, unguenti, polvere per bambini, lozioni per la pelle e cosmetici. Reagisce con basi forti, a causa della sua natura anfotera per formare zincati che vengono utilizzati come farmaci orali per il trattamento di diversi disturbi.
Batterie elettriche
E ‘ utilizzato anche in batterie elettriche ad alta energia che sono ricaricabili attraverso una reazione reversibile.
Gomma compounding
Zn (OH)2 è utilizzato in compounding o miscelazione diversi ingredienti di gomma per ottimizzare le proprietà di uso finale, in base alle esigenze del consumatore.
Composti di zinco
Un’ampia varietà di composti di zinco come l’ossido di zinco, il solfato di zinco e il nitrato di zinco sono prodotti commercialmente con l’aiuto della sostanza chimica inorganica.
Idrossido di zinco MSDS
È generalmente non infiammabile e non presenta pericoli per i lavoratori. Tuttavia, il composto non deve essere assaggiato o ingerito in quanto potrebbe contenere pochi ingredienti tossicologici.