jest to nieorganiczny związek chemiczny występujący naturalnie jako minerał Rzadki. Może rozpuszczać się równomiernie w roztworze mocnego kwasu lub zasady i jest nazywany Związkiem amfoterycznym. W warunkach wodnych związek dysocjuje na jony cynku i wodorotlenku.
identyfikacja wodorotlenku cynku
numer CAS: 20427-58-1
PubChem: 9812759
ChemSpider: 7988510
wzór wodorotlenku cynku
jego wzór chemiczny to ZN (OH)2.
właściwości wodorotlenku cynku
oto niektóre z unikalnych właściwości związku:
wygląd
ogólnie pojawia się jako białe ciało stałe.
Masa molowa
waży około 99,424 g/mol.
stabilność
jest stabilny i niereaktywny w normalnych warunkach.
gęstość
jego masa na objętość wynosi około 3,053 g/cm3.
temperatura topnienia
rozkłada się w temperaturze 125 stopni Celsjusza.
Rozpuszczalność
jest słabo rozpuszczalny w wodzie i absolutnie nierozpuszczalny w alkoholu. Jego iloczyn rozpuszczalności (Ksp) wynosi 3,0 x 10-17.
rozpuszczanie
wodorotlenek cynku rozpuszcza się w wodnym amoniaku, tworząc bezbarwny, rozpuszczalny w wodzie kompleks amminowy. Gdy amoniak jest dodawany w nadmiarze, jony wodorotlenkowe, które dysocjują z Zn(OH)2, reagują z nim, tworząc dodatnio naładowany kompleks tetra o liczbie Koordynacyjnej 4. Otrzymany produkt jest otoczony przez ligand amoniaku, co powoduje rozpuszczenie.
termochemia wodorotlenku cynku
jego standardowa entalpia tworzenia lub standardowe ciepło tworzenia wynosi -642 kJ.mol-1.
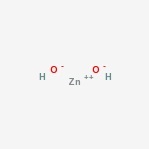
struktura wodorotlenku cynku
oto struktura związku amfoterycznego.
występowanie wodorotlenku cynku
występuje jako trzy minerały ziem rzadkich: Wulfingit, ashoweryt i sweetit. Te rzadkie minerały są w rzeczywistości naturalnymi polimorfami Zn (OH) 2. W naukach o materiałach każdy stały materiał jest polimorficzny, jeśli istnieje w więcej niż jednej formie, takiej jak ortomorficzny lub tetragonalny.
preparat wodorotlenku cynku
zwykle wytwarza się go przez dodanie umiarkowanej ilości roztworu wodorotlenku sodu do roztworu soli cynku, takiego jak chlorek cynku lub siarczan cynku. Te dwa związki reagują w normalnych warunkach, tworząc biały osad Zn (OH) 2. W tej reakcji należy użyć rozcieńczonego roztworu wodorotlenku sodu, aby zapobiec rozpuszczaniu się związku nieorganicznego. W normalnych warunkach sól cynku dysocjuje, tworząc jon cynku, który łączy się z dwoma jonami wodorotlenku z roztworu wodorotlenku sodu, tworząc wodorotlenek cynku.
Zn2++ 2oh- → ZN(OH)2
Jeśli do roztworu soli dodaje się nadmiar wodorotlenku sodu, wytrącony początkowo osad Zn (OH)2 rozpuści się, tworząc bezbarwny roztwór jonu cynkanu, jak widać poniżej:
Zn (OH)2 + 2oh– → ZN(OH)42-
Ta właściwość wodorotlenku cynku jest szeroko stosowana do wykrywania obecności jonów cynku w roztworze. Nie jest to jednak unikalna metoda testowania, ponieważ istnieje wiele związków aluminium i ołowiu, które zachowują się w bardzo podobny sposób.
właściwość rozpuszczania wodorotlenku cynku może przyczyniać się do obecności ligandów wodnych, które normalnie otaczają jon. Gdy do roztworu dodaje się nadmiar wodorotlenku sodu, dwa jony wodorotlenkowe redukują go do ujemnie naładowanego kompleksu, czyniąc go rozpuszczalnym.
zastosowanie wodorotlenku cynku
niektóre z powszechnych zastosowań Zn (OH)2 TO:
opatrunki chirurgiczne
jest stosowany do opatrunków chirurgicznych, w których działa jako absorbent. Duże bandaże, które są używane po operacji są pokryte Związkiem cynku do wchłaniania krwi z rany.
powłoka ochronna
Stal i żelazo są najczęściej nakładane z powłoką cynkową w procesie zwanym galwanizacją. W wilgotnych warunkach na galwanizowanych metalach tworzy się warstwa wodorotlenku cynku, aby zapobiec ich rdzewieniu.
zaprawa
wodorotlenek cynku jest bardzo żelatynowy (galaretowaty) i ogólnie działa jako zaprawa, która ustawia barwniki na różnych tkaninach lub tkankach. Barwnik jest na ogół odczynnikiem chemicznym, który tworzy kompleks metalowy z Zn (OH) 2 i silnie przyczepia się do wykładzin tkaninowych.
pestycydy
jest często stosowany jako półprodukt do komercyjnej produkcji pestycydów i pigmentów.

miejscowe rozwiązania
połączenie Zn (OH)2 z tlenkiem cynku jest szeroko stosowane w kremach kalaminowych, maściach, proszku dla niemowląt, balsamach do skóry i kosmetykach. Reaguje z silnymi zasadami, ze względu na swój amfoteryczny charakter, tworząc cynkaty, które są stosowane jako leki doustne w leczeniu kilku zaburzeń.
Baterie Elektryczne
jest również stosowany w wysokoenergetycznych bateriach elektrycznych, które można ładować w reakcji odwracalnej.
mieszanie gumy
Zn (OH)2 jest wykorzystywany do mieszania lub mieszania różnych składników gumy w celu optymalizacji właściwości końcowego zastosowania, zgodnie z potrzebami konsumenta.
związki cynku
szeroka gama związków cynku, takich jak tlenek cynku, siarczan cynku i azotan cynku, jest wytwarzana komercyjnie za pomocą nieorganicznej substancji chemicznej.
wodorotlenek cynku MSDS
jest na ogół niepalny i nie stanowi zagrożenia dla pracowników. Jednak związek nie powinien być smakowany ani połykany, ponieważ może zawierać niewiele składników toksykologicznych.