Es un compuesto químico inorgánico que existe naturalmente como un mineral raro. Se puede disolver por igual en una solución de ácido o base fuerte y se llama compuesto anfótero. En condiciones acuosas, el compuesto se disocia en iones de zinc e hidróxido.
Zinc, hidróxido de Identificación
número CAS: 20427-58-1
PubChem: 9812759
ChemSpider: 7988510
Zinc, hidróxido de Fórmula
Su fórmula química es Zn (OH)2.
Propiedades del hidróxido de zinc
Las siguientes son algunas de las propiedades únicas del compuesto:
Apariencia
Generalmente aparece como un sólido blanco.
masa Molar
pesa alrededor de 99.424 g/mol.
Estabilidad
es estable y no reactivo bajo condiciones normales.
Densidad
Su masa por volumen es de alrededor de 3,053 g / cm3.
Punto de fusión
Se descompone a 125 grados Celsius.
Solubilidad
es escasamente soluble en agua y absolutamente insoluble en alcohol. Su producto de solubilidad (Ksp) es de 3,0 x 10-17.
Disolución
El hidróxido de zinc se disuelve en amoníaco acuoso para formar un complejo de aminas incoloro y soluble en agua. Cuando se agrega amoníaco en exceso, los iones hidróxido que se disocian de Zn(OH)2 reaccionan con él para formar un complejo tetra cargado positivamente con un número de coordinación de 4. El producto resultante está rodeado por un ligando de amoníaco, lo que resulta en disolución.
Termoquímica de hidróxido de zinc
Su entalpía estándar de formación o calor estándar de formación es de -642 kJ.mol-1.
Estructura de hidróxido de zinc
Aquí está la estructura del compuesto anfótero.
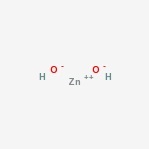
Presencia de hidróxido de zinc
Se presenta como tres minerales de tierras raras: Wulfingita, ashoverita y sweetita. Estos minerales raros son en realidad los polimorfos naturales de Zn (OH) 2. En la ciencia de los materiales, cualquier material sólido es polimórfico si existe en más de una forma, como ortorrómbico o tetragonal.
Preparación de hidróxido de zinc
Generalmente se prepara agregando una cantidad moderada de solución de hidróxido de sodio a una solución de sal de zinc, como cloruro de zinc o sulfato de zinc. Estos dos compuestos reaccionan en condiciones normales para formar un precipitado blanco de Zn (OH) 2. En esta reacción se debe utilizar una solución diluida de hidróxido de sodio para evitar que el compuesto inorgánico se disuelva. En condiciones normales, la sal de zinc se disocia para formar un ion de zinc que se asocia con dos iones de hidróxido de solución de hidróxido de sodio para formar hidróxido de zinc.
Zn2++ 2OH – → Zn (OH)2
Si se agrega un exceso de hidróxido de sodio a la solución salina, el precipitado de Zn (OH)2 que se forma inicialmente se disolverá para formar una forma de solución incolora de iones de cinc como se ve a continuación:
Zn (OH)2 + 2OH– → Zn(OH)42-
Esta propiedad del hidróxido de zinc se usa ampliamente para detectar la presencia de iones de zinc en la solución. Sin embargo, no es un método único para probar, ya que hay muchos compuestos de aluminio y plomo que se comportan de una manera muy similar.
La propiedad de disolución del hidróxido de zinc puede contribuir a la presencia de ligandos de agua que normalmente rodean al ion. Cuando se agrega un exceso de hidróxido de sodio a la solución, los dos iones de hidróxido la reducen a un complejo con carga negativa, lo que la hace soluble.
Usos de hidróxido de zinc
Algunos de los usos comunes de Zn (OH)2 son:
Apósitos quirúrgicos
Se utiliza para apósitos quirúrgicos donde funciona como absorbente. Los vendajes grandes que se usan después de la cirugía se cubren con el compuesto de zinc para absorber la sangre de la herida.
Revestimiento protector
El acero y el hierro se aplican con mayor frecuencia con un revestimiento de zinc a través de un proceso llamado galvanización. En condiciones húmedas, se forma una capa de hidróxido de zinc en estos metales galvanizados para evitar que se oxiden.
Mordiente
El hidróxido de zinc es muy gelatinoso (gelatinoso) y generalmente funciona como mordiente que fija tintes en varias telas o tejidos. El tinte es generalmente un reactivo químico, que forma un complejo metálico con Zn (OH)2 y se adhiere fuertemente a los forros de la tela.
Pesticidas
A menudo se usa como intermediario para la producción comercial de pesticidas y pigmentos.

Soluciones tópicas
La combinación de Zn (OH)2 con óxido de zinc se usa ampliamente en cremas de calamina, ungüentos, polvos para bebés, lociones para la piel y cosméticos. Reacciona con bases fuertes, debido a su naturaleza anfótera para formar cincados que se utilizan como medicamentos orales para tratar varios trastornos.
Baterías eléctricas
También se utiliza en baterías eléctricas de alta energía que son recargables a través de una reacción reversible.
Compuesto de caucho
Zn (OH)2 se utiliza para componer o mezclar diferentes ingredientes de caucho para optimizar las propiedades de uso final, de acuerdo con las necesidades del consumidor.
Compuestos de zinc
Una amplia variedad de compuestos de zinc como óxido de zinc, sulfato de zinc y nitrato de zinc se fabrican comercialmente con la ayuda de la sustancia química inorgánica.
Hidróxido de zinc MSDS
Generalmente no es inflamable y no representa ningún peligro para los trabajadores. Sin embargo, el compuesto no debe probarse ni tragarse, ya que puede contener pocos ingredientes toxicológicos.