je to anorganická chemická sloučenina, která přirozeně existuje jako vzácný minerál. Může se rozpustit rovnoměrně v roztoku silné kyseliny nebo báze a nazývá se amfoterní sloučenina. Za vodných podmínek se sloučenina disociuje na ionty zinku a hydroxidu.
Zinek sodný Identifikace
číslo CAS: 20427-58-1
PubChem: 9812759
ChemSpider: 7988510
Zinku hydroxidu Vzorec
Jeho chemický vzorec je Zn (OH)2.
vlastnosti hydroxidu zinečnatého
níže jsou uvedeny některé z jedinečných vlastností sloučeniny:
vzhled
obecně se jeví jako bílá pevná látka.
molární hmotnost
váží kolem 99.424 g / mol.
stabilita
je stabilní a nereaktivní za normálních podmínek.
hustota
jeho hmotnost na objem je kolem 3.053 g / cm3.
teplota tání
rozkládá se při 125 stupních Celsia.
rozpustnost
je mírně rozpustný ve vodě a absolutně nerozpustný v alkoholu. Jeho produkt rozpustnosti (Ksp) je 3,0 x 10-17.
rozpouštění
hydroxid zinečnatý se rozpouští ve vodném amoniaku za vzniku bezbarvého, ve vodě rozpustného amminového komplexu. Když čpavek se přidává v přebytku, hydroxidu ionty, které se odloučí od Zn(OH)2 reaguje s to tvořit kladně nabité tetra komplex s koordinačním číslem 4. Výsledný produkt je obklopen amoniakovým ligandem, což má za následek rozpuštění.
termochemie hydroxidu zinečnatého
jeho standardní entalpie tvorby nebo standardní teplo tvorby je -642 kJ.mol-1.
struktura hydroxidu zinečnatého
zde je struktura amfoterní sloučeniny.
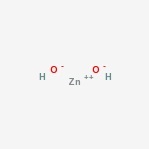
Zinku hydroxidu Výskyt
vyskytuje se jako tři minerálů vzácných zemin: Wulfingite, ashoverite a sweetite. Tyto vzácné minerály jsou ve skutečnosti přirozenými polymorfy Zn (OH)2. V materiálové vědě, pevný materiál, je polymorfní, pokud existuje ve více než jedné formě, jako orthorhombic nebo tetragonal.
přípravek hydroxidu zinečnatého
obecně se připravuje přidáním mírného množství roztoku hydroxidu sodného do roztoku soli zinku, jako je chlorid zinečnatý nebo síran zinečnatý. Tyto dvě sloučeniny reagují za normálních podmínek za vzniku bílé sraženiny Zn (OH)2. Při této reakci by měl být použit zředěný roztok hydroxidu sodného, aby se zabránilo rozpuštění anorganické sloučeniny. Za normálních podmínek se zinková sůl disociuje za vzniku iontu zinku, který se spojuje se dvěma hydroxidovými ionty z roztoku hydroxidu sodného za vzniku hydroxidu zinečnatého.
Zn2++ 2OH- → Zn(OH)2,
Pokud se přebytek hydroxidu sodného se přidá do roztoku soli, sraženina Zn (OH)2, který je tvořen zpočátku se rozpustí formu tvoří bezbarvý roztok zincate ion, jak je vidět níže:
Zn (OH)2 + 2OH– → Zn(OH)42-
Tato vlastnost zinku sodný je široce používán k detekci přítomnosti zinkových iontů v roztoku. Nejedná se však o jedinečnou metodu testování, protože existuje mnoho sloučenin hliníku a olova, které se chovají velmi podobným způsobem.
rozpustná vlastnost hydroxidu zinečnatého může být přispěna k přítomnosti vodních ligandů, které normálně obklopují iont. Při přebytku hydroxidu sodného se přidá do roztoku, dva hydroxidu ionty snížení na záporně nabitý komplex, čímž je rozpustný.
Zinku hydroxidu Použití
Některé běžné použití Zn (OH)2 jsou:
Chirurgické obvazy
používá se pro chirurgické obvazy, kde funguje jako absorpční. Velké obvazy, které se používají po operaci, jsou potaženy sloučeninou zinku pro absorpci krve z rány.
ochranný povlak
ocel a železo se nejčastěji nanášejí povlakem zinku procesem zvaným galvanizace. Za vlhkých podmínek se na těchto pozinkovaných kovech vytvoří vrstva hydroxidu zinečnatého, aby se zabránilo jejich zrezivění.
Mordant
hydroxid zinečnatý je velmi želatinový (rosolovitý) a obecně funguje jako mordant, který nastavuje barviva na různé tkaniny nebo tkáně. Barvivo je obecně chemické činidlo, které tvoří kovový komplex Se Zn (OH)2 a silně se váže na textilní obložení.
pesticidy
často se používá jako meziprodukt pro komerční výrobu pesticidů a pigmentů.

Aktuální řešení
Kombinace Zn (OH)2, oxid zinečnatý je široce používán v calamine krémy, masti, dětský pudr, pleť pleťové vody a kosmetiku. Reaguje se silnými základy, vzhledem k jeho amfoterní charakter tvoří zinečnatany, který se používá jako perorální léky k léčbě několika poruch.
elektrické baterie
používá se také ve vysokoenergetických elektrických bateriích, které se dobíjejí reverzibilní reakcí.
gumová směs
Zn (OH)2 se používá při míchání nebo míchání různých složek pryže pro optimalizaci vlastností konečného použití podle potřeby spotřebitele.
sloučeniny zinku
široká škála sloučenin zinku, jako je oxid zinečnatý, síran zinečnatý a dusičnan zinečnatý, se komerčně vyrábí pomocí anorganické chemikálie.
MSDS hydroxidu zinečnatého
je obecně nehořlavý a nepředstavuje žádné nebezpečí pro pracovníky. Sloučenina by však neměla být ochutnávána ani spolknuta, protože může obsahovat málo toxikologických složek.