C’est un composé chimique inorganique qui existe naturellement sous forme de minéral rare. Il peut se dissoudre également dans une solution d’acide fort ou de base et s’appelle un composé amphotère. Dans des conditions aqueuses, le composé se dissocie en ions zinc et hydroxyde.
Identification de l’hydroxyde de zinc
Numéro CAS: 20427-58-1
PubChem: 9812759
ChemSpider: 7988510
Formule de l’hydroxyde de zinc
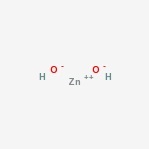
Sa formule chimique est Zn (OH) 2 .
Propriétés de l’hydroxyde de zinc
Voici quelques-unes des propriétés uniques du composé:
Apparence
Il apparaît généralement sous la forme d’un solide blanc.
Masse molaire
Elle pèse environ 99,424 g/mol.
Stabilité
Il est stable et non réactif dans des conditions normales.
Densité
Sa masse volumique est d’environ 3,053 g/cm3.
Point de fusion
Il se décompose à 125 degrés Celsius.
Solubilité
Il est peu soluble dans l’eau et absolument insoluble dans l’alcool. Son produit de solubilité (Ksp) est de 3,0 x 10-17.
Dissolution
L’hydroxyde de zinc se dissout dans l’ammoniaque pour former un complexe d’ammine incolore et soluble dans l’eau. Lorsque de l’ammoniac est ajouté en excès, les ions hydroxydes qui se dissocient de Zn (OH) 2 réagissent avec lui pour former un complexe tétra chargé positivement ayant un nombre de coordination de 4. Le produit résultant est entouré d’un ligand ammoniacal, ce qui entraîne une dissolution.
Thermochimie de l’hydroxyde de zinc
Son enthalpie de formation standard ou chaleur de formation standard est de -642 kJ.mol-1.
Structure de l’hydroxyde de zinc
Voici la structure du composé amphotère.
Occurrence de l’hydroxyde de zinc
Il se présente sous la forme de trois minéraux de terres rares: la Wulfingite, l’ashoverite et la sweetite. Ces minéraux rares sont en fait les polymorphes naturels de Zn(OH)2. En science des matériaux, tout matériau solide est polymorphe s’il existe sous plus d’une forme telle que orthorhombique ou tétragonale.
Préparation d’hydroxyde de zinc
Il est généralement préparé en ajoutant une quantité modérée de solution d’hydroxyde de sodium à une solution de sel de zinc telle que le chlorure de zinc ou le sulfate de zinc. Ces deux composés réagissent dans des conditions normales pour former un précipité blanc de Zn(OH)2. Une solution diluée d’hydroxyde de sodium doit être utilisée dans cette réaction afin d’empêcher le composé inorganique de se dissoudre. Dans des conditions normales, le sel de zinc se dissocie pour former un ion zinc qui s’associe à deux ions hydroxyde de la solution d’hydroxyde de sodium pour former de l’hydroxyde de zinc.
Zn2++ 2OH-→ Zn(OH)2
Si un excès d’hydroxyde de sodium est ajouté à la solution saline, le précipité de Zn(OH)2 formé initialement se dissoudra pour former une solution incolore d’ion zincate comme on le voit ci–dessous:
Zn(OH)2 + 2OH-→ Zn(OH) 42-
Cette propriété de l’hydroxyde de zinc est largement utilisée pour détecter la présence d’ions zinc en solution. Cependant, ce n’est pas une méthode unique pour tester car il existe de nombreux composés d’aluminium et de plomb qui se comportent de manière très similaire.
La propriété de dissolution de l’hydroxyde de zinc peut contribuer à la présence de ligands d’eau qui entourent normalement l’ion. Lorsque l’excès d’hydroxyde de sodium est ajouté à la solution, les deux ions hydroxyde la réduisent en un complexe chargé négativement, le rendant ainsi soluble.
Utilisations de l’hydroxyde de zinc
Certaines des utilisations courantes de Zn(OH) 2 sont:
Pansements chirurgicaux
Il est utilisé pour les pansements chirurgicaux où il fonctionne comme un absorbant. Les gros bandages utilisés après la chirurgie sont recouverts du composé de zinc pour absorber le sang de la plaie.
Revêtement protecteur
L’acier et le fer sont le plus souvent appliqués avec un revêtement de zinc par un processus appelé galvanisation. Dans des conditions humides, une couche d’hydroxyde de zinc se forme sur ces métaux galvanisés afin d’éviter qu’ils ne rouillent.
Mordant
L’hydroxyde de zinc est très gélatineux (ressemblant à de la gelée) et fonctionne généralement comme un mordant qui fixe les colorants sur divers tissus ou tissus. Le colorant est généralement un réactif chimique, qui forme un complexe métallique avec Zn (OH) 2 et se fixe fortement aux doublures de tissu.
Pesticides
Il est souvent utilisé comme intermédiaire pour la production commerciale de pesticides et de pigments.

Solutions topiques
La combinaison de Zn (OH) 2 avec de l’oxyde de zinc est largement utilisée dans les crèmes à la calamine, les onguents, la poudre pour bébé, les lotions pour la peau et les cosmétiques. Il réagit avec des bases fortes, en raison de sa nature amphotère pour former des zincates qui sont utilisés comme médicaments oraux pour traiter plusieurs troubles.
Batteries électriques
Il est également utilisé dans les batteries électriques à haute énergie rechargeables par réaction réversible.
Compoundage du caoutchouc
Le Zn(OH)2 est utilisé pour compounder ou mélanger différents ingrédients du caoutchouc afin d’optimiser les propriétés d’utilisation finale, en fonction des besoins du consommateur.
Composés du zinc
Une grande variété de composés du zinc comme l’oxyde de zinc, le sulfate de zinc et le nitrate de zinc sont fabriqués commercialement à l’aide de la substance chimique inorganique.
Fiche signalétique de l’hydroxyde de zinc
Il est généralement ininflammable et ne présente aucun danger pour les travailleurs. Cependant, le composé ne doit pas être goûté ou avalé car il peut contenir peu d’ingrédients toxicologiques.