Het is een anorganische chemische verbinding die van nature bestaat als een zeldzaam mineraal. Het kan eveneens oplossen in een oplossing van sterk zuur of base en wordt een amfotere verbinding genoemd. Onder waterachtige omstandigheden dissocieert de verbinding in zink-en hydroxideionen.
Zinkhydroxideidentificatie
CAS-nummer: 20427-58-1
PubChem: 9812759
ChemSpider: 7988510
Zinkhydroxideformule
de chemische formule is Zn (OH)2.
Zinkhydroxideeigenschappen
enkele van de unieke eigenschappen van de verbinding zijn:
voorkomen
Het komt over het algemeen voor als een witte vaste stof.
Molaire massa
het weegt ongeveer 99,424 g / mol.
stabiliteit
Het is stabiel en niet-reactief onder normale omstandigheden.
dichtheid
de massa per volume is ongeveer 3,053 g / cm3.
smeltpunt
het ontleedt bij 125 graden Celsius.
Oplosbaarheid
Het is matig oplosbaar in water en absoluut onoplosbaar in alcohol. Het oplosbaarheidsproduct (Ksp) is 3,0 x 10-17.
oplossen
zinkhydroxide lost op in waterige ammoniak tot een kleurloos, in water oplosbaar ammijncomplex. Wanneer er teveel ammoniak wordt toegevoegd, reageren de hydroxide-ionen die van Zn(OH)2 scheiden ermee om een positief geladen tetra-complex te vormen met een coördinatiegetal van 4. Het resulterende product wordt omgeven door ammoniak ligand, wat resulteert in ontbinding.
Zinkhydroxidethermochemie
De standaardthalpie van de vorming of standaardwarmte van de vorming is -642 kJ.mol-1.
Zinkhydroxidestructuur
Hier is de structuur van de amfotere verbinding.
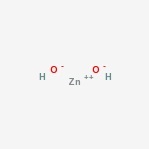
zinkhydroxide voorkomen
Het komt voor als drie zeldzame aardmineralen: Wulfingiet, ashoveriet en sweetiet. Deze zeldzame mineralen zijn eigenlijk de natuurlijke polymorfen van Zn (OH)2. In de materiële wetenschap is elk vast materiaal polymorf als het in meer dan één vorm bestaat, zoals orthorhombisch of tetragonaal.
Zinkhydroxidepreparaat
Het wordt gewoonlijk bereid door een matige hoeveelheid natriumhydroxideoplossing toe te voegen aan een zinkzoutoplossing zoals zinkchloride of zinksulfaat. Deze twee verbindingen reageren onder normale omstandigheden en vormen een witte neerslag van Zn (OH)2. Bij deze reactie moet een verdunde natriumhydroxideoplossing worden gebruikt om te voorkomen dat de anorganische verbinding oplost. Onder normale omstandigheden dissocieert het zinkzout om een zinkion te vormen dat met twee hydroxide-ionen uit natriumhydroxideoplossing wordt geassocieerd om zinkhydroxide te vormen.
Zn2++ 2OH – → Zn (OH)2
als een teveel aan natriumhydroxide wordt toegevoegd aan de zoutoplossing, zal het neerslag van Zn (OH)2 dat aanvankelijk wordt gevormd, oplossen tot een kleurloze oplossing van zinkion zoals hieronder te zien is:
Zn(OH)2 + 2OH– → Zn (OH)42-
Deze eigenschap van zinkhydroxide wordt uitgebreid gebruikt om de aanwezigheid van zinkionen in oplossing te detecteren. Echter, het is niet een unieke methode voor het testen als er veel verbindingen van aluminium en lood die zich gedragen op een zeer vergelijkbare manier.
de oplossende eigenschap van zinkhydroxide kan bijdragen tot de aanwezigheid van waterliganden die normaal gesproken het ion omringen. Wanneer overtollig natriumhydroxide aan de oplossing wordt toegevoegd, verminderen de twee hydroxideionen het tot een negatief geladen complex, waardoor het oplosbaar wordt.
Zinkhydroxidegebruik
enkele veel voorkomende toepassingen van Zn (OH)2 zijn:
chirurgische verbanden
Het wordt gebruikt voor chirurgische verbanden waar het als absorberend middel functioneert. Grote verbanden die na de operatie worden gebruikt, worden gecoat met de zinkverbinding voor het absorberen van het bloed uit de wond.
beschermende coating
staal en ijzer worden meestal aangebracht met een coating van zink door middel van een proces dat galvanisatie wordt genoemd. Onder vochtige omstandigheden vormt zich een laag zinkhydroxide op deze gegalvaniseerde metalen om te voorkomen dat ze verroest raken.
bijtmiddel
zinkhydroxide is zeer geleiachtig (geleiachtig) en werkt over het algemeen als een bijtmiddel dat kleurstoffen op verschillende stoffen of weefsels zet. Kleurstof is over het algemeen een chemisch reagens, dat een metaalcomplex vormt met Zn(OH)2 en zich sterk hecht aan de voeringen van de stof.
pesticiden
Het wordt vaak gebruikt als tussenproduct voor de commerciële productie van pesticiden en pigmenten.

topische oplossingen
combinatie van Zn (OH)2 met zinkoxide wordt veel gebruikt in calaminecrèmes, zalven, babypoeder, huidlotions en cosmetica. Het reageert met sterke basissen, wegens zijn amfotere aard om zincates te vormen die gebruik als mondelinge drugs zijn om verscheidene wanorde te behandelen.
elektrische batterijen
Het wordt ook gebruikt in hoog-energetische elektrische batterijen die oplaadbaar zijn door een omkeerbare reactie.
Rubbercompounding
Zn (OH)2 wordt gebruikt bij het compounderen of mengen van verschillende rubberbestanddelen om de eindgebruikseigenschappen te optimaliseren, afhankelijk van de behoefte van de consument.
zinkverbindingen
grote verscheidenheid aan zinkverbindingen zoals zinkoxide, zinksulfaat en zinknitraat worden commercieel vervaardigd met behulp van de anorganische chemische stof.
zinkhydroxide MSDS
Het is over het algemeen onbrandbaar en vormt geen gevaar voor de werknemers. De verbinding mag echter niet worden geproefd of ingeslikt, omdat het weinig toxicologische ingrediënten kan bevatten.