det er en uorganisk kjemisk forbindelse som naturlig eksisterer som et sjeldent mineral. Det kan oppløses like i en løsning av sterk syre eller base og kalles en amfotert forbindelse. Under vandige forhold dissosierer forbindelsen til sink-og hydroksidioner.
Sink hydroksid Identifikasjon
CAS nummer: 20427-58-1
PubChem: 9812759
ChemSpider: 7988510
Sink hydroksid Formel
dens kjemiske formel Er Zn (OH)2.
Sinkhydroksydegenskaper
følgende er noen av de unike egenskapene til forbindelsen:
Utseende
Det vises vanligvis som et hvitt fast stoff.
Molar masse
den veier rundt 99.424 g / mol.
Stabilitet
den er stabil og ikke-reaktiv under normale forhold.
Tetthet
dens masse per volum er rundt 3,053 g / cm3.
Smeltepunkt
det dekomponerer ved 125 Grader Celsius.
Løselighet
det er sparsomt løselig i vann og helt uoppløselig i alkohol. Løselighetsproduktet (Ksp) er 3,0 x 10-17.
Oppløsning
Sinkhydroksyd oppløses i vandig ammoniakk for å danne et fargeløst, vannløselig amminkompleks. Når ammoniakk tilsettes i overskudd, reagerer hydroksidioner som dissosierer Fra Zn(OH)2 med det for å danne et positivt ladet tetra-kompleks med et koordinasjonsnummer på 4. Det resulterende produktet er omgitt av ammoniakkligand, noe som resulterer i oppløsning.
Sinkhydroksyd Termokjemi
dens standard entalpi av dannelse eller standard varme av dannelse er -642 kJ.mol-1.
Sinkhydroksydstruktur
her er strukturen av den amfotere forbindelsen.
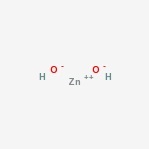
Sinkhydroksidforekomst
Det forekommer som tre sjeldne jordmineraler: Wulfingitt, ashoveritt og søtitt. Disse sjeldne mineralene er faktisk de naturlige polymorfene Til Zn (OH)2. I materialvitenskap er ethvert fast materiale polymorf hvis det finnes i mer enn en form som orthorhombic eller tetragonal.
Sinkhydroksydpreparat
det fremstilles vanligvis ved å tilsette moderat mengde natriumhydroksydoppløsning til en sinksaltløsning som sinkklorid eller sinksulfat. Disse to forbindelsene reagerer under normale forhold for å danne et hvitt bunnfall Av Zn (OH)2. Fortynn oppløsning av natriumhydroksyd bør brukes i denne reaksjonen for å forhindre at den uorganiske forbindelsen oppløses. Under normale forhold dissosierer sinksaltet for å danne en sinkion som forbinder med to hydroksidioner fra natriumhydroksidoppløsning for å danne sinkhydroksyd.
Zn2++ 2oh- → Zn(OH)2
hvis overskudd av natriumhydroksid tilsettes til saltoppløsningen, vil bunnfallet Av ZN (OH)2 som dannes i utgangspunktet oppløses for å danne en fargeløs løsning av sinkation som vist nedenfor:
Zn (OH)2 + 2OH– → Zn(OH)42-
denne egenskapen til sinkhydroksyd brukes i stor grad til å oppdage tilstedeværelsen av sinkioner i oppløsning. Det er imidlertid ikke en unik metode for testing, da det er mange forbindelser av aluminium og bly som oppfører seg på en veldig lignende måte.
oppløsningsegenskapen til sinkhydroksyd kan bidra til tilstedeværelsen av vannligander som normalt omgir ion. Når overflødig natriumhydroksyd tilsettes til løsningen, reduserer de to hydroksydioner det til et negativt ladet kompleks, noe som gjør det løselig.
Sinkhydroksid Bruker
Noen av de vanlige bruksområdene Til Zn (OH)2 er:
Kirurgiske bandasjer
Det brukes til kirurgiske bandasjer hvor Det fungerer som en absorberende. Store bandasjer som brukes etter kirurgi er belagt med sinkforbindelsen for å absorbere blodet fra såret.
Beskyttende belegg
Stål og jern brukes oftest med et belegg av sink gjennom en prosess som kalles galvanisering. Under fuktige forhold dannes et lag sinkhydroksyd på disse galvaniserte metaller for å hindre at de blir rustet.
Mordant
Sinkhydroksid er veldig gelatinøst (geleaktig) og fungerer generelt som en mordant som setter fargestoffer på forskjellige stoffer eller vev. Fargestoff er generelt et kjemisk reagens, som danner et metallkompleks Med Zn (OH)2 og festes sterkt til stoffforingene.
Pesticider
Det brukes ofte som mellomprodukt for kommersiell produksjon av plantevernmidler og pigmenter.

Aktuelle løsninger
Kombinasjon Av Zn (OH)2 med sinkoksid er mye brukt i calamine kremer, salver, babypulver, hudkrem og kosmetikk. Det reagerer med sterke baser, på grunn av sin amfotere natur for å danne sink som brukes som orale legemidler for å behandle flere lidelser.
Elektriske batterier
det brukes også i høy-energi elektriske batterier som er oppladbare gjennom en reversibel reaksjon.
gummi compounding
Zn (OH)2 benyttes i compounding eller blande forskjellige ingredienser av gummi for å optimalisere sluttbruk egenskaper, i henhold til forbrukerens behov.
Sinkforbindelser
Bredt utvalg av sinkforbindelser som sinkoksid, sinksulfat og sinknitrat produseres kommersielt ved hjelp av uorganisk kjemikalie.
Sinkhydroksid MSDS
Det er generelt ikke brennbart og utgjør ingen fare for arbeiderne. Forbindelsen bør imidlertid ikke smakes eller svelges, da den kan inneholde få toksikologiske ingredienser.