Protège la cellule et maintient sa forme, les bactéries peuvent être classées en fonction de leur type de paroi cellulaire:
Les parois Gram positives sont épaisses et peu lipidiques.
Les parois Gram négatives sont beaucoup plus minces, avec deux couches. Certaines bactéries ont une couche visqueuse de polysaccharides et de polypeptides, leur permettant de se fixer aux objets et de les protéger.
ribosomes des années 70
Ils sont destinés à la synthèse des protéines. Ils sont plus petits que les ribosomes des années 80 dans les cellules eucaryotes. Flagelle une autre caractéristique facultative est une projection qui se déplace pour permettre à la cellule de se déplacer. Une cellule peut avoir plusieurs flagelles disposés autour d’elle.
Matière nucléaire
Une masse repliée d’ADN et d’ARN, également appelée zone nucléaire, contenant tous les gènes nécessaires aux fonctions vitales. Les plasmides sont des anneaux supplémentaires de matériel génétique qui ne sont pas essentiels à la cellule et contiennent souvent des gènes de résistance aux antibiotiques.
Mésosome
Un envahissement de la membrane qui est le site de la respiration (comme une mitochondrie) – sa forme améliore la surface. L’existence du mésosome est contestée et la plupart des scientifiques pensent qu’il s’agit d’une erreur dans la technique du microscope électronique.
De plus, les bactéries possèdent une structure cruciale entourant la cellule entière, le peptidoglycane (PG), qui forme un sacculus autour de la cellule bactérienne, est un polymère essentiel de la paroi cellulaire car l’interférence avec sa synthèse ou sa structure entraîne une perte de forme et d’intégrité cellulaire suivie d’une mort bactérienne.
La couche de peptidoglycane telle que représentée à la figure 2 est constituée d’une matrice de chaînes polysaccharidiques composées de fractions de sucre N-acétylmuramique (MurNAc) alternées (italiques) de l’acide N-acétylglucosamine (GlcNAc) réticulées par des chaînes latérales pentapeptidiques.
Classification
Hans christian gram, Un microbiologiste danois, avait développé les taches de Gram afin de visualiser plus facilement les bactéries au microscope. Sur la base du schéma de coloration, les bactéries pathogènes ont été classées en deux catégories principales, à savoir., bactéries Gram (+) et Gram (–). Une vue schématique de la paroi cellulaire après coloration de Gram est illustrée à la figure 3.
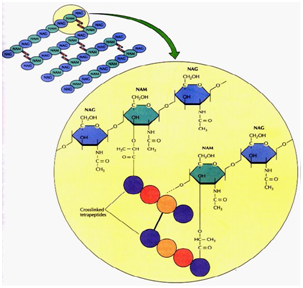
Figure 2: Couche de peptidoglycane.
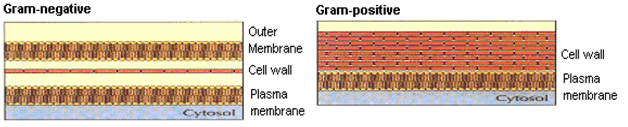
Figure 3: Paroi cellulaire Gram+ Ve et Gram-Ve.
La paroi cellulaire des bactéries gram(+), bien que suffisamment complexe, est plus simple que celle des organismes Gram(-). À l’extérieur de la cellule se trouve un ensemble de déterminants antigéniques qui aident à adhérer à une cellule cible particulière. La barrière suivante est la paroi cellulaire, couche spongieuse formant un gel, c’est-à-dire couche de peptidoglycane externe à la membrane cytoplasmique et représente 50% du poids sec de la bactérie. Sous cette couche se trouve la membrane cellulaire cytoplasmique lipoïdale, par exemple Staphylocoques aureus, Streptocoques pneumoniae, Bacillus subtilis.
Avec le gram (-) : Bactéries, la paroi cellulaire est plus complexe et plus lipoïdale. Ces cellules contiennent généralement une membrane externe supplémentaire, qui contient des lipopolysaccharides complexes qui codent les réponses antigéniques. En dessous se trouve, moins impressionnante, une couche de peptidoglycane suivie d’une membrane cytoplasmique riche en phospholipides. par ex. Escherichia Coli, Haemophilus influenzae, Pseudomonas aeruginosa.
Les microorganismes sont un groupe d’organismes qui comprend des organismes vivants (ex. b) Bactéries, champignons, protozoaires, algues, etc.) ainsi que des organismes non vivants (ex. (v) Virus).
Bactéries: Les bactéries sont des organismes unicellulaires présents dans la nature sur tous les êtres vivants et non vivants à des températures allant de moins de zéro (psychrophiles) à jusqu’à 1000C (thermophiles). Les bactéries sont classées en fonction de la forme de la cellule, de la température dans laquelle elles se développent, sur la base du groupe de cellules, en fonction de la perméabilité et de la coloration. Sur le terrain de la coloration, ils sont en outre classés comme Gram positif (Gram + ve) et Gram négatif (Gram-ve). Les bactéries à Gram positif présentent une couleur violette et les bactéries à Gram négatif une couleur rose dans une procédure appelée coloration à Gram développée par C. Gram. Sur la base de la pathogénicité, la classification est une maladie / infection pathogène causant, c’est-à-dire infectieuse et non pathogène – non infectieuse. En chimie médicinale, cette classification est importante.
Champignons: Les champignons sont de distribution universelle. Beaucoup sont terrestres et prospèrent mieux dans le sol. Certains vivent dans des tissus de plantes et d’animaux tandis que le reste se trouve dans des endroits aquatiques. De nombreux champignons poussent sur les aliments tels que le pain, les confitures, les cornichons, les fruits et les légumes. Les champignons sont de nature saprophyte et parasitaire. Les saprophytes poussent sur la matière organique morte, tandis que les parasites vivent sur les corps vivants d’autres animaux. Les champignons parasites comprennent Candida albicans qui est l’agent causal de la candidose.
Protozoaires: Les protozoaires sont des animalcules minuscules et acellulaires sans tissus et organes ayant un ou plusieurs noyaux. Ils vivent librement ou restent en association avec des animaux et des plantes. Certains protozoaires de nature parasitaire comprennent l’amibe à l’origine de l’amibiase et le Plasmodium à l’origine du paludisme.
Virus: Les virus sont des micro-organismes acellulaires qui sont des parasites obligatoires intracellulaires. Ils occupent une position entre le vivant et le non-vivant. Les virus sont spécifiques à l’hôte et dépendent d’hôtes comme les plantes, les animaux et les bactéries pour leur survie. Les virus sont des parasites intracellulaires inhérents aux cellules vivantes. ex. M. la poliomyélite provoque la poliomyélite, le VIH provoque le SIDA.
Infections par des microbes pathogènes: De nombreux microorganismes ou microbes sont pathogènes pour les plantes, les animaux et la vie humaine, causant diverses maladies entraînant une mortalité et une morbidité importantes. Les microbes pathogènes sont des microorganismes responsables de maladies infectieuses. Ces organismes impliqués comprennent des bactéries pathogènes, causant des maladies telles que la peste, la tuberculose et l’anthrax; les protozoaires, provoquant des maladies telles que le paludisme, la maladie du sommeil et la toxoplasmose; et aussi des champignons causant des maladies telles que la teigne, les candidoses ou l’histoplasmose. Cependant, d’autres maladies telles que la grippe, la fièvre jaune ou le sida sont causées par des virus pathogènes, qui ne sont pas des organismes vivants. Les bactéries pathogènes contribuent à d’autres maladies d’importance mondiale telles que la pneumonie causée par le Streptocoque et le Pseudomonas et les maladies d’origine alimentaire, qui peuvent être causées par des bactéries telles que Shigella, Campylobacter et Salmonella. Les bactéries pathogènes provoquent également des infections telles que le tétanos, la fièvre typhoïde, la diphtérie, la syphilis et la lèpre. Chaque espèce parasite a une interaction caractéristique avec ses hôtes. Microorganismes comme les espèces de staphylocoques ou de streptocoques qui causent des infections cutanées pneumonie, méningite et autres formes d’infections de surface. D’autre part, de nombreux organismes font partie de la flore normale du corps humain qui existe sur la peau, le nez, les voies urinaires, l’intestin, etc. sans causer de maladie. Mais parfois, ceux-ci sont devenus des parasites opportunistes et ont conduit à des infections. Les parasites intracellulaires obligatoires tels que la rickettésie et la Chlamydia ne peuvent se développer et se reproduire qu’à l’intérieur des cellules hôtes. Certaines espèces telles que Pseudomonas aeruginosa, Burkholderia cenocepacia et Mycobacterium avium sont parasitaires lorsqu’un individu souffre de cellules de suppression immunitaire ou de fibrose kystique. Le développement de nouveaux agents thérapeutiques pour traiter ou combattre ces infections / micro-organismes infectieux est un processus continu en médecine clinique. Avec l’avènement des souches résistantes aux antibiotiques, la synthèse de nouveaux médicaments est devenue l’un des principaux objectifs des chercheurs du monde entier.
Agents antifongiques: Un agent antifongique est un médicament, des produits chimiques ou d’autres substances qui éliminent sélectivement les agents pathogènes fongiques d’un hôte avec une toxicité minimale pour l’hôte, qui se trouve le plus souvent sur la peau, les cheveux et les ongles. Le champignon est un organisme eucaryote qui est classé comme un règne distinct des plantes, des animaux et des bactéries. Les champignons contiennent des formes unicellulaires, multinucléées et multicellulaires ils sont classés sur la base de leurs spores reproductrices et de la nature des hyphes. Ils se divisent sexuellement ou asexuellement ou dans les deux sens. Les champignons sont presque entièrement multicellulaires à l’exception de la levure Saccharomyces cerviseae qui est un champignon unicellulaire important. Les champignons sont hétérotrophes et tirent leur énergie d’un autre organisme, vivant ou mort. Les champignons sont des protista eucaryotes différents des bactéries à bien des égards, car ils possèdent une paroi cellulaire rigide contenant de la chitine, du mannane, d’autres polysaccharides et leur membrane cytoplasmique contient du stérol. La principale différence entre les cellules fongiques et les cellules végétales est que les parois des cellules fongiques contiennent de la chitine, tandis que les plantes contiennent de la cellulose.
Les agents antifongiques sont classés selon leur mode d’interférence avec:
- Synthèse de la paroi cellulaire,
- Intégrité de la membrane plasmique,
- Synthèse des acides nucléiques,
- Fonction ribosomique (Figure 4).
La classification des médicaments antifongiques se fait sur leur mode d’action, à savoir,
- Médicaments antifongiques systémiques:
- Antibiotiques polyènes: Amphotéricine B.
- Dérivés azolés: (Imidazole: Kétoconazole, Miconazole; Triazole: Fluconazole, Itraconazole, Voriconazole, Posaconazole, Ravuconazole).
Échinocandine : Capsofungine, Anidulafungine, Micafungine. Antimétabolite : Flucytosine (5-FCEN). Nikkomycine. Médicaments antifongiques topiques: Antibiotiques polyéniques: Amphotéricine B, Nystatine, Hamycine, Natamycine, Rimocidine, Hitachimycine, Philippine. Calme: Clotrimazole, Kétoconazole, Miconazole, Éconazole, Butaconazole, Oxiconazole, Sulconazole, Fenticonazole, Isoconazole, Bifonazole, Terconazole. Qui: Tolnaftate, Acide undécyclinique, Povidone iodée, Triacétine, Violet de Gentiane, thiosulfate de sodium, Cicloporoxolamine, Acide benzoïque, Quinidochlore.
- Antifongiques systémiques pour les infections superficielles:
- benzofuranes hétérocycliques: Corticofunvine, Griséofulvine.
- Allylamine : Terbinafine, Butenafine, Naftifine.
Mycologie: La discipline de la biologie qui est consacrée à l’étude des champignons est connue sous le nom de mycologie. La mycologie s’intéresse à l’étude systématique des champignons, y compris leurs propriétés génétiques et biochimiques. Les mycoses affectant les humains peuvent être divisées en quatre groupes en fonction du niveau de pénétration dans les tissus du corps.
- Mycoses superficielles: Causées par des champignons ne poussant que sur la surface la plus externe de la peau ou des cheveux. Un exemple d’infection fongique est le Tinea Versicolor, une infection fongique qui affecte généralement la peau des jeunes, en particulier la poitrine, le dos, le haut des bras et des jambes.
- Mycoses cutanées ou dermatomycoses: Causée par des champignons ne poussant que dans les couches superficielles de la peau, des ongles et des cheveux, provoquant des infections communément appelées pied d’athlète, démangeaison du jock et teigne.
- Mycoses sous-cutanées: Causées par des champignons pénétrant sous la peau dans le tissu sous-cutané, conjonctif et osseux. La plus fréquente est la sporotrichose, qui survient chez les jardiniers et les agriculteurs qui entrent en contact direct avec le sol.
- Mycoses systémiques ou profondes: Sont causées par des agents pathogènes fongiques primo-pathogènes et opportunistes. Les champignons pathogènes primaires provoquent une infection chez un hôte normal; alors que les agents pathogènes opportunistes nécessitent un hôte dépresseur immunitaire pour établir une infection (par exemple, cancer, chirurgie et sida). Les agents pathogènes primaires ont généralement accès à l’hôte par les voies respiratoires et comprennent Coccidioides immitis, Histoplasma capsulatum, Blastomyces dermatitidis et Paracoccidioides brasiliensis. Les champignons opportunistes envahissent par les voies respiratoires et alimentaires, et comprennent Cryptococcus neoformans, Candida spp., Aspergillus spp., Penicillium marneffei, Zygomycètes, Trichosporon beigelii et Fusarium spp.
Mycologie – champignons pathogènes: L’étude des champignons pathogènes est appelée mycologie médicale. Les champignons pathogènes provoquent des maladies chez l’homme ou d’autres organismes. Les champignons pathogènes couramment observés sont enrôlés ci-dessous,
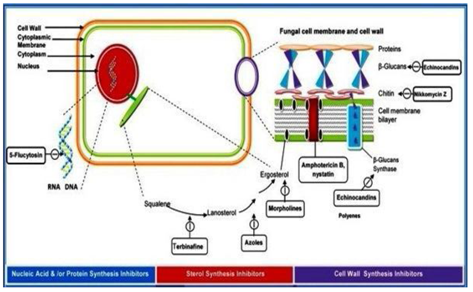
Figure 4: Classification des agents antifongiques par leur mode d’action.
Candida: Les espèces de candida sont des agents pathogènes humains importants causant des infections opportunistes chez des hôtes immunodéprimés (malades du sida, patients cancéreux et patients transplantés). Les infections causées par l’espèce Candida sont difficiles à traiter et pourraient être fatales. Les espèces de Candida représentent à elles seules 30 à 40% des cas de décès causés par les infections systémiques. Les espèces fongiques du genre Candida vivent généralement en commun sur et dans le corps humain. Il y a une augmentation du développement de la résistance aux médicaments par les espèces de Candida aux thérapies actuelles, ce qui motive les chercheurs à comprendre leur génétique et à découvrir de nouvelles cibles thérapeutiques.
Aspergillus: Les spores d’Aspergillus aérosolisées se trouvent presque partout autour de l’être humain et ne présentent généralement pas de problèmes de santé. Mais Aspergillus est encore capable de provoquer des maladies de trois manières majeures: par la production de mycotoxines; par l’induction de réponses allergènes; et enfin par les infections localisées ou systémiques. Aspergillus flavus produit des mycotoxines, l’aflatoxine qui peut agir à la fois comme toxine et comme cancérigène, ayant la capacité de contaminer les denrées alimentaires telles que les noix.
Cryptococcus:La majorité des espèces de Cryptococcus se trouvent dans le sol et ne causent généralement pas de maladies chez l’homme. L’exception est le Cryptococcus neoformans qui provoque des maladies chez les patients immunodéprimés comme le SIDA, provoquant une forme sévère de méningite et de méningo-encéphalite.
Histoplasma: Histoplasma capsulatum peut provoquer une histoplasmose chez l’homme, le chien et le chat. L’infection est généralement due à l’inhalation de l’air contaminé et est répandue.
Pneumocystis: Pneumocystis jirovecii peut provoquer une forme de pneumonie chez les personnes dont le système immunitaire est affaibli, telles que les personnes âgées, les patients atteints du sida et les enfants nés prématurés.
Stachybotrys: Stachybotrys chartarum peut causer des lésions respiratoires et des maux de tête sévères, dans les maisons qui sont constamment humides.
Infection fongique importante dans des maladies particulières: L’association des champignons les plus courants avec le patient souffrant de la maladie particulière est indiquée ci-dessous,
- Espèces de Candida, espèces d’Aspergillus, espèces de Phycomyces: Leucopénie.
- Zygomycètes, Rhizopus, Mucor, Absidia: Diabète.
- Candida, Cryptococcus, Histoplasmes: Tumeurs malignes et maladie de Hodgkin.
- Candida, Cryptococcus, Histoplasmes: SIDA.
Champignons cliniquement significatifs et le site qu’ils affectent: La pathogénicité et la virulence des champignons responsables des infections, chez l’homme, est une préoccupation majeure dans le monde clinique qui se concentre sur les principaux agents responsables de la maladie, en particulier Candida, Cryptococcus et Aspergillus spp. La grande diversité de champignons potentiellement nocifs existant en dehors de ces groupes, bien que rares, peut encore avoir le potentiel d’être plus important que les champignons cliniques courants. Le site affecté par les champignons cliniquement significatifs sont enrôlés comme ci-dessous,
- Malassezia furfur et Exophiala werneckii: Superficial skin.
- Piedraia hortae and Trichosporon beigelii: Hair.
- Microsporum species: Skin and hair.
- Epidermophyton species: Skin and nails.
- Trichophyton species: Skin, hair and nails.
- Sporothrix schenckii, Cladosporium species: Chromoblastomycosis.
- Histoplasma capsulatum, Penicillium species: Systemic respiratory.
- Blastomyces dermatitidis: Subcutaneous/respiratory.
- Cryptococcus neoformans: Respiratory/CNS.
Antifungal resistance: Le développement de la résistance aux médicaments chez les champignons est un concept large, qui décrit l’échec du traitement antifongique actuel pour vaincre l’infection fongique. Les thérapies antifongiques sont conçues pour éradiquer les infections fongiques par divers mécanismes d’action, comme en perturbant leurs capacités de reproduction, en détruisant les parois cellulaires ou en modifiant l’ADN fongique et en modifiant le fonctionnement cellulaire. La résistance antifongique est traditionnellement classée en trois types
- Primaire (intrinsèque),
- Secondaire (acquise),
- Résistance clinique.
Au cours de la dernière décennie, les microorganismes deviennent résistants aux médicaments à un rythme beaucoup plus rapide que le taux de découverte de nouveaux médicaments. La résistance aux médicaments des champignons est importunément observée chez les patients dont le système immunitaire est faible et souffrant de maladies telles que le SIDA et le cancer. Les chercheurs sont donc confrontés à un défi majeur pour développer de nouveaux antifongiques, sûrs et plus efficaces en tenant compte de l’augmentation des infections opportunistes chez l’hôte immunodéprimé. Cela peut être surmonté par la découverte de nouveaux médicaments agissant par de nouveaux mécanismes d’action.
Perspective historique: En 1903, de Beurmann et Gougerot ont été les premiers à discuter de l’utilisation de l’iodure de potassium pour traiter la sporotrichose. Whitfield en 1907 a traité les infections fongiques superficielles en utilisant une pommade. Au milieu des années 1940, des sulfamides ont été utilisés pour traiter la mycose paracoccidioido bien qu’ils aient une efficacité limitée en ce qui concerne les propriétés fongistatiques et nécessitent des temps plus longs pour le traitement avec un taux de rechute élevé. Cela a été suivi par l’utilisation commerciale de la pénicilline dans les années 1940. En succession rapide, vint la découverte et le développement de la streptomycine en 1944 et du Benzimidazole le premier azole à avoir une activité antifongique notable a été découvert en 1944. Elle a été suivie par les découvertes du chloramphénicol en 1947 et de la chlortétracycline en 1948. En 1948, l’Hydroxystilbamidine, un agent antiprotozoaire à action antifongique a été utilisé pour traiter la blastomycose. En 1951, Hazen et Brown ont découvert le premier antibiotique polyène appelé nystatine, polyène topique et oral couramment utilisé. En 1952, les composés benzimidazoles substitués ont des propriétés antifongiques. Les macrolides ont été développés en 1952 ayant des propriétés bactériostatiques. En 1956, Gold et coll. a rapporté les propriétés antifongiques du polyène amphotéricine B, qui était le premier antifongique systémique significativement efficace. C’est devenu la norme et bientôt il a remplacé l’hydroxy stilbamidine. L’amphotéricine B a bénéficié du statut privilégié de seul agent antifongique disponible pour traiter les mycoses systémiques pendant près de dix ans, contre lequel de nouveaux traitements contre les mycoses systémiques ont été comparés. En 1957, la Flucytosine a été développée comme agent antifongique qui n’avait pas réussi à fournir des résultats favorables pour l’utilisation comme agent cytostatique. L’utilisation de la glucytosine en tant que monodrogue a souvent développé une résistance fongique qui a conduit à une utilisation en combinaison avec l’amphotéricine B pour surmonter la résistance. Le premier agent antifongique oral important, la griséofulvine, a été développé en 1958, qui est devenu disponible pour le traitement des mycoses superficielles. Avant la griséofulvine, le traitement des dermatophytoses superficielles n’était que par les médicaments topiques qui n’étaient pas particulièrement efficaces contre la Tinée capite et l’onychomycose. Les pénicillines semi-synthétiques, les Céphalosporines et les glycopeptides ont été développés à partir de 1958. Le développement du Chlormidazole sous forme de crème à 5% en 1958 a été bénéfique sur une large gamme de mycoses cutanées. Dans les années 1960, le thiabendazole et le mébendazole ont des propriétés antifongiques et antihelminthiques. En 1969, les imidazoles, le clotrimazole et le miconazole ont été introduits, bientôt suivis par l’éconazole en 1974. Les allylamines découvertes en 1974 sont les autres classes d’antifongiques qui ont un impact significatif sur la thérapie antifongique en particulier pour les dermatomycoses superficielles, y compris l’onychomycose. Le kétoconazole a été développé en 1977 et est depuis devenu la norme parmi les azoles. Au milieu des années 1980, deux triazoles à large spectre disponibles par voie orale, le Fluconazole (1982) et l’Itraconazole (1984), ont été découverts. Des recherches intensives ont commencé entre 1990 et 1999 pour développer de nouveaux agents antifongiques et ont abouti à l’introduction de trois azoles Voriconazole (2000), Posaconazole (2005)-Schering-Plough, Ravuconazole (2007) et de trois nouvelles échinocandines (Caspofungine (2002) Anidulafungine (2004), Micafungine (2006) pour leur utilisation clinique.