US Pharm. 2017; 42(1):HS16-HS20.
Abstrakti: Neuromuskulaarisilla salpaajilla (Nmbas) on tärkeä rooli useiden sairaalapotilaiden hoidossa. Nmbas: n farmakologia on hyvin ymmärretty, mutta näiden aineiden käyttö voi olla kiistanalaista. NMBAs ovat yleisiä kirurgisissa tilanteissa ja nopea sekvenssi intubaatio, mutta muut merkit, kuten akuutti hengitysvaikeusoireyhtymä, terapeuttinen hypotermia, ja kohonnut kallonsisäinen paine, ovat jonkin verran jakavia. On tärkeää, että farmaseutit tuntevat NMBAs: n käytön kliiniset vaikutukset ja tulokset. Lisäksi on tärkeää ymmärtää samanaikaisia näkökohtia, kuten sedaatio, seuranta, ja kääntyminen. Sairaalaympäristössä toimivien farmaseuttien on tunnettava äskettäin hyväksytty Uusi sugammadeksi (Bridion).
Neuromuskulaarisilla salpaajilla (Nmbas) on tärkeä rooli useiden sairaalapotilaiden hoidossa. Sen lisäksi, että nmbas käytetään rutiininomaisesti kirurgisessa nukutuksessa, se voi olla arvokas monissa uusissa ja kehittyvissä kriittisissä hoitotilanteissa. Siksi on tärkeää, että sairaala-apteekkari perehtyy nmba: n käyttöön ja kääntymiseen liittyviin kliinisiin vaikutuksiin ja tuloksiin.
farmakologia
NMBAs: t käyttävät farmakologisia vaikutuksiaan moduloimalla signaalinvälitystä luurankolihaksissa. Toimintapotentiaalit (sähköisen potentiaalin muutokset, jotka liittyvät impulssin kulkemiseen lihaksen tai hermosolun kalvoa pitkin), jotka saavuttavat luurankolihaksen, aktivoivat asetyylikoliinin vapautumisen Moottorin päätylevyihin. Asetyylikoliini sitoutuu loppupään nikotiinireseptoreihin, jolloin Na+ (natrium) vapautuu lihassyihin, mikä laukaisee lihasten toimintapotentiaalin. Tämän jälkeen kalsiumionit vapautuvat sarkoplasmiseen retikulumiin, jolloin myosiini sitoutuu aktiiniin. Myosiini sitoutuu ja liikkuu aktiinipaikkoja pitkin lyhentäen sarkomeeria niin kauan kuin solussa on kalsiumia. NMBAs toimii kahdella tavalla estää tämän prosessin.
depolarisoivat NMBAs: t toimivat agonisteina nikotiinireseptoreissa.1 ne pitävät auki ioni-aidatut kanavat, mikä johtaa lihasten fasciculation kunnes ionipotentiaali on tyhjentynyt, ja sitten halvaantumiseen.2 Sukkinyylikoliini on ainoa depolarisoiva nmba saatavilla. Nondepolarisoivat NMBAs: t ovat nikotiinireseptoreissa kilpailevia antagonisteja, jotka estävät asetyylikoliinin motor endplatessa.1 Tämä estää toimintapotentiaalia leviämästä, jolloin lihassolut eivät reagoi motorisiin hermoimpulsseihin. Lihasten halvaantuminen tapahtuu peräkkäin alkaen pienistä, nopeasti nykivistä lihaksista silmissä ja kurkunpäässä ja etenee raajoihin, kärsään, hengitysteihin, välisistä lihaksista ja palleaan. Toipuminen neuromuskulaarisesta tukoksesta tapahtuu päinvastaisessa järjestyksessä.2
asetyylikoliiniin kohdistuvien mekanististen vaikutustensa vuoksi NMBAs-valmisteilla on monia haittavaikutuksia. Asetyylikoliinilla on rooli histamiinin vapautumisessa, muskariinisessa aktivaatiossa, vagolyyttisessä vaikutuksessa ja noradrenaliinin vapautumisessa. Tämän seurauksena niiden käytön yhteydessä on havaittu haittavaikutuksia, kuten takykardiaa ja bradykardiaa, hypertensiota ja hypotensiota sekä bronkodilaatiota ja bronkospasmia (taulukko 1).
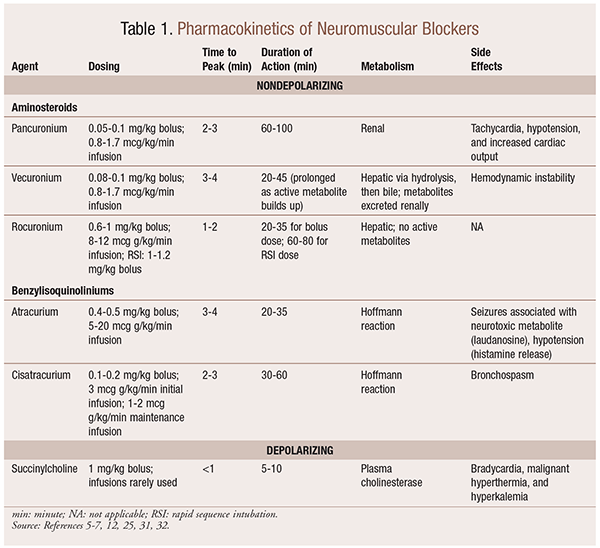
farmakokinetiikka
tilanteesta riippuen on hyödyllistä, että NMBA: ta valittaessa on käytettävissä erilaisia kineettisiä profiileja. Nopea alkaminen ja lyhyt kesto ovat hyödyllisiä käyttöaiheissa, kuten nopea sekvenssinen intubaatio (RSI), kun taas pidempiaikaiset ovat arvokkaampia leikkauksissa. KS. taulukko 1, jossa on lyhyt kuvaus kineettisistä profiileista, mukaan lukien annostus ja yleiset haittavaikutukset.
kliininen käyttö
kirurginen: Nmba: t ovat olleet anestesiologian ja kirurgian katkottuja sen jälkeen, kun suksinyylikoliini otettiin käyttöön vuonna 1952.3-7 aineen ja annostuksen valinta vaihtelee suuresti riippuen kirurgisesta toimenpiteestä ja myös vaihtoehtoisten aineiden käytöstä, mukaan lukien yleisanestetiikka, paikallispuudutus ja suonensisäinen sedaatio. Ensisijainen huolenaihe nmbas: n kirurgisessa käytössä on saavuttaa asianmukaiset lihasten salpauksen tasot aiheuttamatta kardiovaskulaarisia haittavaikutuksia tai pidentämättä salpauksen kokonaiskestoa yli kirurgisen toimenpiteen keston.4 vaikka tämän artikkelin soveltamisalan ulkopuolelle jää täydellinen keskustelu aineen valinnasta ja annostelusta kirurgisissa käyttöaiheissa, näiden vaikutusten kliinistä kääntämistä käsitellään. Potilaan, joka on saanut keskivaikutteisen tai pitkävaikutteisen NMBA: n kirurgisen toimenpiteen aikana, kliiniseen seurantaan tulee kuulua ääreishermostimulaation (PNS) testaus (käsitellään myöhemmin).1,4
RSI: RSI on emergentti prosessi, jota käytetään epävakaan potilaan hengitysteiden turvaamiseen. RSI-protokolliin kuuluu syvän sedaation induktiolääkkeen (esim.propofolin, etomidaatin, midatsolaamin) antaminen lähes samanaikaisesti NMBA: n kanssa. Toivottu lopputulos on, että potilaalle kehittyy sekä amnestinen sedaatio että syvällinen lihasrelaksaatio, mikä parantaa onnistuneen intubaation todennäköisyyttä.8.9 sopivien lääkeaineiden valinnan tulee perustua lääkeainekohtaiseen farmakokinetiikkaan ja potilaskohtaisiin kliinisiin muuttujiin.
ihanteellinen RSI-lääkeaine on lääke, jolla on sekä nopea puhkeaminen että nopea offset, mikä lyhentää aikaa antamisesta intubaatioon ja myös lyhentää halvaantumisen kokonaiskestoa.10 pitkä viive lääkkeen alkamisessa lisää potilaan yleistä hypoksian riskiä. Kun alkamisaika pitenee, viimeisen pussin kautta tapahtuvan hengityksen ja ensimmäisten endotrakeaaliputken kautta suoritettavien hengenvetojen välillä täytyy kulua enemmän aikaa. Halvauksen pidentynyt kesto lisää epäonnistuneen intubaation riskiä.10,11 sukkinyylikoliinin nopean elpymisen sijaan pitkäkestoiset aineet, kuten rokuronium, voivat vaatia hengitystukea yli 90 minuuttia.12
vuonna 2015 julkaistu laaja Cochrane-katsaus osoitti, että sukkinyylikoliini oli rokuroniumiin verrattuna parempi suotuisissa intubaatio-olosuhteissa. Nämä löydökset todennäköisesti heijastavat suksinyylikoliinin suotuisaa kineettistä profiilia.13 kliinisessä käytännössä on kuitenkin olemassa useita tärkeitä vasta-aiheita suksinyylikoliinin käytölle. Potilailla, joilla on ollut pahanlaatuinen hypertermia tai joilla on suuri riski sairastua hyperkalemiaan, rokuronium on edelleen elinkelpoinen RSI-aine.
kriittinen hoito
akuutti hengitysvaikeusoireyhtymä (Ards): yksi ARDS-oireyhtymää sairastavien potilaiden ensisijaisista kliinisistä huolenaiheista on vähentää keuhkoihin kohdistuvaa painetta ja stressiä, mikä vähentää ylimääräistä tulehdusta alkuperäisen vaurion tai loukkauksen lisäksi. Koska ne vaikuttavat kalvosävyyn, nmbas: ia on ehdotettu menetelmäksi hengityskoneen asynkronian ja keuhkopaineiden vähentämiseksi. Englanninkielisiä primaaritutkimuksia on julkaistu kolme, joissa arvioitiin NMBAs: n käyttöä ARDS: n alkuvaiheessa.14-16 jokainen tutkimus osoitti lisääntynyttä hapetusta potilailla, joita hoidettiin varhain 48 tuntia kestävällä sisatrakurium-jatkuvalla infuusiolla. Vuoden 2013 meta-analyysi näiden tutkimusten yhdistetyistä tiedoista osoitti, että sisatrakuriumin varhainen anto vähensi barotraumaa (P = .02) ja laski sairaalakuolleisuutta (P = .005), mutta ei vaikuttanut koneellisen ilmanvaihdon kestoon (P =.57).
näiden havaintojen perusteella on järkevää harkita NMBAs-hoitoa akuutin ARDS: n hoidossa potilailla, jotka tulevat teho-osastolle.4 vaikka kaikkien ei-depolarisoivien NMBAs: ien vaikutusmekanismin pitäisi edistää ehdotettua kliinisen hyödyn mekanismia ARDS: ssä, julkaistuissa satunnaistetuissa, kontrolloiduissa tutkimuksissa sisatrakuriumia käytettiin vain interventionaaliryhmässä. Kirjallisuudessa ei ole käsitelty sitä, vaikuttaisivatko muut aineet näihin tuloksiin.
terapeuttinen hypotermia: NMBAs-hoitoa on ehdotettu osana monia hoitoalgoritmeja potilaille, joilla on terapeuttinen hypotermia sydänpysähdyksen jälkeen.18 säätelemällä vapinaa NMBAs voi vähentää kokonaishapenkulutusta. Vaikka tätä ei ole tutkittu kriittisessä hoidossa, nämä fysiologiset muutokset on osoitettu leikkauspotilailla, joille tehdään hypotermia kardiopulmonaalisen ohitusleikkauksen aikana.19, 20 retrospektiivisessä tutkimuksessa, johon osallistui 111 terapeuttista hypotermiaa saanutta potilasta (18 NMBA: lla ja 93 ilman), sairaalassa elossaolo parani (P = .004), joka säilyi merkitsevänä mahdollisten lähtötilanteen sekoittajien monimuuttujaanalyysin jälkeen (95%: n luottamusväli, 1, 56-33, 38).Myös potilailla, jotka saivat jatkuvaa NMBA-hoitoa, havaittiin suuntaus kohti laktaattipuhdistuman ja toiminnallisten hoitotulosten paranemista.
toinen retrospektiivinen tutkimus käsitteli NMBAs: n valikoimaa potilailla, joilla oli terapeuttinen hypotermia sydänpysähdyksen jälkeen.22 monimuuttuja-analyysillä tutkijat vertasivat 201 potilasta, jotka saivat terapeuttista hypotermiaa (29, 9% sisatrakuriumia ja 17, 9% vekuroniumia). Sisatrakurium oli ainoa riippumaton positiivinen eloonjäämisen ennustaja, jolla oli hyvä neurologinen tulos (P = .014). Tämän tutkimuksen retrospektiivisen luonteen ja pienen otoskoon vuoksi on vaikea arvioida vekuronin tarjoaman mahdollisen eron havaitsemisen kokonaistehoa, joka on samanlainen kuin sisatrakuriumilla. On mahdollista, että sekoittavilla muuttujilla voi olla suurempi vaikutus kuin valitulla neuroblokkaatuotteella kokonaistuloksiin.22
kohonnut kallonsisäinen paine (ICP): ICP: tä hoidetaan rutiininomaisesti syvällä sedaatiolla ja analgesialla, mikä vähentää hapenkulutusta ja aivojen aineenvaihduntaa samalla kun se kontrolloi kipua, liikettä ja hengityskoneen asynkroniaa.2 nmbas: n lisäämistä harkitaan vain silloin, kun syvä sedaatio ei riitä ICP: n vaarallisen lisääntymisen hallintaan, mikä on usein seurausta yskimisestä, imemisestä tai värisemisestä.2,12 varhaisen NMBA: n käytön on osoitettu vähentävän kuolleisuutta, mutta lisäävän sairastuvuutta. Hsiang ja kollegat tarkastelivat takautuvasti 514 potilaan kohorttia traumaattisen kooman tietopankista arvioidakseen nmba: n varhaisen, pidennetyn käytön ja lyhytaikaisen NMBA: n käytön. Teho-osastolla oleskelu oli keskimäärin 3 päivää pidempi, useammalle potilaalle kehittyi keuhkokuume, ja pitkittynyttä NMBA-hoitoa saaneilla potilailla verenmyrkytyksen riski kasvoi. Lisäksi, vaikka nmba-ryhmässä oli enemmän kuolemia, nmba-ryhmässä oli enemmän vegetatiivisia tai vaikeasti vammaisia eloonjääneitä.23 NMBAs: n käyttö lisääntyneessä ICP: ssä aiheuttaa merkittäviä vaikeuksia neurologisen toiminnan ja kohtausten seurannassa.24
Käänteislääkkeet
vaikka melko harvinaista teho-osastolla, NMBAs: n kumoaminen on tärkeä osa halvauspotilaiden kirurgista hoitoa. Aiemmin tämä on tapahtunut, kun neostigmiinia on käytetty leikkauksen jälkeen.4 Neostigmiini on asetyylikoliiniesteraasin estäjä (ACheI), joka vähentää asetyylikoliinin hajoamista Moottorin päätylevyssä aiheuttaen asetyylikoliinin pitoisuuden suurenemisen. Koska Ei-depolarisoivat Nmbat ovat nikotiinireseptorin kilpailevia antagonisteja, neostigmiini lisää asetyylikoliinin kilpailupainetta lääkkeen vaikutuskohdassa. Vaikka neostigmiini parantaa tehokkaasti NMBA-hoidon jälkeistä toipumisaikaa, se voi olla epäluotettava epäsuoran vaikutusmekanismin vuoksi.4, 25 Jos NMBA-pitoisuus on riittävän suuri, antagonismia ei voida voittaa annetusta antikoliiniesteraasiannoksesta riippumatta. Jos NMBAs-oireyhtymää ei pystytä täysin kääntämään leikkauksen jälkeen, on osoitettu, että jäännösheikkous ja dysfagia lisääntyvät ja aspiraatioriski kasvaa.4, 25 lisäksi neostigmiinilla on omia haittavaikutuksia, koska se vaikuttaa sekä nikotiini-että muskariinireseptoreihin. Nmba estää nikotiinireseptorin toimintaa, kun taas neostigmiinin vaikutus muskariinireseptoriin lisää bronkospasmeja, mahalaukun motiliteettia, eritteitä ja bradykardiaa.Näiden riskien vähentämiseksi neostigmiinin kanssa on käytettävä antimuskariiniagonistia, kuten atropiinia tai glykopyrrolaattia, kompensoimaan lisääntynyttä muskariiniaktivaatiota.
joulukuussa 2015 FDA hyväksyi sugammadeksin (Bridion), joka on uusi rokuronin ja vekuronin suora käänteislääke. Gammasyklodekstriiniksi luokiteltu sugammadeksi muodostaa vapaan NMBA: n kanssa lääkeainekompleksin, jolloin käytettävissä olevat lääkeainepitoisuudet pienenevät. Nämä farmakokineettiset vaikutukset NMBA-pitoisuuteen ovat sekä nopeita että täydellisiä. Kokonsa vuoksi sugammadeksi ei kuitenkaan vaikuta sisatrakuuriin, atrakuuriin eikä sukkinyylikoliiniin.Sugammadeksista saatava ensisijainen hyöty verrattuna neostigmiiniin on kääntymisnopeus (2 minuuttia vs. 17 minuuttia).27 toisin kuin Acheisilla, sugammadeksilla ei ole kattovaikutusta, ts.riittävän suurella sugammadeksiannoksella mikä tahansa syvyyshalvaus voidaan nopeasti kääntää päinvastaiseksi.26,28 sugammadeksin käytöllä ei ole farmakodynaamista vaikutusta muskariinireseptoreihin, mikä vähentää merkittävästi lääkkeen sivuvaikutusprofiilia ja välttää tarpeen käyttää samanaikaisesti antimuskariinisia aineita. Sugammadeksin annostus perustuu hermo-lihasliitosta salpaavan vaikutuksen tasoon: Kohtalaista salpausta käytettäessä 2 mg/kg ja välitöntä salpausta käytettäessä 16 mg/kg.26, 28
sedaatio
on erittäin tärkeää huomata, että vaikka NMBAs-yhdisteet estävät lihasten liikkuvuutta, niillä ei ole vaikutusta potilaan tajunnan tasoon tai kykyyn havaita kipua tai epämukavuutta, mikä johtaa tahattomaksi tiedostamiseksi kuvattuun ilmiöön.1 joko kirurgisissa tai lääketieteellisissä käyttöaiheissa potilailla saattaa olla riski riittämättömään sedaatioon tai analgesiaan. Tapaussarja osoitti, että jopa 18% potilaista säilyttää jonkinasteisen tietoisuuden halvaantuneena.29 nämä potilaat raportoivat tuntemuksista, jotka vaihtelevat unenomaisesta tilasta eksplisiittiseen tietoisuuteen. Ei ole olemassa tutkimuksia, joissa annettaisiin erityisiä ohjeita tahattoman tietoisuuden hallintaan hermo-lihasliitoksen salpauksen aikana. Normaalina käytäntönä pidetään kuitenkin asianmukaisen kivunlievityksen ja syvän sedaation aikaansaamista ja ylläpitämistä ennen hermo-lihasliitoksen salpausta ja sen aikana.1
seuranta
NMBAs-hoitoa saavien potilaiden seuranta on välttämätöntä, mutta menetelmiä vaikeuttavat usein kliininen hoito, sedatiivien ja analgeettien samanaikainen anto ja muut terapeuttiset järjestelyt (esim.terapeuttinen hypotermia). PNS: ää pidetään yleisesti valintamenetelmänä, mutta sillä on rajoituksensa. Muita seurantamuuttujia ovat spontaani hengitys ja elintoimintojen kehitys.2
PNS: ää suositellaan itsenäisesti potilaille, jotka saavat jatkuvaa nmbas-infuusiota, ja lisänä muissa kliinisissä tilanteissa.1 orbicularis-okuliin, kyynärhermoon tai peroneaalihermoon kiinnitetty juna-of-four-laite tuottaa neljä peräkkäistä sähköärsykettä. Jos hermo-lihassalpausta ei ole, kaikille neljälle ärsykkeelle havaitaan yhtä suuri nykimisvaste, jolloin T4/T1-suhde on 1. Halvaantuneella potilaalla nykimisvaste tulisi havaita ensimmäisellä ärsykkeellä, mutta tämän pitäisi vähentyä motoneuronien salpauksen vuoksi. Tavoitteena on, että T4/T1-suhde on noin 0,25.1
komplikaatiot
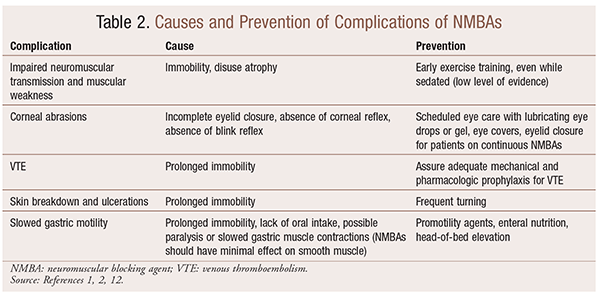
vaikka NMBAs: n käytöstä on merkittävää hyötyä erityistilanteissa, on myös lyhyt-ja pitkäaikaisia komplikaatioita. Akuutissa tilanteessa nmbas: n käyttö voi johtaa lisääntyneeseen teho-osastoon, pitkittyneeseen koneelliseen ilmanvaihtoon, laskimotromboemboliaan, ihon repimiseen ja haavaumiin, infektioon, sarveiskalvon vaurioihin ja anafylaksiaan. Pitkäaikainen anto voi johtaa liikkumattomuuteen tai pidentyneeseen toipumisaikaan heikentyneen hermo-lihasliitoksen ja lihasheikkouden vuoksi.30 useita suosituksia näiden vaikutusten ehkäisemiseksi esitetään taulukossa 2.
Conclusion
proviisorilla voi olla erittäin tärkeä rooli NMBAs-lääkkeiden säätelyssä ja käytössä monilla kliinisillä käyttökohteilla. Ymmärtämällä tämän korkean hälytysluokan lääkkeiden vaikutusmekanismin, terapeuttiset indikaatiot, kirjallisuuden ja kliinisten haittavaikutusten tukemisen apteekkihenkilökunnalla voi olla korvaamaton vaikutus potilaan hoitoon ja potilasturvallisuuteen.
1. Murray MJ, DeBlock H, Erstad B, et al. Kliinisen käytännön ohjeet pitkäkestoisen hermo-lihasliitoksen estoon kriittisesti sairaalla aikuispotilaalla. Crit Care Med. 2016;44:2079-2103.
2. Warr J, Thiboutot Z, Rose L, et al. Neuromuskulaaristen salpaajien nykyinen terapeuttinen käyttö, farmakologia ja kliiniset näkökohdat kriittisesti sairaille aikuisille. Ann Pharmacother. 2011;45:1116-1126.
3. Foldes FF, McNall PG, Borrego-Hinojosa JM. Sukkinyylikoliini: uusi lähestymistapa lihasten rentoutumiseen anestesiologiassa. N Engl J Med. 1952;247:596-600.
4. Naguib M, Lien CA. Lihasrelaksanttien ja niiden antagonistien farmakologia. Vuonna: Millerin nukutus. 7.toim. Miller RD, Eriksson LI, Fleisher LA, et al, toim. Philadelphia, PA: Churchill Livingstone; 2010.
5. Anektiini (sukkinyylikoliini) pakkausseloste. Princeton, NJ: Sandoz Inc; syyskuu 2010.
6. Rocuronium – pakkausseloste. Irvine, CA: Teva Parenteral Medicines, Inc; marraskuu 2008.
7. Nimbex (sisatrakurium) pakkausseloste. North Chicago, IL: Abbott Laboratories; 2010.
8. Sakles JC, Laurin EG, Rantapaa AA, Panacek EA. Hengitysteiden hallinta päivystyksessä; vuoden mittainen tutkimus 610 henkitorven intubaatiosta. Ann Emerg Med. 1998;31:325-332.
9. Tayal VS, Riggs RW, Marx JA, et al. Nopeasekvenssinen intubaatio ensihoidon residenssissä: onnistumisprosentti ja haittatapahtumat kahden vuoden aikana. Acad Emerg Med. 1999;6:31-37.
10. Li J, Murphy-Lavoie H, Bugas C, et al. Intubaatiokomplikaatiot halvaantumisen kanssa tai ilman. Olen Emerg Med. 1999;17:141-143.
11. Naguib M, Samarkandi AH, El-Din ME, et al. Suksinyylikoliinin annos, joka tarvitaan erinomaisiin endotrakeaalisiin intubointiolosuhteisiin. Anesth Analg. 2006;102:151-155.
12. Greenberg SB, Vender J. neuromuskulaaristen salpaajien käyttö teho-osastolla: missä olemme nyt? Crit Care Med. 2013;41:1332-1344.
13. Tran DT, Newton EK, Mount VA, et al. Rokuronium vastaan sukkinyylikoliini nopean sekvenssin induktion intubaatiossa. Cochrane Database Syst Rev. 2015; (10): CD002788.
14. Gainier M, Roch A, Forel JM, et al. Neuromuskulaaristen salpaajien vaikutus kaasun vaihtoon potilailla, joilla on akuutti hengitysvaikeusoireyhtymä. Crit Care Med. 2004;32:113-119.
15. Forel JM, Roch A, Marin V, et al. Neuromuskulaariset salpaajat heikentävät tulehdusvastetta potilailla, joilla on akuutti hengitysvaikeusoireyhtymä. Crit Care Med. 2006;34:2749-2757.
16. Papazian L, Forel JM, Gacouin A, et al. Neuromuskulaariset salpaajat varhaisen akuutin hengitysvaikeusoireyhtymän hoidossa. N Engl J Med. 2010;363:1107-1116.
17. Alhazzani W, Alshahrani M, Jaeschke R, et al. Neuromuscular blocking agents in acute respiratory distress syndrome: a systemic review and meta-analysis of randomized controlled trials. Crit Care. 2013; 17: R43.
18. Chamorro C, Borrallo JM, Romera MA, et al. Anestesian ja analgesian protokolla terapeuttisen hypotermian aikana sydänpysähdyksen jälkeen: systemaattinen katsaus. Anesth Analg. 2010;110:1328-1335.
19. Cruise C, MacKinnon J, Tough J, Houston P. Meperidiinin ja pankuronin Vertailu sydänleikkauksen jälkeisen vapinan hoitoon. Can Anaesth. 1992;39:563-568.
20. Sladen RN, Berend JZ, Fassero JS, et al. Vekuronin ja meperidiinin vertailu hypotermisen kardiopulmonaalisen ohitusleikkauksen jälkeisen vapinan kliinisistä ja metabolisista vaikutuksista. J Cardiothorac Vasc Anesth. 1995;9:147-153.
21. Salciccioli JD, Cocchi MN, Rittenberger JC, et al. Jatkuva hermo-lihassalpaus on yhteydessä alentuneeseen kuolleisuuteen sydänpysähdyksen jälkeisillä potilailla. Elvytys. 2013;84:1728-1733.
22. Baker WL, Geronila G, Kallur R, et al. Hermo-lihassalpaajien vaikutus hoitotuloksiin potilailla, jotka saavat terapeuttista hypotermiaa sydänpysähdyksen jälkeen. Analg Resusc Curr Res. 2013; S1.
23. Hsiang JK, Chesnut RM, Crisp CB, et al. Varhainen, rutiininomainen halvaus kallonsisäisen paineen hallintaan vakavassa päävammassa: onko se tarpeen? Crit Care Med. 1994;22:1471-1476.
24. Rangel-Castilla L, Gopinath S, Robertson CS. Kallonsisäisen hypertension hoito. Neurol Clin. 2008;26:521-541.
25. Caldwell JE. Asetyylikoliiniesteraasiantagonistien kliiniset rajoitukset. J Crit Care. 2009;24:21-28.
26. Bridion (sugammadex) package insert. Whitehouse Station, NJ: Merck & Co, Inc; July 2015.
27. Sacan O, White PF, Tufanogullari B, Klein K. Sugammadex reversal of rocuronium-induced neuromuscular blockade: a comparison with neostigmine-glycopyrrolate and edrophonium-atropine. Anesth Analg. 2007;10:569-574.
28. Meistelman C, Donati F. Do we really need sugammadex as an antagonist of muscle relaxants in anesthesia? Curr Opin Anaesthesiol. 2016;29:462-467.
29. Arnot-Smith J, Smith AF. Patient safety incidents involving neuromuscular blockade: analyysi Yhdistyneen kuningaskunnan kansallisen raportointi-ja oppimisjärjestelmän tiedoista vuosilta 2006-2008. Anestesia. 2010;65:1106-1113.
30. Price DR, Mikkelsen minä, Umscheid CA, Armstrong EJ. Neuromuscular blocking agents and neuromuscular dysfunction acquired in critical illness: a systematic review and meta-analysis. Crit Care Med. 2016;44:2070-2078.
31. Prielipp RC, Coursin DB, Scuderi PE, et al. Vekuronin ja sisatrakurium 51W89: n infuusiotarpeiden ja palautumisprofiilien vertailu teho-osastopotilailla. Anesth Analg. 1995;81:3-12.
32. Sparr HJ, Wierda JM, Proost JH, et al. Rokuronin farmakodynamiikka ja farmakokinetiikka tehohoitopotilailla. Br J Anaesth. 1997;78:267-273.