US Pharm. 2017;42(1):HS16-HS20.ZUSAMMENFASSUNG: Neuromuskuläre Blocker (NMBAs) spielen eine wichtige Rolle bei der Behandlung einer großen Anzahl von Krankenhauspatienten. Die Pharmakologie von NMBAs ist gut verstanden, aber die Verwendung dieser Mittel kann umstritten sein. NMBAs sind in chirurgischen Situationen und bei Intubation mit schneller Sequenz häufig, aber andere Indikationen wie akutes Atemnotsyndrom, therapeutische Hypothermie und erhöhter Hirndruck sind etwas spaltend. Apotheker müssen unbedingt mit den klinischen Auswirkungen und Ergebnissen vertraut sein, die mit der Verwendung von NMBAs verbunden sind. Darüber hinaus ist es wichtig, gleichzeitige Überlegungen wie Sedierung, Überwachung und Umkehrung zu verstehen. Apotheker im Krankenhaus sollten mit dem kürzlich zugelassenen neuartigen Direktumkehrmittel Sugammadex (Bridion) vertraut sein.
Neuromuskuläre Blocker (NMBAs) spielen eine wichtige Rolle bei der Behandlung einer großen Anzahl von Krankenhauspatienten. Zusätzlich zu ihrer routinemäßigen Verwendung in der chirurgischen Anästhesie können NMBAs in vielen neuen und sich entwickelnden Situationen der Intensivpflege wertvoll sein. Daher ist es für den Krankenhausapotheker unerlässlich, sich mit den klinischen Implikationen und Ergebnissen vertraut zu machen, die mit der Verwendung und Umkehrung von NMBA verbunden sind.
Pharmakologie
NMBAs üben ihre pharmakologische Wirkung aus, indem sie die Signalübertragung im Skelettmuskel modulieren. Aktionspotentiale (Änderungen des elektrischen Potentials, die mit dem Durchgang eines Impulses entlang der Membran eines Muskels oder einer Nervenzelle verbunden sind), die den Skelettmuskel erreichen, aktivieren die Freisetzung von Acetylcholin in die motorischen Endplatten. Acetylcholin bindet an Nikotinrezeptoren an der Endplatte, was zur Freisetzung von Na + (Natrium) in die Muskelfasern führt, was das Muskelaktionspotential auslöst. Calciumionen werden dann in das sarkoplasmatische Retikulum freigesetzt, was die Bindung von Myosin an Aktin provoziert. Myosin bindet weiter und bewegt sich entlang der Aktinstellen, wodurch das Sarkomer verkürzt wird, solange Kalzium in der Zelle vorhanden ist. NMBAs arbeiten auf zwei Arten, um diesen Prozess zu blockieren.
Depolarisierende NMBAs wirken als Agonisten an Nikotinrezeptoren.1 Sie halten die ionengesteuerten Kanäle offen, was zu einer Muskelfaszikulation führt, bis das Ionenpotential erschöpft ist, und dann zu einer Lähmung.2 Succinylcholin ist das einzige verfügbare depolarisierende NMBA. Nichtdepolarisierende NMBAs sind kompetitive Antagonisten an Nikotinrezeptoren, die Acetylcholin an der motorischen Endplatte blockieren.1 Dies verhindert, dass sich das Aktionspotential ausbreitet, wodurch Muskelzellen unempfindlich gegen motorische Nervenimpulse werden. Muskellähmungen treten nacheinander auf, beginnend mit kleinen, schnell zuckenden Muskeln in Augen und Kehlkopf bis hin zu Gliedmaßen, Rumpf, Atemwegen, Interkostalmuskeln und Zwerchfell. Die Erholung von der neuromuskulären Blockade erfolgt in umgekehrter Reihenfolge.2
Aufgrund ihrer mechanistischen Wirkungen auf Acetylcholin zeigen NMBAs viele Nebenwirkungen. Acetylcholin spielt eine Rolle bei der Histaminfreisetzung, der Muskarinaktivierung, der vagolytischen Wirkung und der Noradrenalinfreisetzung. Infolgedessen wurden Nebenwirkungen wie Tachykardie und Bradykardie, Hypertonie und Hypotonie sowie Bronchodilatation und Bronchospasmus bei ihrer Anwendung beobachtet (TABELLE 1).
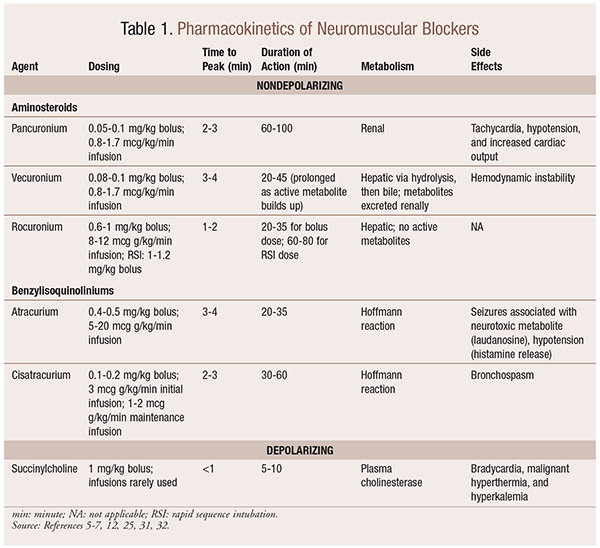
Pharmakokinetik
Je nach Situation ist es sinnvoll, eine Vielzahl von kinetischen Profilen zur Verfügung zu haben, wenn ein NMBA ausgewählt wird. Schneller Beginn und kurze Dauer sind nützlich für Indikationen wie Rapid Sequence Intubation (RSI), während diejenigen mit einer längeren Dauer in der Chirurgie von größerem Wert sind. Siehe TABELLE 1 für einen kurzen Überblick über kinetische Profile, einschließlich Dosierung und häufige Nebenwirkungen.
Klinische Anwendung
Chirurgisch: NMBAs sind seit der Einführung von Succinylcholin im Jahr 1952 ein fester Bestandteil der Anästhesiologie und Chirurgie.3-7 Die Wahl des Mittels und die Dosierung variieren stark in Abhängigkeit vom chirurgischen Eingriff und auch von der Verwendung alternativer Mittel, einschließlich Allgemeinanästhetika, Lokalanästhetika und IV-Sedationsmedikamente. Von primärem Interesse bei der chirurgischen Anwendung von NMBAs ist es, ein angemessenes Maß an Muskelblockade zu erreichen, ohne kardiovaskuläre Nebenwirkungen hervorzurufen oder die Gesamtdauer der Blockade über den Zeitrahmen des chirurgischen Eingriffs hinaus zu verlängern.4 Obwohl eine vollständige Erörterung der Wirkstoffauswahl und -dosierung für chirurgische Indikationen den Rahmen dieses Artikels sprengt, wird die klinische Umkehrung dieser Effekte angesprochen. Die klinische Überwachung eines Patienten, der während eines chirurgischen Eingriffs ein mittel- bis langwirksames NMBA erhalten hat, sollte periphere Nervenstimulationstests (PNS) umfassen (später erörtert).1,4
RSI: RSI ist ein emergentes Verfahren zur Sicherung der Atemwege eines instabilen Patienten. RSI-Protokolle beinhalten die Verabreichung eines Tiefensedierungsinduktionsmittels (z. B. Propofol, Etomidate, Midazolam) bei nahezu gleichzeitiger Verabreichung eines NMBA. Das gewünschte Ergebnis ist, dass der Patient sowohl eine amnestische Sedierung als auch eine tiefgreifende Muskelentspannung entwickelt, wodurch die Wahrscheinlichkeit einer erfolgreichen Intubation verbessert wird.8,9 Die Auswahl geeigneter Wirkstoffe sollte auf der wirkstoffspezifischen Pharmakokinetik und den patientenspezifischen klinischen Variablen beruhen.Ein ideales Mittel für RSI ist eines mit einem schnellen Beginn und einem schnellen Offset, was die Zeit von der Verabreichung bis zur Intubation verkürzt und auch die Gesamtdauer der Lähmung verringert.10 Eine lange Verzögerung des Arzneimitteleintritts erhöht das Gesamtrisiko einer Hypoxie für den Patienten. Mit zunehmender Einsetzzeit muss zwischen dem letzten Atemzug über den Beutel und den ersten Atemzügen, die über den Endotrachealtubus abgegeben werden, mehr Zeit vergehen. Eine längere Dauer der Lähmung erhöht das Risiko einer fehlgeschlagenen Intubation.10,11 Anstelle der schnellen Wiederherstellung, die mit Succinylcholin gesehen wird, können länger anhaltende Mittel wie Rocuronium Atemunterstützung für mehr als 90 Minuten erfordern.12
Ein großer Cochrane Review, der 2015 veröffentlicht wurde, zeigte, dass Succinylcholin Rocuronium in Bezug auf günstige Intubationsbedingungen überlegen war. Diese Ergebnisse spiegeln wahrscheinlich das günstige kinetische Profil von Succinylcholin wider.13 In der klinischen Praxis gibt es jedoch mehrere wichtige Kontraindikationen für die Verwendung von Succinylcholin. Bei Patienten mit maligner Hyperthermie in der Vorgeschichte oder bei Patienten mit hohem Risiko für die Entwicklung einer Hyperkaliämie bleibt Rocuronium ein lebensfähiger RSI-Wirkstoff.
Intensivpflege
Akutes Atemnotsyndrom (ARDS): Eines der primären klinischen Anliegen für Patienten, die ARDS entwickeln, ist es, Druck und Stress auf die Lunge zu reduzieren und dadurch zusätzliche Entzündungen über die anfängliche Schädigung oder Beleidigung hinaus zu reduzieren. Aufgrund ihrer Auswirkungen auf den Zwerchfelltonus wurden NMBAs als Methode zur Verringerung der Asynchronität des Beatmungsgeräts und des Lungendrucks vorgeschlagen. Es wurden drei Primärstudien in englischer Sprache veröffentlicht, in denen die Verwendung von NMBAs in der frühen Phase von ARDS bewertet wurde.14-16 Jede Studie zeigte eine erhöhte Sauerstoffversorgung bei Patienten, die frühzeitig mit einer 48-stündigen kontinuierlichen Infusion von Cisatracurium behandelt wurden. Eine Metaanalyse von gepoolten Daten aus diesen Studien aus dem Jahr 2013 zeigte, dass eine frühe Verabreichung von Cisatracurium zu einem verringerten Barotrauma führte (P = .02) und verringerte Krankenhaussterblichkeit (P = .005), hatte aber keinen Einfluss auf die Dauer der mechanischen Beatmung (P = .57).17
Basierend auf diesen Befunden ist es sinnvoll, NMBAs für die Behandlung von akutem ARDS bei Patienten auf der Intensivstation in Betracht zu ziehen.4 Während der Wirkmechanismus für alle nicht depolarisierenden NMBAs zum vorgeschlagenen Mechanismus des klinischen Nutzens bei ARDS beitragen sollte, verwendeten veröffentlichte randomisierte, kontrollierte Studien Cisatracurium nur in der interventionellen Gruppe. Ob andere Wirkstoffe einen Einfluss auf diese Ergebnisse haben würden, wurde in der Literatur nicht angesprochen.
Therapeutische Hypothermie: NMBAs wurden als Teil vieler Behandlungsalgorithmen für Patienten vorgeschlagen therapeutische Hypothermie nach Herzstillstand.18 Durch die Kontrolle des Zitterns können NMBAs den Gesamtsauerstoffverbrauch senken. Obwohl dies in der Intensivmedizin nicht untersucht wurde, wurden diese physiologischen Veränderungen bei chirurgischen Patienten nachgewiesen Hypothermie während des kardiopulmonalen Bypasses.19,20 In einer retrospektiven Studie mit 111 Patienten, die sich einer therapeutischen Hypothermie unterzogen (18 mit NMBA vs. 93 ohne), zeigte sich eine Verbesserung des Krankenhausüberlebens (P = .004), die nach multivariater Analyse potenzieller Baseline-Störfaktoren signifikant blieben (95% -KI, 1,56-33,38).21 Ein Trend zu Verbesserungen der Laktat-Clearance und der funktionellen Ergebnisse wurde auch bei Patienten beobachtet, die kontinuierlich NMBA erhielten.
Eine weitere retrospektive Studie befasste sich mit der Auswahl von NMBAs bei Patienten, die sich nach einem Herzstillstand einer therapeutischen Hypothermie unterziehen.22 Mit einer multivariaten Analyse verglichen die Forscher 201 Patienten, die eine therapeutische Hypothermie erhielten (29,9% mit Cisatracurium vs. 17,9% mit Vecuronium). Cisatracurium war der einzige unabhängige positive Prädiktor für das Überleben mit gutem neurologischem Ergebnis (P = .014). Aufgrund des retrospektiven Charakters und der geringen Stichprobengröße dieser Studie ist es schwierig, die Gesamtleistung zu bewerten, um einen von Vecuronium gebotenen Unterschied zu erkennen, der dem bei Cisatracurium beobachteten ähnelt. Es ist möglich, dass Störvariablen einen stärkeren Einfluss auf die Gesamtergebnisse haben als der ausgewählte Neuroblockade-Agent.22
Erhöhter intrakranieller Druck (ICP): ICP wird routinemäßig durch tiefe Sedierung und Analgesie behandelt, wodurch der Sauerstoffverbrauch und der zerebrale Stoffwechsel reduziert werden, während Schmerzen, Bewegung und Asynchronität des Beatmungsgeräts kontrolliert werden.2 Die Zugabe von NMBAs wird nur in Betracht gezogen, wenn eine tiefe Sedierung nicht ausreicht, um einen gefährlichen Anstieg des ICP zu kontrollieren, der häufig auf Husten, Saugen oder Zittern zurückzuführen ist.2,12 Es wurde gezeigt, dass die frühe Verwendung von NMBA zu einer verringerten Mortalität führt, jedoch auf Kosten einer erhöhten Morbidität. Hsiang und Kollegen überprüften retrospektiv Daten zu einer Kohorte von 514 Patienten aus der Traumatic Coma Data Bank, um die Verwendung von frühem verlängertem NMBA-Gebrauch im Vergleich zu kurzzeitigem NMBA-Gebrauch zu bewerten. Der Aufenthalt auf der Intensivstation war durchschnittlich 3 Tage länger, mehr Patienten entwickelten eine Lungenentzündung und es gab einen Trend zu einem erhöhten Sepsisrisiko bei Patienten mit verlängerter NMBA. Obwohl es in der Nicht-NMBA-Gruppe mehr Todesfälle gab, hatte die NMBA-Gruppe eine größere Inzidenz von vegetativen oder schwer behinderten Überlebenden.23 Die Verwendung von NMBAs bei erhöhtem ICP führt zu erheblichen Schwierigkeiten bei der Überwachung der neurologischen Funktion und Anfallsaktivität.24
Umkehrmittel
Obwohl auf der Intensivstation ungewöhnlich, ist die Umkehrung von NMBAs ein wichtiger Bestandteil der chirurgischen Behandlung von Patienten, die gelähmt sind. Historisch gesehen ist dies durch die Verwendung von Neostigmin postoperativ aufgetreten.4 Neostigmin ist ein Acetylcholinesterase-Inhibitor (ACheI), der den Abbau von Acetylcholin in der motorischen Endplatte reduziert und eine Erhöhung der Acetylcholinkonzentration verursacht. Da nichtdepolarisierende NMBAs kompetitive Antagonisten des Nikotinrezeptors sind, erhöht Neostigmin den kompetitiven Druck von Acetylcholin am Ort der Arzneimittelwirkung. Obwohl Neostigmin die Erholungszeiten nach der Verabreichung von NMBA wirksam verbessert, kann es aufgrund seines indirekten Wirkmechanismus unzuverlässig sein.4,25 Wenn die NMBA-Konzentrationen hoch genug sind, kann der Antagonismus unabhängig von der verabreichten Anticholinesterase-Dosis nicht überwunden werden. Es wurde gezeigt, dass das Versäumnis, NMBAs postoperativ vollständig umzukehren, die Raten von Restschwäche und Dysphagie und das Aspirationsrisiko erhöht.4,25 Zusätzlich hat Neostigmin seine eigenen Nebenwirkungen durch seine Wirkung sowohl auf den Nikotin- als auch auf den Muskarinrezeptor. Während der Nikotinrezeptor über den NMBA blockiert wird, führt die Wirkung von Neostigmin auf den Muskarinrezeptor zu erhöhten Bronchospasmen, Magenmotilität, Sekreten und Bradykardie.25 Um diese Risiken zu verringern, muss ein Antimuskarinagonist wie Atropin oder Glycopyrrolat zusammen mit Neostigmin angewendet werden, um die erhöhte Muskarinaktivierung auszugleichen.Im Dezember 2015 genehmigte die FDA Sugammadex (Bridion), ein neuartiges Mittel zur direkten Umkehrung von Rocuronium und Vecuronium. Sugammadex wird als Gamma-Cyclodextrin klassifiziert und erzeugt einen Arzneimittelkomplex mit freiem NMBA, wodurch die verfügbaren Wirkstoffkonzentrationen reduziert werden. Diese pharmakokinetischen Wirkungen auf die NMBA-Konzentration sind sowohl schnell als auch vollständig. Aufgrund ihrer Größe sind Cisatracurium, Atracurium und Succinylcholin jedoch von Sugammadex nicht betroffen.26 Der Hauptvorteil von Sugammadex im Vergleich zu Neostigmin ist die Geschwindigkeit, mit der die Umkehrung erfolgt (2 Minuten vs. 17 Minuten).27 Im Gegensatz zu ACheIs hat Sugammadex keinen Deckeneffekt, d. h. Mit einer ausreichend hohen Sugammadex-Dosis kann jede Lähmungstiefe schnell rückgängig gemacht werden.26,28 Schließlich hat die Anwendung von Sugammadex keine pharmakodynamische Wirkung auf Muskarinrezeptoren, was das Nebenwirkungsprofil des Arzneimittels signifikant verringert und die Notwendigkeit der gleichzeitigen Verabreichung von Antimuskarinmitteln vermeidet. Die Dosierung von Sugammadex basiert auf dem Grad der neuromuskulären Blockade und reicht von 2 mg / kg bei mäßiger Blockade bis zu 16 mg / kg bei sofortiger Umkehrung.26,28
Sedierung
Es ist äußerst wichtig zu erkennen, dass NMBAs zwar Muskelbewegungen verhindern, jedoch keinen Einfluss auf das Bewusstseinsniveau oder die Fähigkeit des Patienten haben, Schmerzen oder Beschwerden wahrzunehmen, was zu einem Phänomen führt, das als unbeabsichtigtes Bewusstsein beschrieben wird.1 Unabhängig davon, ob es sich um chirurgische oder medizinische Indikationen handelt, besteht bei Patienten möglicherweise das Risiko einer unzureichenden Sedierung oder Analgesie. Eine Fallserie zeigte, dass bis zu 18% der Patienten ein gewisses Maß an Bewusstsein behalten, während sie gelähmt sind.29 Diese Patienten berichten von Empfindungen, die von einem traumhaften Zustand bis zu explizitem Bewusstsein reichen. Es gibt keine Studien, die eine spezifische Anleitung zum Management des unbeabsichtigten Bewusstseins während der neuromuskulären Blockade bieten. Unabhängig davon gilt es als gängige Praxis, vor und während der neuromuskulären Blockade ein angemessenes Maß an Analgesie und tiefer Sedierung zu etablieren und aufrechtzuerhalten.1
Überwachung
Die Überwachung von Patienten mit NMBAs ist zwingend erforderlich, die Methoden werden jedoch häufig durch den klinischen Verlauf, die gleichzeitige Verabreichung von Sedativa und Analgetika und zusätzliche therapeutische Modalitäten (z. B. therapeutische Hypothermie) kompliziert. PNS wird allgemein als die Überwachungsmethode der Wahl angesehen, hat jedoch Einschränkungen. Zusätzliche Überwachungsparameter umfassen Spontanatmung und Trends in Vitalfunktionen.2
PNS wird unabhängig für Patienten mit kontinuierlicher Infusion von NMBAs und als Ergänzung in anderen klinischen Situationen empfohlen.1 Ein Train-of-Four-Gerät, das am Orbicularis oculi, N. ulnaris oder N. peroneus angebracht ist, liefert vier aufeinanderfolgende elektrische Reize. In Abwesenheit einer neuromuskulären Blockade wird für alle vier Stimuli eine gleiche Zuckungsreaktion beobachtet, was zu einem T4 / T1-Verhältnis von 1 führt. Bei einem gelähmten Patienten sollte die Zuckreaktion mit dem ersten Reiz beobachtet werden, dies sollte jedoch aufgrund der Blockade von Motoneuronen abnehmen. Ziel ist es, ein T4/T1-Verhältnis von etwa 0,25 zu erreichen.1
Komplikationen
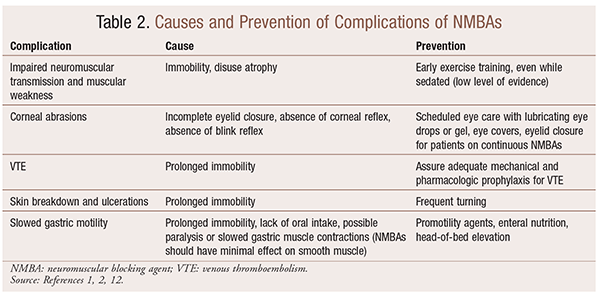
Obwohl die Verwendung von NMBAs in bestimmten Situationen erhebliche Vorteile bietet, gibt es auch kurz- und langfristige Komplikationen. Im akuten Umfeld kann die Verwendung von NMBAs zu einem erhöhten Aufenthalt auf der Intensivstation, einer längeren mechanischen Beatmung, venösen Thromboembolien, Hautrissen und Geschwüren, Infektionen, Hornhautschäden und Anaphylaxie führen. Eine langfristige Verabreichung kann aufgrund einer gestörten neuromuskulären Übertragung und Muskelschwäche zu Immobilität oder erhöhter Erholungszeit führen.30 Mehrere Empfehlungen zur Vermeidung dieser Effekte sind in TABELLE 2 dargestellt.
Fazit
Der Apotheker kann eine sehr wichtige Rolle bei der Regulierung und Verwendung von NMBAs in einer Vielzahl von klinischen Praxisstandorten spielen. Durch das Verständnis des Wirkmechanismus, der therapeutischen Indikationen, der unterstützenden Literatur und der klinischen Nebenwirkungen dieser Hochwarmklasse von Medikamenten kann der Apotheker einen unschätzbaren Einfluss auf die Patientenversorgung und die Patientensicherheit haben.
1. Murray MJ, DeBlock H, Erstad B, et al. Leitlinien für die klinische Praxis für eine anhaltende neuromuskuläre Blockade bei erwachsenen kritisch kranken Patienten. In: Crit Care Med. 2016;44:2079-2103.
2. Warr J, Thiboutot Z, Rose L, et al. Aktuelle therapeutische Anwendungen, Pharmakologie und klinische Überlegungen von neuromuskulären Blockierungsmitteln für kritisch kranke Erwachsene. Ann Pharmacother. 2011;45:1116-1126.
3. Foldes FF, McNall PG, Borrego-Hinojosa JM. Succinylcholin: ein neuer Ansatz zur Muskelentspannung in der Anästhesiologie. In: N Engl J Med. 1952;247:596-600.
4. Naguib M, Pfandrecht CA. Pharmakologie von Muskelrelaxantien und deren Antagonisten. In: Millers Anästhesie. 7. Aufl. Miller RD, Eriksson LI, Fleisher LA, et al., Hrsg. Philadelphia, PA: Churchill Livingstone; 2010.
5. Anektin (Succinylcholin) Packungsbeilage. Princeton, NJ: Sandoz Inc; September 2010.
6. Rocuronium Packungsbeilage. Irvine, Kalifornien: Teva Parenteral Medicines, Inc; November 2008.
7. Nimbex (Cisatracurium) Packungsbeilage. North Chicago, IL: Abbott Laboratories; 2010.
8. Sakles JC, Laurin EG, Rantapaa AA, Panacek EA. Atemwegsmanagement in der Notaufnahme; eine einjährige Studie von 610 Trachealintubationen. In: Ann Emerg Med. 1998;31:325-332.
9. Tayal VS, Riggs RW, Marx JA, et al. Rapid-Sequence-Intubation in einer Notfallmedizin Residenz: Erfolgsrate und unerwünschte Ereignisse während eines Zeitraums von zwei Jahren. In: Acad Emerg Med. 1999;6:31-37.
10. Li J, Murphy-Lavoie H, Bugas C, et al. Komplikationen der Notfallintubation mit und ohne Lähmung. In: Am J Emerg Med. 1999;17:141-143.
11. Naguib M, Samarkandi AH, El-Din MICH, et al. Die Dosis von Succinylcholin, die für hervorragende endotracheale Intubationsbedingungen erforderlich ist. Anesth Analg. 2006;102:151-155.
12. Greenberg SB, Vender J. Die Verwendung von neuromuskulären Blockierungsmitteln auf der Intensivstation: wo stehen wir jetzt? In: Crit Care Med. 2013;41:1332-1344.
13. Tran DT, Newton EK, Mount VA, et al. Rocuronium versus Succinylcholin für die Intubation mit schneller Sequenzinduktion. Cochrane Database Syst Rev. 2015;(10):CD002788.
14. Gainnier M, Roch A, Forel JM, et al. Wirkung von neuromuskulären Blockern auf den Gasaustausch bei Patienten mit akutem Atemnotsyndrom. In: Crit Care Med. 2004;32:113-119.
15. In: Forel JM, Roch A, Marin V, et al. Neuromuskuläre Blocker verringern die Entzündungsreaktion bei Patienten mit akutem Atemnotsyndrom. In: Crit Care Med. 2006;34:2749-2757.
16. Papazian L, Forel JM, Gacouin A, et al. Neuromuskuläre Blocker im frühen akuten Atemnotsyndrom. In: N Engl J Med. 2010;363:1107-1116.
17. Alhazzani W, Alshahrani M, Jaeschke R, et al. Neuromuskuläre Blockierungsmittel beim akuten Atemnotsyndrom: eine systemische Überprüfung und Metaanalyse randomisierter kontrollierter Studien. Crit Pflege. 2013;17:R43.
18. In: Chamorro C, Borrallo JM, Romera MA, et al. Anästhesie- und Analgesieprotokoll während der therapeutischen Hypothermie nach Herzstillstand: eine systematische Überprüfung. Anesth Analg. 2010;110:1328-1335.
19. Cruise C, MacKinnon J, Tough J, Houston P. Vergleich von Meperidin und Pancuronium zur Behandlung von Zittern nach einer Herzoperation. Kann J Anaesth. 1992;39:563-568.
20. Sladen RN, Berend JZ, Fassero JS, et al. Vergleich von Vecuronium und Meperidin zu den klinischen und metabolischen Wirkungen von Zittern nach hypothermischem kardiopulmonalem Bypass. In: J Cardiothorac Vasc Anesth. 1995;9:147-153.
21. Salciccioli JD, Cocchi MN, Rittenberger JC, et al. Eine kontinuierliche neuromuskuläre Blockade ist mit einer verringerten Mortalität bei Patienten nach Herzstillstand verbunden. Wiederbelebung. 2013;84:1728-1733.
22. Baker WL, Geronila G, Kallur R, et al. Wirkung von neuromuskulären Blockern auf die Ergebnisse bei Patienten, die nach einem Herzstillstand eine therapeutische Hypothermie erhalten. 2013;S1.
23. Hsiang JK, Chesnut RM, Crisp CB, et al. Frühe, routinemäßige Lähmung zur intrakraniellen Druckkontrolle bei schweren Kopfverletzungen: Ist es notwendig? In: Crit Care Med. 1994;22:1471-1476.
24. Rangel-Castilla L, Gopinath S, Robertson CS. Management der intrakraniellen Hypertonie. In: Neurol Clin. 2008;26:521-541.
25. Caldwell JE. Klinische Einschränkungen von Acetylcholinesterase-Antagonisten. J Crit Pflege. 2009;24:21-28.
26. Bridion (sugammadex) package insert. Whitehouse Station, NJ: Merck & Co, Inc; July 2015.
27. Sacan O, White PF, Tufanogullari B, Klein K. Sugammadex reversal of rocuronium-induced neuromuscular blockade: a comparison with neostigmine-glycopyrrolate and edrophonium-atropine. Anesth Analg. 2007;10:569-574.
28. Meistelman C, Donati F. Do we really need sugammadex as an antagonist of muscle relaxants in anesthesia? Curr Opin Anaesthesiol. 2016;29:462-467.
29. Arnot-Smith J, Smith AF. Patient safety incidents involving neuromuscular blockade: analyse der Daten des britischen nationalen Berichts- und Lernsystems von 2006 bis 2008. Anästhesie. 2010;65:1106-1113.
30. Preis DR, Mikkelsen ME, Umscheid CA, Armstrong EJ. Neuromuskuläre Blockierungsmittel und neuromuskuläre Dysfunktion bei kritischen Erkrankungen: eine systematische Überprüfung und Metaanalyse. In: Crit Care Med. 2016;44:2070-2078.
31. Prielipp RC, Coursin DB, Scuderi PE, et al. Vergleich des Infusionsbedarfs und der Erholungsprofile von Vecuronium und Cisatracurium 51W89 bei Patienten auf der Intensivstation. Anesth Analg. 1995;81:3-12.
32. Dr.-Ing.Dr.-Ing. Dr.-Ing. Dr.-Ing. Dr.-Ing. Dr.-Ing. Pharmakodynamik und Pharmakokinetik von Rocuronium bei Intensivpatienten. Br J Anaesth. 1997;78:267-273.