Es ist eine anorganische chemische Verbindung, die natürlicherweise als seltenes Mineral vorkommt. Es kann sich gleichermaßen in einer Lösung starker Säure oder Base lösen und wird als amphotere Verbindung bezeichnet. Unter wässrigen Bedingungen dissoziiert die Verbindung in Zink- und Hydroxidionen.
Zinkhydroxid Identifikation
CAS-Nummer: 20427-58-1
PubChem: 9812759
ChemSpider: 7988510
Zinkhydroxid Formel
Seine chemische Formel ist Zn (OH)2.
Zinkhydroxid-Eigenschaften
Im Folgenden sind einige der einzigartigen Eigenschaften der Verbindung aufgeführt:
Aussehen
Es erscheint im Allgemeinen als weißer Feststoff.
Molmasse
Es wiegt etwa 99,424 g/mol.
Stabilität
Es ist unter normalen Bedingungen stabil und nicht reaktiv.
Dichte
Seine Masse pro Volumen beträgt etwa 3,053 g/cm3.
Schmelzpunkt
Es zersetzt sich bei 125 Grad Celsius.
Löslichkeit
Es ist in Wasser schwer löslich und in Alkohol absolut unlöslich. Sein Löslichkeitsprodukt (Ksp) beträgt 3,0 x 10-17.
Auflösung
Zinkhydroxid löst sich in wässrigem Ammoniak unter Bildung eines farblosen, wasserlöslichen Amminkomplexes. Wenn Ammoniak im Überschuss zugegeben wird, reagieren die Hydroxidionen, die von Zn (OH) 2 dissoziieren, mit ihm zu einem positiv geladenen Tetra-Komplex mit einer Koordinationszahl von 4. Das resultierende Produkt ist von Ammoniakligand umgeben, was zur Auflösung führt.
Zinkhydroxid-Thermochemie
Seine Standardbildungsenthalpie oder Standardbildungswärme beträgt -642 kJ.mol-1.
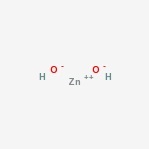
Zinkhydroxidstruktur
Hier ist die Struktur der amphoteren Verbindung.
Vorkommen von Zinkhydroxid
Es kommt als drei Seltenerdmineralien vor: Wulfingit, Ashoverit und Sweetit. Diese seltenen Mineralien sind eigentlich die natürlichen Polymorphe von Zn (OH) 2. In der Materialwissenschaft ist jedes feste Material polymorph, wenn es in mehr als einer Form wie orthorhombisch oder tetragonal vorliegt.
Zinkhydroxidzubereitung
Es wird im Allgemeinen durch Zugabe einer moderaten Menge Natriumhydroxidlösung zu einer Zinksalzlösung wie Zinkchlorid oder Zinksulfat hergestellt. Diese beiden Verbindungen reagieren unter normalen Bedingungen unter Bildung eines weißen Niederschlags von Zn (OH)2. Bei dieser Reaktion sollte eine verdünnte Lösung von Natriumhydroxid verwendet werden, um zu verhindern, dass sich die anorganische Verbindung auflöst. Unter normalen Bedingungen dissoziiert das Zinksalz unter Bildung eines Zinkions, das sich mit zwei Hydroxidionen aus Natriumhydroxidlösung zu Zinkhydroxid verbindet.
Zn2++ 2OH- → Zn(OH)2
Wenn der Salzlösung überschüssiges Natriumhydroxid zugesetzt wird, löst sich der Niederschlag von Zn (OH)2, der anfänglich gebildet wird, auf, um eine Form zu bilden eine farblose Lösung von Zinkat Ionen wie unten gesehen:
Zn (OH)2 + 2OH– → Zn(OH)42-
Diese Eigenschaft von Zinkhydroxid wird ausgiebig verwendet, um das Vorhandensein von Zinkionen in Lösung nachzuweisen. Es ist jedoch keine einzigartige Methode zum Testen, da es viele Verbindungen von Aluminium und Blei gibt, die sich sehr ähnlich verhalten.
Die Auflösungseigenschaft von Zinkhydroxid kann zur Anwesenheit von Wasserliganden beigetragen werden, die normalerweise das Ion umgeben. Wenn der Lösung überschüssiges Natriumhydroxid zugesetzt wird, reduzieren die beiden Hydroxidionen es zu einem negativ geladenen Komplex, wodurch es löslich wird.
Zinkhydroxid Verwendet
Einige der häufigsten Verwendungen von Zn (OH) 2 sind:
Chirurgische Verbände
Es wird für chirurgische Verbände verwendet, bei denen es als Absorptionsmittel wirkt. Große Bandagen, die nach der Operation verwendet werden, sind mit der Zinkverbindung beschichtet, um das Blut aus der Wunde zu absorbieren.
Schutzbeschichtung
Stahl und Eisen werden meistens mit einer Zinkbeschichtung durch einen Prozess namens Galvanisierung aufgebracht. Unter feuchten Bedingungen bildet sich auf diesen verzinkten Metallen eine Schicht Zinkhydroxid, um ein Verrosten zu verhindern.
Beizmittel
Zinkhydroxid ist sehr gallertartig (geleeartig) und fungiert im Allgemeinen als Beizmittel, das Farbstoffe auf verschiedenen Stoffen oder Geweben festigt. Farbstoff ist im Allgemeinen ein chemisches Reagenz, das mit Zn (OH) 2 einen Metallkomplex bildet und stark an den Gewebeauskleidungen haftet.
Pestizide
Es wird häufig als Zwischenprodukt für die kommerzielle Herstellung von Pestiziden und Pigmenten verwendet.

Topische Lösungen
Die Kombination von Zn (OH) 2 mit Zinkoxid wird häufig in Calamincremes, Salben, Babypuder, Hautlotionen und Kosmetika verwendet. Es reagiert mit starken Basen, aufgrund seiner amphoteren Natur, um Zinkate zu bilden, die als orale Medikamente zur Behandlung mehrerer Erkrankungen verwendet werden.
Elektrische Batterien
Es wird auch in hochenergetischen elektrischen Batterien verwendet, die durch eine reversible Reaktion wiederaufladbar sind.
Kautschukcompoundierung
Zn (OH)2 wird zum Compoundieren oder Mischen verschiedener Kautschukbestandteile verwendet, um die Endnutzungseigenschaften je nach Bedarf des Verbrauchers zu optimieren.
Zinkverbindungen
Eine Vielzahl von Zinkverbindungen wie Zinkoxid, Zinksulfat und Zinknitrat werden kommerziell mit Hilfe der anorganischen Chemikalie hergestellt.
Sicherheitsdatenblatt Zinkhydroxid
Es ist im Allgemeinen nicht brennbar und stellt keine Gefahr für die Arbeitnehmer dar. Die Verbindung sollte jedoch nicht verkostet oder geschluckt werden, da sie nur wenige toxikologische Inhaltsstoffe enthalten kann.