US Pharm. 2017; 42 (1): HS16-HS20.
sammanfattning: neuromuskulära blockeringsmedel (NMBA) spelar en viktig roll i hanteringen av ett stort antal sjukhuspatienter. Farmakologin hos NMBAs är väl förstådd, men användningen av dessa medel kan vara kontroversiell. NMBA är vanliga i kirurgiska situationer och snabb sekvensintubation, men andra indikationer, såsom akut andningsbesvärssyndrom, terapeutisk hypotermi och förhöjt intrakraniellt tryck, är något splittrande. Det är viktigt för apotekare att känna till kliniska konsekvenser och resultat i samband med användningen av NMBAs. Dessutom är det viktigt att förstå samtidiga överväganden som sedering, övervakning och återföring. Apotekare på sjukhus bör vara bekanta med det nyligen godkända nya direktomvandlingsmedlet sugammadex (Bridion).
neuromuskulära blockeringsmedel (NMBA) spelar en viktig roll vid hanteringen av ett stort antal sjukhuspatienter. Förutom deras rutinmässiga användning vid kirurgisk anestesi kan NMBA vara värdefull i många nya och utvecklande kritiska vårdsituationer. Därför är det viktigt för sjukhusapotekaren att bli bekant med de kliniska konsekvenserna och resultaten i samband med NMBA-användning och återföring.
farmakologi
NMBA utövar sina farmakologiska effekter genom att modulera signalöverföring i skelettmuskulaturen. Åtgärdspotentialer (förändringar i elektrisk potential i samband med passage av en impuls längs membranet i en muskel eller nervcell) som når skelettmuskel aktiverar frisättningen av acetylkolin i motorändplattorna. Acetylkolin binder till nikotinreceptorer i ändanplattan, vilket resulterar i frisättning av Na+ (natrium) i muskelfibrer, vilket utlöser muskelverkningspotentialen. Kalciumjoner frigörs sedan i sarkoplasmatisk retikulum, vilket framkallar bindningen av myosin till aktin. Myosin fortsätter att binda och röra sig längs aktinställen, förkorta sarkomeren, så länge kalcium är närvarande i cellen. NMBAs arbetar på två sätt för att blockera denna process.
depolariserande NMBA fungerar som agonister vid nikotinreceptorer.1 de håller upp de jongrindade kanalerna, vilket leder till muskulär fascikulation tills jonpotentialen är utarmad och sedan till förlamning.2 succinylkolin är den enda depolariserande NMBA som finns tillgänglig. Nondepolariserande NMBA är konkurrerande antagonister vid nikotinreceptorer, blockerar acetylkolin vid motorändplattan.1 Detta förhindrar att åtgärdspotentialen sprids, vilket gör muskelceller okänsliga för motoriska nervimpulser. Muskelförlamning sker sekventiellt, börjar med små, snabba muskler i ögonen och struphuvudet och utvecklas till lemmar, bagage, luftväg, interkostala muskler och membran. Återhämtning från Neuromuskulär blockering sker i omvänd ordning.2
som ett resultat av deras mekanistiska effekter på acetylkolin uppvisar NMBAs många biverkningar. Acetylkolin spelar en roll i histaminfrisättning, muskarinaktivering, vagolytisk verkan och noradrenalinfrisättning. Som ett resultat har biverkningar såsom takykardi och bradykardi, hypertoni och hypotoni samt bronkodilation och bronkospasm setts med deras användning (tabell 1).
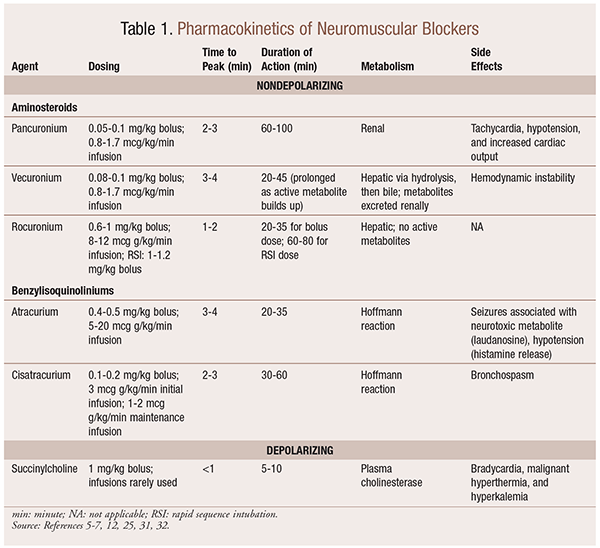
farmakokinetik
beroende på situationen är det användbart att ha en mängd olika kinetiska profiler tillgängliga när en NMBA väljs. Snabb start och kort varaktighet är användbara för indikationer som rapid sequence intubation (RSI), medan de med längre varaktighet är av mer värde vid operation. Se Tabell 1 för en kort översikt över kinetiska profiler, inklusive dosering och vanliga biverkningar.
klinisk användning
kirurgisk: NMBA har varit en häftklammer för anestesiologi och kirurgi sedan introduktionen av succinylkolin 1952.3-7 valet av medel och dosering varierar mycket beroende på det kirurgiska ingreppet och även på användningen av alternativa medel, inklusive generella anestetika, lokalbedövningsmedel och IV sederingsmedicin. Av primär oro vid kirurgisk användning av NMBAs är att uppnå lämpliga nivåer av muskulär blockad utan att inducera kardiovaskulära biverkningar eller förlänga blockadens totala varaktighet utöver tidsramen för det kirurgiska ingreppet.4 även om en fullständig diskussion om agensval och dosering för kirurgiska indikationer ligger utanför ramen för denna artikel, kommer den kliniska omkastningen av dessa effekter att behandlas. Klinisk övervakning av en patient som har fått en mellan – till långverkande NMBA under ett kirurgiskt ingrepp bör inkludera perifer nervstimulering (PNS) testning (diskuteras senare).1,4
RSI: RSI är en framväxande process som används för att säkra luftvägarna hos en instabil patient. RSI-protokoll involverar administrering av ett djupsederingsinduktionsmedel (t.ex. propofol, etomidat, midazolam) med nästan samtidig administrering av en NMBA. Det önskade resultatet är att patienten utvecklar både amnestisk sedering och djup muskelavslappning, vilket förbättrar sannolikheten för en framgångsrik intubation.8,9 valet av lämpliga medel bör baseras på agensspecifik farmakokinetik och patientspecifika kliniska variabler.
ett idealiskt medel för RSI är ett med både en snabb start och en snabb förskjutning, vilket minskar tiden från administrering till intubation och minskar också den totala varaktigheten av förlamning.10 en lång fördröjning av läkemedelsuppkomsten ökar den totala risken för hypoxi för patienten. När starttiden förlängs måste mer tid passera mellan det sista andetaget via påsen och de första andetagen som levereras via endotrakealröret. Ökad varaktighet av förlamning ökar risken för misslyckad intubation.10,11 i stället för den snabba återhämtningen som ses med succinylkolin kan medel med längre varaktighet såsom rokuronium kräva andningsstöd i mer än 90 minuter.12
en stor Cochrane recension publicerad 2015 visade att succinylkolin var överlägsen rokuronium med avseende på gynnsamma intubationsförhållanden. Dessa resultat återspeglar sannolikt den gynnsamma kinetiska profilen för succinylkolin.13 emellertid finns flera viktiga kontraindikationer för användningen av succinylkolin i klinisk praxis. Hos patienter med en historia av malign hypertermi eller hos dem med hög risk för att utveckla hyperkalemi förblir rokuronium ett livskraftigt RSI-medel.
kritisk vård
akut respiratorisk nödsyndrom (ARDS): en av de primära kliniska bekymmerna för patienter som utvecklar ARDS är att minska tryck och stress på lungorna, vilket minskar ytterligare inflammation utöver den initiala skadan eller förolämpningen. På grund av deras effekter på diafragmatisk ton har NMBA föreslagits som en metod för att minska ventilatorns asynkroni och lungtryck. Tre primära studier har publicerats på engelska som utvärderade användningen av NMBA i den tidiga fasen av ARDS.14-16 varje studie visade ökad syresättning hos patienter som behandlades tidigt med en 48-timmars kontinuerlig infusion av cisatracurium. En metaanalys från 2013 av poolade data från dessa studier visade att tidig administrering av cisatracurium resulterade i minskad barotrauma (P = .02) och minskad sjukhusdödlighet (P = .005), men hade ingen effekt på varaktigheten av mekanisk ventilation (P = .57).17
baserat på dessa fynd är det rimligt att överväga NMBAs för behandling av akuta ARDS hos patienter som presenterar på ICU.4 medan verkningsmekanismen för alla icke-depolariserande NMBA bör bidra till den föreslagna mekanismen för klinisk nytta i ARDS, publicerade randomiserade, kontrollerade studier som används cisatracurium endast i interventionsgruppen. Huruvida andra agenter skulle ha en effekt på dessa resultat har inte tagits upp i litteraturen.
terapeutisk hypotermi: NMBA har föreslagits som en del av många behandlingsalgoritmer för patienter som genomgår terapeutisk hypotermi efter hjärtstopp.18 genom att kontrollera skakningar kan NMBA minska den totala syreförbrukningen. Även om detta inte har studerats i kritisk vård, har dessa fysiologiska förändringar visats hos kirurgiska patienter som genomgår hypotermi under hjärt-lungomgång.19,20 i en retrospektiv studie av 111 patienter som genomgick terapeutisk hypotermi (18 med NMBA mot 93 utan) var det en förbättring av sjukhusöverlevnad (P = .004) som förblev signifikant efter multivariat analys av potentiella baslinjekonfounder (95% CI, 1,56-33,38).21 en trend mot förbättringar av laktatclearance och funktionella resultat noterades också hos patienter som fick kontinuerlig NMBA.
en annan retrospektiv studie behandlade valet av NMBA hos patienter som genomgick terapeutisk hypotermi efter hjärtstopp.22 Med hjälp av en multivariat analys jämförde forskarna 201 patienter som fick terapeutisk hypotermi (29,9% med cisatracurium mot 17,9% med vekuronium). Cisatracurium var den enda oberoende positiva prediktorn för överlevnad med bra neurologiskt resultat (P = .014). På grund av den retrospektiva naturen och den lilla provstorleken i denna studie är det svårt att bedöma den totala effekten för att upptäcka någon skillnad som erbjuds av vecuronium som liknar vad som observerades med cisatracurium. Det är möjligt att förvirrande variabler kan ha ett starkare inflytande än det valda neuroblockademedlet på övergripande resultat.22
förhöjt intrakraniellt tryck (ICP): ICP hanteras rutinmässigt av djup sedering och analgesi, vilket minskar syreförbrukningen och cerebral metabolism samtidigt som man kontrollerar smärta, rörelse och ventilator asynkroni.2 tillsatsen av NMBA beaktas endast när djup sedering är otillräcklig för att kontrollera farliga ökningar av ICP, ofta ett resultat av hosta, sugning eller skakning.2,12 tidig NMBA-användning har visat sig leda till minskad dödlighet, men på bekostnad av ökad sjuklighet. Hsiang och kollegor granskade retroaktivt data om en kohort av 514 patienter från den traumatiska koma databanken för att utvärdera användningen av tidig förlängd NMBA-användning jämfört med kortvarig NMBA-användning. ICU-vistelsen var i genomsnitt 3 dagar längre, fler patienter utvecklade lunginflammation och det fanns en trend mot ökad risk för sepsis hos patienter med förlängd NMBA. Dessutom, även om det fanns fler dödsfall i icke-NMBA-gruppen, hade NMBA-gruppen en större förekomst av vegetativa eller allvarligt funktionshindrade överlevande.23 användning av NMBA vid ökad ICP leder till betydande svårigheter vid övervakning av neurologisk funktion och anfallsaktivitet.24
Reverseringsmedel
även om det är ovanligt på ICU är reversering av NMBA en viktig del av den kirurgiska hanteringen av patienter som får paralytika. Historiskt sett har detta skett genom användning av neostigmin postoperativt.4 neostigmin är en acetylkolinesterashämmare (ACheI) som minskar nedbrytningen av acetylkolin i motorändplattan, vilket orsakar en ökning av koncentrationen av acetylkolin. Eftersom nondepolariserande NMBA är konkurrerande antagonister av nikotinreceptorn ökar neostigmin konkurrenstrycket av acetylkolin vid läkemedelsverkningsstället. Även om neostigmin är effektivt för att förbättra återhämtningstiderna efter NMBA-administrering, kan det vara opålitligt på grund av dess indirekta verkningsmekanism.4,25 om NMBA-koncentrationerna är tillräckligt höga kan antagonismen inte övervinnas oberoende av den administrerade antikolinesterasdosen. Underlåtenhet att fullständigt vända nmbas postoperativt har visat sig öka andelen kvarvarande svaghet och dysfagi och risken för aspiration.4,25 dessutom har neostigmin sina egna biverkningar genom sin verkan på både nikotin-och muskarinreceptorerna. Medan nikotinreceptorn blockeras via NMBA resulterar neostigmins effekt på muskarinreceptorn i ökade bronkospasmer, gastrisk motilitet, sekret och bradykardi.25 för att minska dessa risker måste en antimuskarinagonist som atropin eller glykopyrrolat användas tillsammans med neostigmin för att kompensera den ökade muskarinaktiveringen.i December 2015 godkände FDA sugammadex (Bridion), ett nytt direktomvandlingsmedel för rokuronium och vekuronium. Klassificerad som ett gamma-cyklodextrin skapar sugammadex ett läkemedelskomplex med fri NMBA, vilket minskar de tillgängliga medelkoncentrationerna. Dessa farmakokinetiska effekter på NMBA-koncentrationen är både snabba och fullständiga. På grund av deras storlek påverkas emellertid cisatracurium, atracurium och succinylkolin inte av sugammadex.26 den främsta fördelen med sugammadex, jämfört med neostigmin, är hastigheten vid vilken återföring sker (2 minuter mot 17 minuter).27 till skillnad från ACheIs har sugammadex ingen takeffekt; dvs med en tillräckligt stor sugammadex-dos kan varje djup av förlamning snabbt vändas.26,28 Slutligen har användningen av sugammadex ingen farmakodynamisk effekt på muskarinreceptorer, vilket avsevärt minskar läkemedlets biverkningsprofil och undviker behovet av att samtidigt administrera antimuskarinmedel. Dosering av sugammadex baseras på nivån av neuromuskulär blockad, från 2 mg/kg för måttlig blockad till 16 mg/kg för omedelbar återföring.26,28
sedering
det är oerhört viktigt att inse att även om NMBA förhindrar muskelrörelse, har de ingen effekt på patientens medvetenhetsnivå eller förmåga att uppleva smärta eller obehag, vilket resulterar i ett fenomen som beskrivs som oavsiktlig medvetenhet.1 oavsett om det gäller kirurgiska eller medicinska indikationer kan patienter vara i riskzonen för otillräcklig sedering eller analgesi. En fallserie visade att upp till 18% av patienterna upprätthåller en viss grad av medvetenhet medan de är förlamade.29 dessa patienter rapporterar sensationer som sträcker sig från ett drömlikt tillstånd till uttrycklig medvetenhet. Det finns inga försök som ger specifik vägledning om hantering av oavsiktlig medvetenhet under neuromuskulär blockad. Oavsett anses det vara standardpraxis att etablera och upprätthålla lämpliga nivåer av analgesi och djup sedering före och under neuromuskulär blockad.1
övervakning
övervakningen av patienter på NMBA är absolut nödvändigt, men metoder kompliceras ofta av klinisk kurs, samtidig administrering av lugnande medel och smärtstillande medel och ytterligare terapeutiska metoder (t.ex. terapeutisk hypotermi). PNS anses allmänt som övervakningsmetod val, men det har begränsningar. Ytterligare övervakningsparametrar inkluderar spontan andning och trender i vitala tecken.2
PNS rekommenderas oberoende för patienter som får kontinuerlig infusion av NMBAs och som ett komplement i andra kliniska situationer.1 en tåg-av-fyra-enhet fäst vid orbicularis oculi, ulnar nerv eller peroneal nerv levererar fyra på varandra följande elektriska stimuli. I frånvaro av neuromuskulär blockad observeras ett lika ryckningsrespons för alla fyra stimuli, vilket resulterar i ett T4/T1-förhållande på 1. I en förlamad patient bör twitch-svaret observeras med den första stimulansen, men detta bör minska på grund av blockaden av motorneuroner. Målet är att uppnå ett T4 / T1-förhållande på cirka 0,25.1
komplikationer
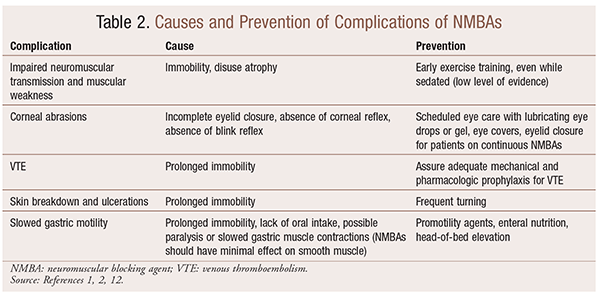
Även om det finns betydande fördelar med användningen av NMBA i särskilda situationer, finns det också kortvariga och långsiktiga komplikationer. I den akuta miljön kan användningen av NMBA leda till ökad ICU-vistelse, långvarig mekanisk ventilation, venös tromboembolism, hudrivning och sår, infektion, hornhinneskada och anafylaxi. Långvarig administrering kan leda till orörlighet eller ökad återhämtningstid på grund av nedsatt neuromuskulär överföring och muskelsvaghet.30 flera rekommendationer för att förebygga dessa effekter beskrivs i tabell 2.
slutsats
apotekaren kan spela en mycket viktig roll vid reglering och användning av NMBA över ett brett spektrum av kliniska praktikplatser. Genom att förstå verkningsmekanismen, Terapeutiska indikationer, stödjande litteratur och kliniska biverkningar av denna högvarningsklass av läkemedel kan apotekaren ha en ovärderlig effekt på patientvård och patientsäkerhet.
1. Murray MJ, DeBlock H, Erstad B, et al. Riktlinjer för klinisk praxis för långvarig neuromuskulär blockad hos den vuxna kritiskt sjuka patienten. Crit Vård Med. 2016;44:2079-2103.
2. Warr J, Thiboutot Z, Rose L, et al. Nuvarande terapeutiska användningar, farmakologi och kliniska överväganden av neuromuskulära blockeringsmedel för kritiskt sjuka vuxna. Ann Pharmacother. 2011;45:1116-1126.
3. FF, McNall PG, Borrego-Hinojosa JM. Succinylkolin: ett nytt tillvägagångssätt för muskelavslappning i anestesiologi. N Engl J Med. 1952;247:596-600.
4. Naguib M, Lien CA. Farmakologi av muskelavslappnande medel och deras antagonister. I: Millers anestesi. 7: e upplagan. Miller RD, Eriksson LI, Fleisher LA, et al, Red. Philadelphia, PA: Churchill Livingstone; 2010.
5. Bipacksedeln för anektin (succinylkolin). Princeton, NJ: Sandoz Inc; September 2010.
6. Rocuronium bipacksedel. Irvine, CA: Teva Parenteral Medicines, Inc; November 2008.
7. Nimbex (cisatracurium) bipacksedel. North Chicago, IL: Abbott Laboratories; 2010.
8. Det är inte så lätt att få tag på det. Luftvägshantering i akutavdelningen; en ettårig studie av 610 trakealintubationer. Ann Emerg Med. 1998;31:325-332.
9. Tayal VS, Riggs RW, Marx JA, et al. Intubation med snabb sekvens vid akutmedicin: framgångsgrad och biverkningar under en tvåårsperiod. Acad Emerg Med. 1999;6:31-37.
10. Li J, Murphy-Lavoie H, Bugas C, et al. Komplikationer av akut intubation med och utan förlamning. Är J Emerg Med. 1999;17:141-143.
11. Naguib M, Samarkandi AH, El-Din ME, et al. Dosen succinylkolin krävs för utmärkta endotrakeala intubationsförhållanden. Anesth Analg. 2006;102:151-155.
12. Greenberg SB, Vender J. användningen av neuromuskulära blockeringsmedel i ICU: var är vi nu? Crit Vård Med. 2013;41:1332-1344.
13. Tran DT, Newton EK, Mount VA, et al. Rokuronium kontra succinylkolin för snabb sekvensinduktionsintubation. Cochrane databas Syst Rev. 2015;(10): CD002788.
14. Det är en av de mest populära. Effekt av neuromuskulära blockerande medel på gasutbyte hos patienter som uppvisar akut andningsbesvärssyndrom. Crit Vård Med. 2004;32:113-119.
15. Forel JM, Roch A, Marin V, et al. Neuromuskulära blockerande medel minskar inflammatoriskt svar hos patienter som uppvisar akut andningsbesvärssyndrom. Crit Vård Med. 2006;34:2749-2757.
16. Papazian L, Forel JM, Gacouin A, et al. Neuromuskulära blockerare vid tidigt akut andningsbesvärssyndrom. N Engl J Med. 2010;363:1107-1116.
17. Alhazzani W, Alshahrani M, Jaeschke R, et al. Neuromuskulära blockerande medel vid akut respiratorisk nödsyndrom: en systemisk granskning och metaanalys av randomiserade kontrollerade studier. Kritvård. 2013; 17: R43.
18. Chamorro C, Borrallo JM, Romera MA, et al. Anestesi och analgesi protokoll under terapeutisk hypotermi efter hjärtstopp: en systematisk granskning. Anesth Analg. 2010;110:1328-1335.
19. Cruise C, MacKinnon J, Tough J, Houston P. jämförelse av meperidin och pancuronium för behandling av skakningar efter hjärtkirurgi. Kan J Anaesth. 1992;39:563-568.
20. Det är en av de mest kända. Jämförelse av vekuronium och meperidin på de kliniska och metaboliska effekterna av skakning efter hypotermisk kardiopulmonell bypass. J Cardiothorac Vasc Anesth. 1995;9:147-153.
21. De flesta av dem är mycket populära. Kontinuerlig neuromuskulär blockad är förknippad med minskad dödlighet hos patienter efter hjärtstopp. Återupplivning. 2013;84:1728-1733.
22. Han är en av de mest kända. Effekt av neuromuskulära blockerare på resultat hos patienter som får terapeutisk hypotermi efter hjärtstopp. Analg Resusc Curr Res. 2013; S1.
23. Hsiang JK, Chesnut RM, skarp CB, et al. Tidig rutinförlamning för intrakraniell tryckkontroll vid allvarlig huvudskada: är det nödvändigt? Crit Vård Med. 1994;22:1471-1476.
24. L, Gopinath s, Robertson CS. Hantering av intrakraniell hypertoni. Neurol Clin. 2008;26:521-541.
25. Caldwell JE. Kliniska begränsningar av acetylkolinesterasantagonister. J Crit Vård. 2009;24:21-28.
26. Bridion (sugammadex) package insert. Whitehouse Station, NJ: Merck & Co, Inc; July 2015.
27. Sacan O, White PF, Tufanogullari B, Klein K. Sugammadex reversal of rocuronium-induced neuromuscular blockade: a comparison with neostigmine-glycopyrrolate and edrophonium-atropine. Anesth Analg. 2007;10:569-574.
28. Meistelman C, Donati F. Do we really need sugammadex as an antagonist of muscle relaxants in anesthesia? Curr Opin Anaesthesiol. 2016;29:462-467.
29. Arnot-Smith J, Smith AF. Patient safety incidents involving neuromuscular blockade: analys av Storbritanniens nationella rapporterings-och Lärandesystemdata från 2006 till 2008. Bedövning. 2010;65:1106-1113.
30. Pris DR, Mikkelsen mig, Umscheid CA, Armstrong EJ. Neuromuskulära blockeringsmedel och neuromuskulär dysfunktion förvärvad vid kritisk sjukdom: en systematisk granskning och metaanalys. Crit Vård Med. 2016;44:2070-2078.
31. Prielipp RC, Coursin DB, Scuderi PE, et al. Jämförelse av infusionskrav och återvinningsprofiler för vekuronium och cisatracurium 51W89 hos patienter med intensivvårdsavdelning. Anesth Analg. 1995;81:3-12.
32. Sparr HJ, Wierda JM, Proost JH, et al. Farmakodynamik och farmakokinetik för rokuronium hos intensivvårdspatienter. Br J Anaesth. 1997;78:267-273.