det är en oorganisk kemisk förening som naturligt existerar som ett sällsynt mineral. Det kan lösas lika i en lösning av stark syra eller bas och kallas en amfotera förening. Under vattenhaltiga betingelser dissocierar föreningen i zink-och hydroxidjoner.
Zinkhydroxididentifiering
CAS-nummer: 20427-58-1
PubChem: 9812759
ChemSpider: 7988510
Zinkhydroxidformel
dess kemiska formel är Zn (OH)2.
Zinkhydroxidegenskaper
Följande är några av föreningens unika egenskaper:
utseende
det verkar vanligtvis som ett vitt fast ämne.
Molmassa
den väger cirka 99.424 g / mol.
stabilitet
den är stabil och icke-reaktiv under normala förhållanden.
densitet
dess massa per volym är cirka 3,053 g / cm3.
Smältpunkt
den sönderdelas vid 125 grader Celsius.
löslighet
det är sparsamt lösligt i vatten och absolut olösligt i alkohol. Dess löslighetsprodukt (Ksp) är 3,0 x 10-17.
upplösning
zinkhydroxid löses upp i vattenhaltig ammoniak för att bilda ett färglöst, vattenlösligt amminkomplex. När ammoniak tillsätts i överskott reagerar hydroxidjonerna som dissocierar från Zn(OH)2 med det för att bilda ett positivt laddat tetra-komplex med ett samordningsnummer på 4. Den resulterande produkten är omgiven av ammoniakligand, vilket resulterar i upplösning.
zinkhydroxid termokemi
dess standard entalpi för bildning eller standardvärme för bildning är -642 kJ.mol-1.
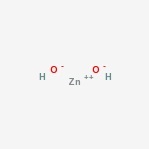
Zinkhydroxidstruktur
här är strukturen hos den amfotera föreningen.
Zinkhydroxidförekomst
det förekommer som tre sällsynta jordartsmineraler: Wulfingit, ashoverite och sweetit. Dessa sällsynta mineraler är faktiskt de naturliga polymorferna i Zn (OH)2. I materialvetenskap är något fast material polymorf om det finns i mer än en form, såsom ortorhombisk eller tetragonal.
Zinkhydroxidberedning
det framställs generellt genom tillsats av måttlig mängd natriumhydroxidlösning till en zinksaltlösning såsom zinkklorid eller zinksulfat. Dessa två föreningar reagerar under normala förhållanden för att bilda en vit fällning av Zn (OH) 2. Utspädd lösning av natriumhydroxid bör användas i denna reaktion för att förhindra att den oorganiska föreningen löses upp. Under normala förhållanden dissocierar zinksaltet för att bilda en zinkjon som associerar med två hydroxidjoner från natriumhydroxidlösning för att bilda zinkhydroxid.
Zn2++ 2oh-kubi Zn (OH)2
om överskott av natriumhydroxid tillsätts till saltlösningen, kommer fällningen av Zn (OH)2 som bildas initialt att lösas upp för att bilda en form en färglös lösning av zinkatjon som ses nedan:
Zn(OH)2 + 2oh– kubi Zn (OH)42-
denna egenskap hos zinkhydroxid används i stor utsträckning för att detektera närvaron av zinkjoner i lösning. Det är dock inte en unik metod för testning eftersom det finns många föreningar av aluminium och bly som beter sig på ett mycket liknande sätt.
den upplösande egenskapen hos zinkhydroxid kan bidra till närvaron av vattenligander som normalt omger Jonen. När överskott av natriumhydroxid tillsätts till lösningen reducerar de två hydroxidjonerna det till ett negativt laddat komplex, vilket gör det lösligt.
zinkhydroxid använder
några av de vanliga användningarna av Zn (OH) 2 är:
kirurgiska förband
det används för kirurgiska förband där det fungerar som absorberande. Stora bandage som används efter operation är belagda med zinkföreningen för att absorbera blodet från såret.
skyddande beläggning
stål och järn appliceras oftast med en beläggning av zink genom en process som kallas galvanisering. Under fuktiga förhållanden bildas ett lager zinkhydroxid på dessa galvaniserade metaller för att förhindra att de blir rostiga.
Mordant
zinkhydroxid är mycket gelatinös (gelatinös) och fungerar i allmänhet som en mordant som sätter färgämnen på olika tyger eller vävnader. Färgämne är i allmänhet ett kemiskt reagens, som bildar ett metallkomplex med Zn(OH)2 och fäster starkt på tygbeklädnaderna.
bekämpningsmedel
det används ofta som mellanprodukt för kommersiell produktion av bekämpningsmedel och pigment.

topiska lösningar
kombination av Zn (OH)2 med zinkoxid används ofta i kalaminkrämer, salvor, babypulver, hudlotioner och kosmetika. Det reagerar med starka baser på grund av dess amfotera natur för att bilda zinkater som används som orala läkemedel för att behandla flera störningar.
elektriska batterier
det används också i elektriska batterier med hög energi som är uppladdningsbara genom en reversibel reaktion.
gummiblandning
Zn (OH)2 används vid blandning eller blandning av olika ingredienser av gummi för att optimera slutanvändningsegenskaperna, beroende på konsumentens behov.
zinkföreningar
brett utbud av zinkföreningar som zinkoxid, zinksulfat och zinknitrat tillverkas kommersiellt med hjälp av den oorganiska kemikalien.
zinkhydroxid MSDS
det är i allmänhet icke brandfarligt och utgör inga risker för arbetarna. Föreningen bör dock inte smakas eller sväljas eftersom den kan innehålla få toxikologiska ingredienser.