US Pharm. 2017; 42(1):HS16-HS20.
streszczenie: leki blokujące nerwowo-mięśniowe (Nmbas) odgrywają ważną rolę w leczeniu dużej liczby pacjentów szpitalnych. Farmakologia NMBAs jest dobrze rozumiana, ale stosowanie tych środków może być kontrowersyjne. NMBAs są powszechne w sytuacjach chirurgicznych i szybkiej intubacji sekwencji, ale inne wskazania, takie jak zespół ostrej niewydolności oddechowej, hipotermia terapeutyczna i podwyższone ciśnienie wewnątrzczaszkowe, są nieco dzielące. Ważne jest, aby farmaceuci byli zaznajomieni z implikacjami klinicznymi i wynikami związanymi ze stosowaniem NMBAs. Ponadto ważne jest, aby zrozumieć równoczesne rozważania, takie jak sedacja, monitorowanie i odwrócenie. Farmaceuci w warunkach szpitalnych powinni być zaznajomieni z niedawno zatwierdzonym nowym środkiem bezpośredniego odwracania sugammadeksu (Bridion).
leki blokujące nerwowo-mięśniowe (NMBAs) odgrywają ważną rolę w leczeniu dużej liczby pacjentów szpitalnych. Oprócz ich rutynowego stosowania w znieczuleniu chirurgicznym, NMBAs mogą być cenne w wielu nowych i rozwijających się sytuacjach krytycznych opieki. Dlatego ważne jest, aby farmaceuta szpitalny zapoznał się z implikacjami klinicznymi i wynikami związanymi ze stosowaniem i odwracaniem NMBA.
farmakologia
NMBAs wywierają działanie farmakologiczne poprzez modulowanie transmisji sygnału w mięśniach szkieletowych. Potencjały działania (zmiany potencjału elektrycznego związane z przepływem impulsu wzdłuż błony mięśniowej lub komórki nerwowej) docierające do mięśni szkieletowych aktywują uwalnianie acetylocholiny do końców silnika. Acetylocholina wiąże się z receptorami nikotynowymi na płytce końcowej, co powoduje uwalnianie Na+ (sodu) do włókien mięśniowych, co wyzwala potencjał czynnościowy mięśni. Jony wapnia są następnie uwalniane do retikulum sarkoplazmatycznego, prowokując Wiązanie miozyny z aktyną. Miozyna będzie nadal wiązać się i poruszać wzdłuż miejsc aktyny, skracając sarkomere, tak długo, jak wapń jest obecny w komórce. NMBAs działają na dwa sposoby, aby zablokować ten proces.
depolaryzujące NMBAs działają jako agoniści receptorów nikotynowych.1 trzymają otwarte kanały bramkowane jonowo, co prowadzi do fascynulacji mięśniowej, aż do wyczerpania potencjału jonowego, a następnie do paraliżu.2 Sukcynylocholina jest jedynym dostępnym depolaryzującym NMBA. Niedepolaryzujące NMBAs są konkurencyjnymi antagonistami receptorów nikotynowych, blokującymi acetylocholinę na płycie końcowej silnika.1 zapobiega to rozprzestrzenianiu się potencjału czynnościowego, co czyni komórki mięśni niewrażliwymi na ruchowe impulsy nerwowe. Paraliż mięśni występuje kolejno, począwszy od małych, szybko drgających mięśni w oczach i krtani i postępuje do kończyn, tułowia, dróg oddechowych, mięśni międzyżebrowych i przepony. Powrót do zdrowia po niedrożności nerwowo-mięśniowej następuje w odwrotnej kolejności.2
w wyniku ich mechanistycznego działania na acetylocholinę, NMBAs wykazują wiele skutków ubocznych. Acetylocholina odgrywa rolę w uwalnianiu histaminy, aktywacji muskarynowej, działaniu wagolitycznym i uwalnianiu noradrenaliny. W rezultacie podczas ich stosowania obserwowano działania niepożądane, takie jak tachykardia i bradykardia, nadciśnienie i niedociśnienie oraz rozszerzenie oskrzeli i skurcz oskrzeli (tabela 1).
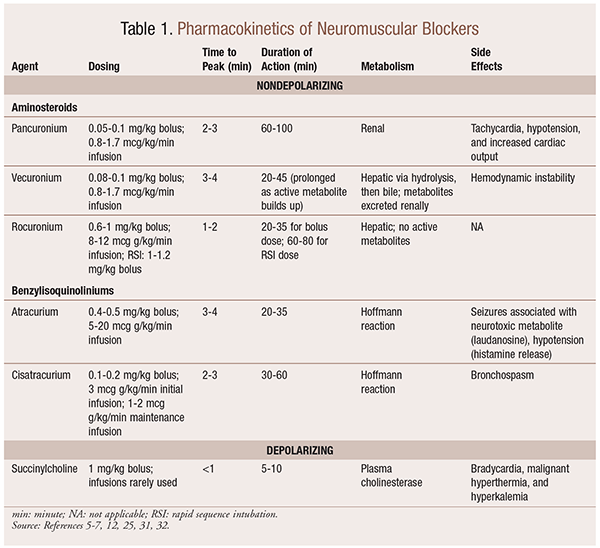
farmakokinetyka
w zależności od sytuacji, przydatne jest posiadanie różnych profili kinetycznych dostępnych podczas wybierania NMBA. Szybki początek i krótki czas trwania są przydatne w wskazaniach takich jak szybka intubacja Sekwencyjna (RSI), podczas gdy te o dłuższym czasie trwania mają większą wartość w chirurgii. W tabeli 1 przedstawiono krótki przegląd profili kinetycznych, w tym dawkowanie i częste działania niepożądane.
zastosowanie kliniczne
chirurgiczne: NMBAs były podstawą anestezjologii i chirurgii od czasu wprowadzenia sukcynylocholiny w 1952 r. 3-7 wybór środka i dawkowania różni się znacznie w zależności od procedury chirurgicznej, a także od stosowania alternatywnych środków, w tym środków znieczulających ogólnego, znieczulenia miejscowego i leków sedacyjnych IV. Głównym problemem w chirurgicznym stosowaniu NMBAs jest osiągnięcie odpowiedniego poziomu blokady mięśni bez wywoływania działań niepożądanych ze strony układu sercowo-naczyniowego lub wydłużenia całkowitego czasu trwania blokady poza ramy czasowe zabiegu chirurgicznego.4 chociaż pełna dyskusja na temat doboru środków i dawkowania w przypadku wskazań chirurgicznych wykracza poza zakres tego artykułu, kliniczne odwrócenie tych efektów zostanie uwzględnione. Monitorowanie kliniczne pacjenta, który otrzymał średnio-lub długo działającą NMBA podczas zabiegu chirurgicznego, powinno obejmować badanie stymulacji nerwów obwodowych (PNS) (omówione później).1,4
RSI: RSI jest procesem emergentnym stosowanym w celu zabezpieczenia dróg oddechowych niestabilnego pacjenta. Protokoły RSI obejmują podawanie środka indukującego głęboką sedację (np. propofolu, etomidatu, midazolamu) z prawie równoczesnym podawaniem NMBA. Pożądanym rezultatem jest dla pacjenta opracowanie zarówno amnestycznej sedacji, jak i głębokiego rozluźnienia mięśni, zwiększając w ten sposób prawdopodobieństwo udanej intubacji.8,9 dobór odpowiednich leków powinien opierać się na farmakokinetyce specyficznej dla danego leku i zmiennych klinicznych specyficznych dla pacjenta.
idealnym środkiem do RSI jest taki, który ma zarówno szybki początek, jak i szybkie przesunięcie, co skraca czas od podania do intubacji, a także zmniejsza ogólny czas trwania paraliżu.Duże opóźnienie pojawienia się leku zwiększa ogólne ryzyko niedotlenienia u pacjenta. W miarę wydłużania się czasu wystąpienia, między ostatnim oddechem przez worek a pierwszym oddechem dostarczonym przez rurkę intubacyjną musi upłynąć więcej czasu. Wydłużony czas trwania paraliżu zwiększa ryzyko nieudanej intubacji.10,11 zamiast szybkiego powrotu do zdrowia obserwowanego po zastosowaniu sukcynylocholiny, środki o dłuższym czasie działania, takie jak rokuronium, mogą wymagać wsparcia oddechowego przez ponad 90 minut.12
duży przegląd Cochrane opublikowany w 2015 r.wykazał, że sukcynylocholina była lepsza od rokuronium pod względem korzystnych warunków intubacji. Wyniki te prawdopodobnie odzwierciedlają korzystny profil kinetyczny sukcynylocholiny.W praktyce klinicznej istnieje jednak kilka ważnych przeciwwskazań do stosowania sukcynylocholiny. U pacjentów z hipertermią złośliwą w wywiadzie lub u pacjentów z wysokim ryzykiem wystąpienia hiperkaliemii rokuronium pozostaje realnym czynnikiem RSI.
Opieka krytyczna
zespół ostrej niewydolności oddechowej (Ards): jednym z podstawowych problemów klinicznych u pacjentów, u których rozwija się ARDS, jest zmniejszenie ciśnienia i stresu w płucach, zmniejszając w ten sposób dodatkowe zapalenie poza początkowym uszkodzeniem lub zniewagą. Ze względu na ich wpływ na dźwięk przeponowy, nmbas zostały zasugerowane jako metoda zmniejszania asynchronicznego respiratora i ciśnienia płucnego. Trzy podstawowe badania zostały opublikowane w języku angielskim, które oceniały stosowanie NMBAs we wczesnej fazie ARDS.14-16 każde badanie wykazało zwiększone dotlenienie u pacjentów leczonych we wczesnym okresie 48-godzinnym ciągłym wlewem cisatrakuru. Metaanaliza zbiorczych danych z tych badań z 2013 r. wykazała, że wczesne podawanie cisatrakuru spowodowało zmniejszenie barotraumy (P = .02) i zmniejszoną śmiertelność szpitalną (P = .005), ale nie miały wpływu na czas trwania wentylacji mechanicznej (P = .57).
na podstawie tych wyników uzasadnione jest rozważenie NMBAs w leczeniu ostrych ARDS u pacjentów zgłaszających się na OIOM.4 podczas gdy mechanizm działania dla wszystkich niedepolaryzujących NMBAs powinien przyczynić się do proponowanego mechanizmu korzyści klinicznych w ARDS, opublikowane randomizowane, kontrolowane badania stosowane cisatrakurium tylko w grupie interwencyjnej. W literaturze nie omówiono, czy inne leki mogą mieć wpływ na te wyniki.
hipotermia terapeutyczna: NMBAs zostały zaproponowane jako część wielu algorytmów leczenia pacjentów poddawanych hipotermii terapeutycznej po zatrzymaniu krążenia.18 kontrolując drżenie, NMBAs może zmniejszyć całkowite zużycie tlenu. Chociaż nie badano tego w leczeniu krytycznym, te zmiany fizjologiczne zostały wykazane u pacjentów poddawanych zabiegom chirurgicznym w okresie hipotermii podczas obejścia krążeniowo-oddechowego.19,20 w retrospektywnym badaniu z udziałem 111 pacjentów, którzy przeszli hipotermię terapeutyczną (18 z NMBA vs 93 bez), stwierdzono poprawę przeżycia w szpitalu (P = .004), które pozostawały istotne po wielowymiarowej analizie potencjalnych czynników zakłócających wartość początkową (95% CI, 1,56-33,38).Zaobserwowano również tendencję do poprawy klirensu mleczanów i wyników czynnościowych u pacjentów otrzymujących NMBA w trybie ciągłym.
Inne retrospektywne badanie dotyczyło selekcji NMBAs u pacjentów poddawanych hipotermii terapeutycznej po zatrzymaniu krążenia.Stosując analizę wielowymiarową, naukowcy porównali 201 pacjentów otrzymujących hipotermię terapeutyczną (29,9% z cisatrakurium vs 17,9% z wekuronium). Cisatrakurium był jedynym niezależnym pozytywnym predyktorem przeżycia z dobrym wynikiem neurologicznym (P = .014). Ze względu na retrospektywny charakter i niewielką wielkość próby tego badania trudno jest ocenić ogólną moc wykrywania jakichkolwiek różnic oferowanych przez wekuronium podobnych do obserwowanych w przypadku cisatrakuru. Możliwe jest, że zmienne zakłócające mogą mieć silniejszy wpływ niż wybrany środek neuroblockade na ogólne wyniki.
podwyższone ciśnienie wewnątrzczaszkowe (ICP): ICP jest rutynowo zarządzany przez głęboką sedację i analgezję, zmniejszając zużycie tlenu i metabolizm mózgowy, kontrolując ból, ruch i asynchronikę respiratora.2 dodanie NMBAs rozważa się tylko wtedy, gdy głęboka sedacja jest niewystarczająca do kontrolowania niebezpiecznego wzrostu ICP, często w wyniku kaszlu, ssania lub dreszczy.Wykazano, że wczesne stosowanie NMBA prowadzi do zmniejszenia śmiertelności, ale kosztem zwiększonej zachorowalności. Hsiang i współpracownicy dokonali retrospektywnego przeglądu danych dotyczących kohorty 514 pacjentów z banku danych dotyczących śpiączki pourazowej w celu oceny zastosowania wczesnego rozszerzonego stosowania nmba w porównaniu z krótkotrwałym stosowaniem nmba. Pobyt na OIOM był średnio o 3 dni dłuższy, u większej liczby pacjentów rozwinęło się zapalenie płuc i zaobserwowano tendencję do zwiększonego ryzyka sepsy u pacjentów z przedłużonym NMBA. Dodatkowo, chociaż w grupie nie-NMBA było więcej zgonów, Grupa NMBA miała większą częstość występowania wegetatywnych lub poważnie niepełnosprawnych ocalałych.Stosowanie NMBAs w zwiększonym ICP prowadzi do istotnych trudności w monitorowaniu czynności neurologicznych i aktywności napadowej.
leki odwracające
chociaż niezbyt często na OIOM, odwrócenie NMBAs jest ważnym elementem leczenia chirurgicznego pacjentów otrzymujących leki paralityczne. W przeszłości miało to miejsce podczas stosowania neostygminy pooperacyjnie.Neostygmina jest inhibitorem acetylocholinoesterazy (ACheI), który zmniejsza rozpad acetylocholiny w płytce końcowej silnika, powodując wzrost stężenia acetylocholiny. Ponieważ niedepolaryzujące NMBAs są konkurencyjnymi antagonistami receptora nikotynowego, Neostygmina zwiększa konkurencyjną presję acetylocholiny w miejscu działania leku. Chociaż Neostygmina jest skuteczna w poprawianiu czasów rekonwalescencji po podaniu NMBA, może być zawodna ze względu na pośredni mechanizm działania.4,25 jeśli stężenia NMBA są wystarczająco wysokie, antagonizm nie może być przezwyciężony niezależnie od podanej dawki antycholinoesterazy. Wykazano, że brak całkowitego odwrócenia NMBAs pooperacyjnie zwiększa częstość występowania resztkowego osłabienia i dysfagii oraz ryzyko aspiracji.Ponadto Neostygmina ma swoje własne działania niepożądane, ponieważ działa zarówno na receptory nikotynowe, jak i muskarynowe. Podczas gdy receptor nikotynowy jest blokowany przez NMBA, działanie neostygminy na receptor muskarynowy powoduje zwiększone skurcze oskrzeli, ruchliwość żołądka, wydzielanie i bradykardię.W celu zmniejszenia tego ryzyka należy stosować agonistę antymuskarynowego, takiego jak atropina lub glikopirolan z neostygminą w celu zrównoważenia zwiększonej aktywacji muskarynowej.
w grudniu 2015 r.FDA zatwierdziła sugammadeks (Bridion), nowy środek do bezpośredniego odwracania rokuronium i wekuronium. Sklasyfikowany jako cyklodekstryna gamma, sugammadeks tworzy kompleks lekowy z wolnym nmba, zmniejszając w ten sposób dostępne stężenia leków. Wpływ farmakokinetyczny na stężenie NMBA jest zarówno szybki, jak i całkowity. Jednak ze względu na ich rozmiar sugammadeks nie ma wpływu na cisatrakurium, atrakurium i sukcynylocholinę.Główną zaletą sugammadeksu w porównaniu z neostygminą jest szybkość, z jaką następuje odwrócenie (2 minuty w porównaniu z 17 minutami).27 W Przeciwieństwie Do ACheIs, sugammadeks nie ma efektu sufitu; to znaczy, przy wystarczająco dużej dawce sugammadeksu, każda głębokość paraliżu może być szybko odwrócona.26,28 wreszcie, stosowanie sugammadeksu nie ma farmakodynamicznego wpływu na receptory muskarynowe, znacznie zmniejszając profil działań niepożądanych leku i unikając konieczności jednoczesnego podawania leków przeciwmuskarynowych. Dawkowanie sugammadeksu opiera się na poziomie blokady nerwowo-mięśniowej, w zakresie od 2 mg/kg mc.w przypadku umiarkowanej blokady do 16 mg/kg mc. w przypadku natychmiastowego odwrócenia.26,28
sedacja
niezwykle ważne jest, aby uznać, że chociaż NMBAs zapobiegają ruchom mięśniowym, nie mają one wpływu na poziom świadomości pacjenta lub zdolność do postrzegania bólu lub dyskomfortu, co prowadzi do zjawiska opisanego jako niezamierzona świadomość.1 niezależnie od tego, czy chodzi o wskazania chirurgiczne, czy Medyczne, pacjenci mogą być narażeni na ryzyko niewystarczającej sedacji lub analgezji. Seria przypadków wykazała, że do 18% pacjentów utrzymuje pewien stopień świadomości podczas sparaliżowania.29 ci pacjenci zgłaszają odczucia od stanu przypominającego sen do wyraźnej świadomości. Nie ma badań zapewniających konkretne wytyczne dotyczące postępowania z niezamierzoną świadomością podczas blokady nerwowo-mięśniowej. Niezależnie od tego, standardową praktyką jest ustalanie i utrzymywanie odpowiedniego poziomu analgezji i głębokiej sedacji przed i podczas blokady nerwowo-mięśniowej.1
monitorowanie
monitorowanie pacjentów z NMBAs jest konieczne, ale metody są często skomplikowane przez przebieg kliniczny, jednoczesne podawanie środków uspokajających i przeciwbólowych oraz dodatkowe metody terapeutyczne (np. hipotermia terapeutyczna). PNS jest powszechnie uważany za metodę monitorowania z wyboru, ale ma ograniczenia. Dodatkowe parametry monitorowania obejmują spontaniczne oddychanie i trendy parametrów życiowych.
PNS jest zalecany niezależnie u pacjentów otrzymujących ciągły wlew NMBAs oraz jako uzupełnienie w innych sytuacjach klinicznych.1 zestaw czterech urządzeń przymocowanych do oczodołu, nerwu łokciowego lub nerwu strzałkowego dostarcza cztery kolejne bodźce elektryczne. W przypadku braku blokady nerwowo-mięśniowej, dla wszystkich czterech bodźców obserwuje się równą odpowiedź na drgania, w wyniku czego stosunek T4/T1 wynosi 1. U sparaliżowanego pacjenta odpowiedź na drgawki powinna być obserwowana przy pierwszym bodźcu, ale powinna się ona zmniejszać z powodu blokady neuronów ruchowych. Celem jest osiągnięcie współczynnika T4/T1 na poziomie około 0,25.1
powikłania
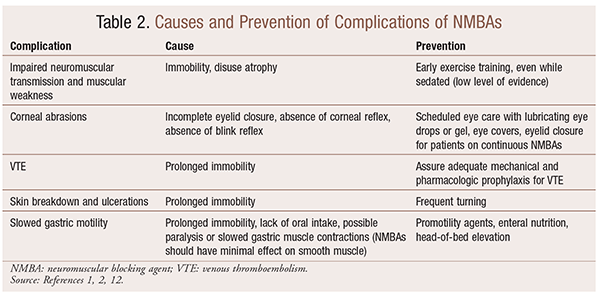
chociaż istnieją znaczące korzyści ze stosowania NMBAs w określonych sytuacjach, istnieją również krótko-i długoterminowe powikłania. W ostrej sytuacji stosowanie NMBAs może prowadzić do zwiększonego pobytu na OIOM, przedłużonej wentylacji mechanicznej, żylnej choroby zakrzepowo-zatorowej, łzawienia i owrzodzeń skóry, infekcji, uszkodzenia rogówki i anafilaksji. Długotrwałe podawanie może prowadzić do unieruchomienia lub wydłużenia czasu regeneracji z powodu upośledzenia transmisji nerwowo-mięśniowej i osłabienia mięśni.W tabeli 2 przedstawiono kilka zaleceń dotyczących zapobiegania tym skutkom.
wnioski
farmaceuta może odgrywać bardzo ważną rolę w regulacji i stosowaniu NMBAs w szerokim zakresie placówek klinicznych. Dzięki zrozumieniu mechanizmu działania, wskazań terapeutycznych, literatury pomocniczej i klinicznych skutków ubocznych tej wysokiej klasy leków, farmaceuta może mieć nieoceniony wpływ na opiekę nad pacjentem i bezpieczeństwo pacjenta.
1. Murray MJ, DeBlock H, Erstad B, et al. Wytyczne praktyki klinicznej dla trwałej blokady nerwowo-mięśniowej u dorosłych pacjentów w stanie krytycznym. Crit Care Med. 2016;44:2079-2103.
2. Warr J, Thiboutot Z, Rose L, et al. Aktualne zastosowania terapeutyczne, farmakologia i rozważania kliniczne leków blokujących nerwowo-mięśniowe u osób dorosłych w stanie krytycznym. Ann Pharmacother. 2011;45:1116-1126.
3. Foldes FF, McNall PG, Borrego-Hinojosa JM. Sukcynylocholina: nowe podejście do relaksacji mięśni w anestezjologii. N Engl J Med. 1952;247:596-600.
4. Naguib m, Lien CA. Farmakologia leków zwiotczających mięśnie i ich antagonistów. Na: Znieczulenie Millera. 7.ed. Miller RD, Eriksson LI, Fleisher LA, et al, eds. Philadelphia, PA: Churchill Livingstone; 2010.
5. Anektyna (sukcynylocholina) ulotka informacyjna. Princeton, NJ: Sandoz Inc; wrzesień 2010.
6. Rokuronium ulotka dla pacjenta. Irvine, CA: Teva Parenteral Medicines, Inc; listopad 2008.
7. Nimbex (cisatracurium) ulotka informacyjna. North Chicago, IL: Abbott Laboratories; 2010.
8. Sakles JC, Laurin EG, RANTAPAA AA, Panacek EA. Leczenie dróg oddechowych w oddziale ratunkowym; jednoroczne badanie 610 intubacji tchawicy. Ann Emerg Med. 1998;31:325-332.
9. Tayal VS, Riggs RW, Marx JA, et al. Intubacja metodą Rapid-sequence w Klinice Medycyny Ratunkowej: wskaźnik sukcesu i zdarzenia niepożądane w okresie dwóch lat. Acad Emerg Med. 1999;6:31-37.
10. Li J, Murphy-Lavoie H, Bugas C, et al. Powikłania intubacji awaryjnej z paraliżem i bez paraliżu. Am J Emerg Med. 1999;17:141-143.
11. Naguib m, Samarkandi AH, El-Din ME, et al. Dawka sukcynylocholiny wymagana dla doskonałych warunków intubacji dotchawiczej. Anesth Analg. 2006;102:151-155.
12. Greenberg SB, Vender J. zastosowanie leków blokujących nerwowo-mięśniowo w OIOM: gdzie teraz jesteśmy? Crit Care Med. 2013;41:1332-1344.
13. Tran DT, Newton EK, Mount VA i in. Rokuronium kontra sukcynylocholina do szybkiej intubacji sekwencyjnej. Cochrane Database Syst Rev. 2015; (10): CD002788.
14. Gainnier M, Roch a, Forel JM i in. Wpływ leków blokujących przewodnictwo nerwowo-mięśniowe na wymianę gazową u pacjentów z zespołem ostrej niewydolności oddechowej. Crit Care Med. 2004;32:113-119.
15. Forel JM, Roch a, Marin V i in. Leki blokujące przewodnictwo nerwowo-mięśniowe zmniejszają odpowiedź zapalną u pacjentów z zespołem ostrej niewydolności oddechowej. Crit Care Med. 2006;34:2749-2757.
16. Papazian L, Forel JM, Gacouin A, et al. Blokery nerwowo-mięśniowe we wczesnym zespole ostrej niewydolności oddechowej. N Engl J Med. 2010;363:1107-1116.
17. Alhazzani w, Alshahrani M, Jaeschke R, et al. Neuromuscular blocking agents in acute respiratory distress syndrome: a systemic review and meta-analysis of randomized controlled trials. Opieka Krytyczna. 2013; 17: R43.
18. Chamorro C, Borrallo JM, Romera MA, et al. Protokół znieczulenia i analgezji podczas hipotermii terapeutycznej po zatrzymaniu krążenia: przegląd systematyczny. Anesth Analg. 2010;110:1328-1335.
19. Cruise C, MacKinnon J, Tough J, Houston P. porównanie meperydyny i pankuronium w leczeniu drżenia po operacji serca. Can J Anaesth. 1992;39:563-568.
20. Sladen RN, Berend JZ, Fassero JS i in. Porównanie wekuronium i meperydyny na temat klinicznego i metabolicznego wpływu dreszczy po hipotermicznym pominięciu krążenia. J Cardiothorac Vasc Anesth. 1995;9:147-153.
21. Salciccioli JD, Cocchi MN, Rittenberger JC, et al. Ciągła blokada nerwowo-mięśniowa jest związana ze zmniejszoną śmiertelnością u pacjentów po zatrzymaniu krążenia. Reanimacja. 2013;84:1728-1733.
22. Baker WL, Geronila G, Kallur R, et al. Wpływ leków blokujących przewodnictwo nerwowo-mięśniowe na wyniki leczenia pacjentów otrzymujących hipotermię terapeutyczną po zatrzymaniu krążenia. Analg Resusc Curr Res. 2013; S1.
23. Hsiang JK, Chesnut RM, Crisp CB i in. Wczesny, rutynowy paraliż do kontroli ciśnienia wewnątrzczaszkowego w ciężkim urazie głowy: czy to konieczne? Crit Care Med. 1994;22:1471-1476.
24. Rangel-Castilla L, Gopinath S, Robertson CS. Postępowanie w nadciśnieniu śródczaszkowym. Neurol Clin. 2008;26:521-541.
25. Caldwell JE. Ograniczenia kliniczne antagonistów acetylocholinoesterazy. J Crit Care. 2009;24:21-28.
26. Bridion (sugammadex) package insert. Whitehouse Station, NJ: Merck & Co, Inc; July 2015.
27. Sacan O, White PF, Tufanogullari B, Klein K. Sugammadex reversal of rocuronium-induced neuromuscular blockade: a comparison with neostigmine-glycopyrrolate and edrophonium-atropine. Anesth Analg. 2007;10:569-574.
28. Meistelman C, Donati F. Do we really need sugammadex as an antagonist of muscle relaxants in anesthesia? Curr Opin Anaesthesiol. 2016;29:462-467.
29. Arnot-Smith J, Smith AF. Patient safety incidents involving neuromuscular blockade: analiza danych brytyjskiego krajowego systemu raportowania i uczenia się z lat 2006-2008. Znieczulenie. 2010;65:1106-1113.
30. Price DR, Mikkelsen ME, Umscheid CA, Armstrong EJ. Leki blokujące nerwowo-mięśniowe i zaburzenia nerwowo-mięśniowe nabyte w chorobie krytycznej: przegląd systematyczny i metaanaliza. Crit Care Med. 2016;44:2070-2078.
31. Prielipp RC, Coursin DB, Scuderi PE, et al. Porównanie zapotrzebowania na wlew i profili odzysku wekuronium i cisatrakurium 51W89 u pacjentów z oddziału intensywnej terapii. Anesth Analg. 1995;81:3-12.
32. Sparr HJ, Wierda JM, Proost JH i in. Farmakodynamika i farmakokinetyka rokuronium u pacjentów intensywnej terapii. Br J Anaesth. 1997;78:267-273.