| Citric acid | |
|---|---|
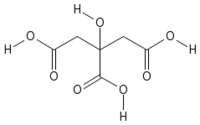
|
|
| General | |
| Systematic name | 2-hydroxypropane- 1,2,3-tricarboxylic acid |
| Empirical formula | C6H8O7 |
| SMILES | C(C(=O)O)C(CC(=O)O)(C(=O)O)O |
| Molar mass | 192.13 g/mol |
| Appearance | crystalline white solid |
| CAS number | |
| Properties | |
| Density and phase | 1.665 g/cm³ |
| Solubility in water | 133 g/100 ml (20°C) |
| Melting point | 153 °C (307.4F, 426 K) |
| Boiling point | decomposes at 175 °C (448 K) |
| Acidity (pKa) | pKa1=3.15 pKa2=4.77 pKa3=6.40 |
| Hazards | |
| MSDS | External MSDS |
| Main hazards | skin and eye irritant |
| Supplementary data page | |
| Thermodynamic data |
Phase behaviour Solid, liquid, gas |
| Spectral data | UV, IR, NMR, MS |
| Related compounds | |
| Related compounds | sodium citrate, calcium citrate |
Citric acid is a weak organic acid found dans les agrumes. C’est un conservateur naturel et est également utilisé pour ajouter un goût acide (acide) aux aliments et aux boissons gazeuses. En biochimie, il est important en tant qu’intermédiaire dans le cycle de l’acide citrique et intervient donc dans le métabolisme de presque tous les êtres vivants. Il sert également d’agent de nettoyage respectueux de l’environnement et agit comme antioxydant.
L’acide citrique existe dans une variété de fruits et légumes, mais il est surtout concentré dans les citrons et les citrons verts, où il peut représenter jusqu’à 8% du poids sec du fruit.
Propriétés
À température ambiante, l’acide citrique est une poudre cristalline blanche. Il peut exister soit sous forme anhydre (sans eau), soit sous forme monohydratée contenant une molécule d’eau pour chaque molécule d’acide citrique. La forme anhydre cristallise à partir de l’eau chaude, tandis que le monohydrate se forme lorsque l’acide citrique est cristallisé à partir de l’eau froide. Le monohydrate peut être converti en forme anhydre en le chauffant au-dessus de 74°C.
Chimiquement, l’acide citrique partage les propriétés d’autres acides carboxyliques. Lorsqu’il est chauffé au-dessus de 175°C, il se décompose par la perte de dioxyde de carbone et d’eau.

Histoire
La découverte de l’acide citrique a été attribuée à l’alchimiste islamique du 8ème siècle Jabir Ibn Hayyan (Geber). Les érudits médiévaux en Europe étaient conscients de la nature acide des jus de citron et de citron vert; ces connaissances sont consignées dans l’encyclopédie du 13ème siècle Speculum Majus (Le Grand Miroir), compilée par Vincent de Beauvais. L’acide citrique a été isolé pour la première fois en 1784 par le chimiste suédois Carl Wilhelm Scheele, qui l’a cristallisé à partir de jus de citron. La production d’acide citrique à l’échelle industrielle a commencé en 1860, basée sur l’industrie italienne des agrumes.
En 1893, C. Wehmer a découvert que la moisissure au pénicillium pouvait produire de l’acide citrique à partir du sucre. Cependant, la production microbienne d’acide citrique n’est devenue industriellement importante que lorsque la Première Guerre mondiale a perturbé les exportations italiennes d’agrumes. En 1917, le chimiste alimentaire américain James Currie a découvert que certaines souches de la moisissure Aspergillus niger pouvaient être des producteurs efficaces d’acide citrique, et Pfizer a commencé la production industrielle en utilisant cette technique deux ans plus tard.
Production
Dans cette technique de production, qui est encore aujourd’hui la principale voie industrielle vers l’acide citrique utilisée, les cultures d’Aspergillus niger sont alimentées au saccharose pour produire de l’acide citrique. Après filtration du moule de la solution résultante, l’acide citrique est isolé en le précipitant avec de la chaux (hydroxyde de calcium) pour donner du sel de citrate de calcium, à partir duquel l’acide citrique est régénéré par traitement à l’acide sulfurique.
Alternativement, l’acide citrique est parfois isolé du bouillon de fermentation par extraction avec une solution hydrocarbonée de la base organique trilaurylamine, suivie d’une ré-extraction de la solution organique par de l’eau.
Cycle de Krebs
L’acide citrique fait partie d’une série de composés impliqués dans l’oxydation physiologique des graisses, des protéines et des glucides en dioxyde de carbone et en eau.
Cette série de réactions chimiques est au cœur de presque toutes les réactions métaboliques et est la source des deux tiers de l’énergie d’origine alimentaire dans les organismes supérieurs. Il a été découvert par le sir Hans Adolf Krebs. Krebs a reçu le prix Nobel de physiologie ou médecine en 1953 pour cette découverte. La série de réactions est correctement connue sous le nom de cycle de l’acide tricarboxylique, mais elle est également connue sous le nom de cycle de l’acide citrique ou cycle de Krebs.
Utilise
Additif alimentaire
En tant qu’additif alimentaire, l’acide citrique est utilisé comme arôme et conservateur dans les aliments et les boissons, en particulier les boissons gazeuses; il est désigné par le numéro E E330. Les sels de citrate de divers métaux sont utilisés pour fournir ces minéraux sous une forme biologiquement disponible dans de nombreux compléments alimentaires. Les propriétés tampons des citrates sont utilisées pour contrôler le pH dans les nettoyants ménagers et les produits pharmaceutiques.
Adoucissement de l’eau
La capacité de l’acide citrique à chélater les métaux le rend utile dans les savons et les détergents à lessive. En chélatant les métaux dans de l’eau dure, ces nettoyants produisent de la mousse et fonctionnent mieux sans avoir besoin d’adoucissement de l’eau. De même, l’acide citrique est utilisé pour régénérer les matériaux échangeurs d’ions utilisés dans les adoucisseurs d’eau en éliminant les ions métalliques accumulés sous forme de complexes de citrate.
Autres
Il est utilisé dans l’industrie biotechnologique et pharmaceutique pour passiver la tuyauterie de processus de haute pureté au lieu d’utiliser de l’acide nitrique, car l’acide nitrique est un problème d’élimination dangereux une fois qu’il est utilisé à cette fin, alors que l’acide citrique ne l’est pas.
C’est également l’ingrédient actif de certaines solutions de nettoyage ménager pour salles de bains et cuisines. Une solution avec une concentration de 6% d’acide citrique éliminera les taches d’eau dure du verre sans frotter.
L’acide citrique est couramment utilisé comme tampon pour augmenter la solubilité de l’héroïne brune. Des sachets d’acide citrique à usage unique ont été utilisés pour inciter les utilisateurs d’héroïne à échanger leurs aiguilles sales contre des aiguilles propres dans le but de réduire la propagation du sida et de l’hépatite. D’autres acidifiants utilisés pour l’héroïne brune sont l’acide ascorbique, l’acide acétique et l’acide lactique: en leur absence, l’injecteur de drogue remplacera souvent le jus de citron ou le vinaigre.
L’acide citrique est l’un des produits chimiques nécessaires à la synthèse de l’HMTD; un explosif hautement sensible à la chaleur, au frottement et aux chocs, similaire au peroxyde d’acétone (également connu sous le nom de « Mère de Satan »). Pour cette raison, l’achat de grandes quantités d’acide citrique peut être considéré par certains gouvernements comme un indicateur d’une activité terroriste potentielle.
De l’acide citrique peut également être ajouté à la crème glacée pour séparer les globules gras. Il peut également être ajouté aux recettes à la place du jus de citron frais. L’acide citrique est utilisé avec le bicarbonate de sodium dans une large gamme de formules effervescentes, à la fois pour l’ingestion (p. ex. poudres et comprimés) et pour les soins personnels (p. ex. sels de bain, perles de bain et méthode de nettoyage bonne pour la graisse).
Lorsqu’il est appliqué sur les cheveux, l’acide citrique ouvre la cuticule. Lorsque la cuticule est ouverte, elle permet une pénétration plus profonde des agents de nettoyage. Il n’est généralement pas recommandé si vous faites une coloration artificielle des cheveux, sauf si vous essayez de retirer la couleur. Il peut être utilisé en shampooing. Il est également utilisé dans le produit « Sun-In » pour blanchir les cheveux pour la même raison.
L’acide citrique est également utilisé comme bain d’arrêt en photographie. Le révélateur est normalement alcalin, donc un acide doux le neutralisera, augmentant l’efficacité du bain d’arrêt par rapport à l’eau ordinaire.
Sécurité
L’acide citrique est reconnu comme étant sans danger pour les aliments par toutes les principales agences nationales et internationales de réglementation des aliments. Il est naturellement présent dans presque toutes les formes de vie et l’excès d’acide citrique est facilement métabolisé et éliminé du corps.
Fait intéressant, malgré son omniprésence dans le corps, on sait qu’il existe une intolérance à l’acide citrique dans l’alimentation. Peu d’informations sont disponibles car la maladie semble rare, mais comme d’autres types d’intolérance alimentaire, elle est souvent décrite comme une réaction « pseudo-allergique ».
Le contact avec de l’acide citrique sec ou avec des solutions concentrées peut provoquer une irritation de la peau et des yeux, de sorte que des vêtements de protection doivent être portés lors de la manipulation de ces matériaux.
Allégations relatives au cancer
Il y a eu des rapports erronés selon lesquels l’E330 est une cause majeure de cancer. On pense que cela a été provoqué par un malentendu et une confusion sur le mot Krebs. Dans ce cas, il fait référence à Sir Hans Adolf Krebs, découvreur du cycle de Krebs, et non au mot allemand pour cancer.
- Jardin, J., Roberts, K., Taylor, A. et Robinson, D. (2003). « Evaluation of the Provision of Single Use Citric Acid Sachets to Injecting Drug Users » (pdf). Centre Écossais pour l’Infection et la Santé Environnementale.
- http://www.silverprint.co.uk/chem4.html