| Citric acid | |
|---|---|
 |
|
| General | |
| Systematic name | 2-hydroxypropane- 1,2,3-tricarboxylic acid |
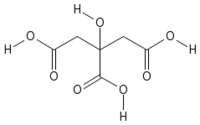
| Empirical formula | C6H8O7 |
| SMILES | C(C(=O)O)C(CC(=O)O)(C(=O)O)O |
| Molar mass | 192.13 g/mol |
| Appearance | crystalline white solid |
| CAS number | |
| Properties | |
| Density and phase | 1.665 g/cm³ |
| Solubility in water | 133 g/100 ml (20°C) |
| Melting point | 153 °C (307.4F, 426 K) |
| Boiling point | decomposes at 175 °C (448 K) |
| Acidity (pKa) | pKa1=3.15 pKa2=4.77 pKa3=6.40 |
| Hazards | |
| MSDS | External MSDS |
| Main hazards | skin and eye irritant |
| Supplementary data page | |
| Thermodynamic data |
Phase behaviour Solid, liquid, gas |
| Spectral data | UV, IR, NMR, MS |
| Related compounds | |
| Related compounds | sodium citrate, calcium citrate |
Citric acid is a weak organic acid found 柑橘系の果物で。 それは天然の防腐剤であり、食品や清涼飲料に酸性(酸っぱい)味を加えるためにも使用されます。 生化学では、クエン酸サイクルの中間体として重要であり、したがって、ほぼすべての生物の代謝に起こる。 それはまた環境的に温和な洗浄剤として役立ち、酸化防止剤として機能します。クエン酸は様々な果物や野菜に存在しますが、レモンやライムに最も集中しており、果物の乾燥重量の8%を占めることができます。
クエン酸は、果物の乾燥重量の8%を占めることができます。
クエン酸は、さまざまな果物や野菜に存在しますが、レモンやライムに最も集中しています。
プロパティ
室温では、クエン酸は白色の結晶性粉末である。 それは無水(水なしの)形態で、またはクエン酸のあらゆる分子のための1つの水分子を含んでいる一水化物としてあることができます。 無水形態は温水から結晶化し、クエン酸が冷水から結晶化すると一水和物が形成される。 一水和物は、それを74℃以上に加熱することによって無水形態に変換することができる。
化学的に、クエン酸は他のカルボン酸の特性を共有する。 175°Cの上で熱されたとき、それは二酸化炭素および水の損失によって分解します。

歴史
クエン酸の発見は、8世紀のイスラム錬金術師Jabir Ibn Hayyan(Geber)に信じられています。 ヨーロッパの中世の学者は、レモンとライムジュースの酸性の性質を認識していました; このような知識は、13世紀のVincent of Beauvaisによって編纂されたencyclopedia Speculum Majus(The Great Mirror)に記録されています。 クエン酸は、1784年にスウェーデンの化学者Carl Wilhelm Scheeleによって最初に単離され、レモン汁から結晶化した。 工業規模のクエン酸の生産は、イタリアの柑橘類産業に基づいて1860年に始まりました。
1893年、C.Wehmerはペニシリウム型が砂糖からクエン酸を生成できることを発見しました。 しかし、クエン酸の微生物生産は、第一次世界大戦がイタリアの柑橘類の輸出を混乱させるまで工業的に重要にならなかった。 1917年、アメリカの食品化学者ジェームズ-カリーは、カビAspergillus nigerの特定の株が効率的なクエン酸生産者であることを発見し、ファイザーは二年後にこの技術を使用して工業レベルの生産を開始した。
生産
今日でもクエン酸への主要な工業ルートであるこの生産技術では、アスペルギルス-ニジェールの培養物をスクロースに供給してクエン酸を 得られた溶液から鋳型を濾過した後、クエン酸を石灰(水酸化カルシウム)で沈殿させて単離し、クエン酸カルシウム塩を得、そこからクエン酸を硫酸で処理することによって再生する。
あるいは、クエン酸は、有機塩基トリラウリルアミンの炭化水素溶液で抽出し、続いて有機溶液から水で再抽出することによって発酵ブロスから単クエン酸は、脂肪、タンパク質、および炭水化物の二酸化炭素および水への生理学的酸化に関与する一連の化合物の1つである。
クエン酸
この一連の化学反応は、ほぼすべての代謝反応の中心であり、高等生物における食物由来のエネルギーの3分の2の源です。
それはハンス-アドルフ-クレブス卿によって発見された。 クレブスはこの発見により1953年のノーベル生理学-医学賞を受賞した。 一連の反応は、トリカルボン酸サイクルとして適切に知られているが、クエン酸サイクルまたはクレブスサイクルとしても知られている。
使用
食品添加物
食品添加物として、クエン酸は食糧および飲料、特に清涼飲料でflavouringおよび防腐剤として使用されます;それはe数E330 さまざまな金属のクエン酸塩が多くの食餌療法の補足の生物学的に利用できる形態のそれらの鉱物を渡すのに使用されています。 クエン酸塩の緩衝の特性が世帯の洗剤および医薬品のpHを制御するのに使用されています。
水軟化
クエン酸は金属をキレートする能力があり、石鹸や洗濯洗剤に役立ちます。 硬水の金属をキレート環を作ることによって、それはこれらの洗剤が泡を作り出し、水柔らかくなることのための必要性なしでよりよく働くことを 同様に、クエン酸は、クエン酸錯体として蓄積された金属イオンを除去することにより、軟水剤に使用されるイオン交換材料を再生するために使用さ
その他
クエン酸はそうではありませんが、硝酸は、この目的のために使用されると、有害な処分の問題であるため、硝酸を使用する代わりに、高純度のプロセス配管を不動態化するために、バイオテクノロジーおよび製薬業界で使用されています。それはまた浴室および台所のためのある世帯のクリーニングの解決の有効成分です。
それはまた有効成分です。
それはまた有効成分です。 クエン酸の6%の集中が付いている解決はごしごし洗うことなしでガラスから硬水の汚れを取除きます。
クエン酸は、茶色のヘロインの溶解度を高めるための緩衝剤として一般的に使用されています。 Single-useクエン酸の磨き粉は誘導としてエイズおよび肝炎の広がりを減らすためにきれいな針のために彼らの汚れた針を交換するためにヘロインのユーザーを得るのに使用されていました。 茶色のヘロインに使用される他の酸性化剤は、アスコルビン酸、酢酸、乳酸である:彼らの不在では、薬物注入器は、多くの場合、レモン汁や酢を代用します。クエン酸はHMTDの合成に必要な化学物質の一つであり、過酸化アセトン(”サタンの母”としても知られている)に似た非常に熱、摩擦、衝撃に敏感な爆発物である。 このため、大量のクエン酸の購入は、潜在的なテロ活動の指標としていくつかの政府によって見られるかもしれません。
クエン酸は、脂肪球を別々に保つためにアイスクリームに加えることもできます。 それは同様に新鮮なレモン汁の代わりにレシピに追加することができます。 クエン酸は摂取(例えば粉およびタブレット)と個人的な心配(例えば入浴剤、浴室のビードおよびグリースでよい洗浄法)のために両方の発泡性の方式の広い範囲で重炭酸ナトリウムと共に、使用される。
髪に適用すると、クエン酸はキューティクルを開きます。 キューティクルが開いている間、それは洗浄剤のより深い浸透を可能にする。 あなたが色を取り除くしようとしていない限り、あなたが行われた任意の人工毛の着色を持っている場合、それは一般的にお勧めしません。 それはシャンプーで使用することができます。 また、同じ理由で髪を漂白するために”Sun-In”製品でも使用されています。
クエン酸は、写真撮影の停止浴としても使用されます。 開発者は普通アルカリです、従って穏やかな酸は普通水と比較されたとき停止浴室の有効性を高めるそれを中和します。
安全性
クエン酸は、すべての主要な国内および国際的な食品規制当局によって食品に使用するのに安全であると認識されています。
安全性
クエン酸 それは生命のほとんどすべての形態に自然にあり、余分なクエン酸はボディから容易に新陳代謝し、除去されます。興味深いことに、体内での遍在性にもかかわらず、食事中のクエン酸に対する不耐性が存在することが知られています。 条件がまれのようであるが他のタイプの食糧不寛容のように頻繁に”擬似アレルギー”の反作用として記述されているので少し情報は利用できます。
乾燥クエン酸または濃縮溶液と接触すると、皮膚や眼の刺激を引き起こす可能性があるため、これらの材料を扱うときは防護服を着用する必
がんの主張
E330ががんの主な原因であるという誤った報告がありました。 これは、Krebsという言葉に対する誤解と混乱によってもたらされたと考えられています。 この場合、それはKrebsサイクルの発見者であるHans Adolf Krebsを指し、ドイツ語の癌を指す言葉ではありません。
- Garden,J.,Roberts,K.,Taylor,A.,And Robinson,D.(2003). “薬物使用者への一回限りのクエン酸サシェの提供の評価”(pdf)。 感染症と環境衛生のためのスコットランドのセンター。
- http://www.silverprint.co.uk/chem4.html