Sulfur hexafluoride or SF6 is an inorganic, greenhouse gas. É não inflamável, inodoro e incolor, e é um excelente isolador. É uma molécula octaédrica hipervalente que tem sido um tópico interessante de conversa entre entusiastas de química.Henri Moissan descobriu a existência do SF6. Incidentalmente, ele também é o descobridor de flúor. A forma padrão de sintetizar SF6 é expor S8 A F2. Este método faz com que a formação de alguns fluoretos de enxofre, mas aqueles que podem ser eliminados através de aquecimento e, em seguida, usando NaOH para remover qualquer adicional SF4 moléculas.
SF6 não pode ser utilizado imediatamente após a síntese. Precisa de ser purificado para se livrar de todos os fluoretos reactivos. Depois disso, tem de passar por pirólise.
aqui neste post, vamos aprender a estrutura de Lewis do SF6 e seus ângulos de ligação, Geometria Molecular e forma que podem nos ajudar a entender as propriedades físicas desta molécula.
| Name of molecule | Sulphur Hexafluoride ( SF6) |
| No of Valence Electrons in the molecule | 48 |
| Hybridization of SF6 | sp3d2 hybridization |
| Bond Angles | 90 degrees |
| Molecular Geometry of SF6 | Octahedral |
Contents
SF6 Valence Electrons
To determine the Lewis Estrutura de qualquer molécula, primeiro precisamos saber o número total de elétrons de Valência. Aqui vamos descobrir o número total de elétrons de Valência para SF6 adicionando os elétrons de Valência para os átomos de enxofre e flúor.
número Total de elétrons de Valência nos elétrons de Valência SF6 dos elétrons de enxofre + Valência dos elétrons de flúor
enxofre tem seis elétrons de Valência.o flúor tem sete elétrons de Valência, mas como existem seis átomos de flúor nesta molécula, vamos multiplicar este número por 6.
= 6 + 7*6
= 6 + 42
= 48 elétrons de valência
Assim SF6 tem 48 elétrons de valência que vai nos ajudar a desenhar o Lewis Ponto de Estrutura de SF6.
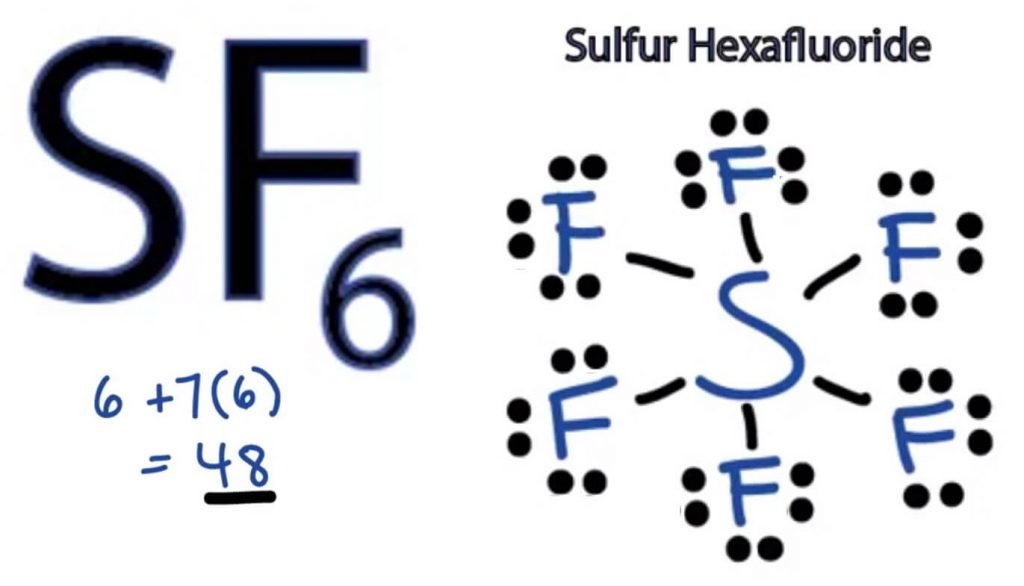
SF6 Lewis Structure
The Lewis Dot structure of any molecule is a pictorial representation of the atoms involved in forming the structure and its individual valence electrons. Esta estrutura nos ajuda a conhecer as formações de ligação na molécula e o arranjo de elétrons nela.o átomo de enxofre assume a posição central, uma vez que é menos electronegativo do que o flúor. Coloca-o no centro e em todos os átomos de flúor à sua volta assim: o átomo de flúor só precisa de um electrão de Valência para completar o seu octeto. À medida que cada átomo segue a regra dos octetos para atingir uma estrutura estável, o átomo de flúor irá partilhar um electrão de Valência do átomo de enxofre. Assim, Enxofre irá compartilhar seis dos seus electrões de valência de todos os átomos de flúor que resultam na formação de seis único laços entre S e F.
Na Estrutura de Lewis, nós mostrar-obrigações da estrutura desenhar uma linha reta entre dois átomos. Então, todas estas ligações vão levar 12 elétrons de valência de 48.
Coloque todos os electrões de Valência restantes em torno dos átomos de flúor e verifique se os octetos de todos os átomos de flúor estão completos. uma vez que você faça isso, você verá elétrons de Valência nas camadas exteriores de todos os átomos de flúor, mas o enxofre tem mais de 8 elétrons em sua camada exterior. Isto porque é uma exceção ao papel octeto e pode expandir sua órbita para acomodar mais elétrons.
portanto, esta é a estrutura de Lewis direita do SF6.
SF6 Hybridization
Now that we know the Lewis Structure of SF6, we can now determine the atoms’ hybridization in the molecule. Aqui como o enxofre está compartilhando seus elétrons com os átomos de flúor, vamos olhar para sua hibridação.
a configuração eletrônica do SF6 em seu estado fundamental é 3s23p4. Mas quando ele compartilha elétrons e está no estado excitado os pares de elétrons em ambos orbitais 3s e 3p ficam sem par. Estes electrões movem-se para preencher os orbitais 3D mais vagos. Como resultado, seis orbitais híbridos são formados (um de 3s, Três de 3p, e dois 3d). Estes orbitais híbridos são os que acomodam os elétrons compartilhados. Estes orbitais sobrepõem-se com os orbitais 2p do átomo de flúor quando átomos de enxofre e flúor formam ligações. Estes seis orbitais estão nas seis direções da forma octaedro.
portanto, Hexafluoreto de enxofre tem hibridização sp3d2.como o enxofre compartilha seus elétrons de Valência com 6 átomos de flúor, podemos ver que todos os seis elétrons do átomo de enxofre são compartilhados para formar ligações. O ângulo de ligação de F-S-F é de 90 graus.
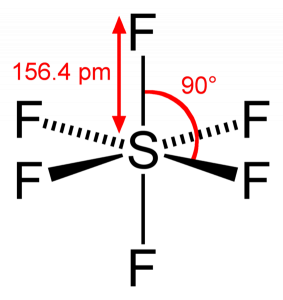
SF6 Geometria Molecular
Quando olhamos para o Hexafluoreto de Enxofre molécula de Enxofre é a posição central com o flúor átomos dispostos simetricamente em torno dele. Os átomos são colocados no padrão octaédrico, o que faz com que a geometria molecular de SF6 seja octaédrica.
SF6 forma
olhando para a geometria molecular da molécula, podemos dizer que a molécula SF6 tem uma forma octaédrica como tem oito lados. No entanto, as ligações atômicas centrais com seis átomos de flúor, a forma de SF6 é octaédrica.

é SF6 polar ou não-polar?
SF6 é uma molécula não-polar. Isto porque a teoria VSEPR diz que quando seis átomos de flúor são dispostos simetricamente em torno do átomo de enxofre, os dipolos de ligação são cancelados. Como resultado, é uma molécula não-polar.

também tem as mesmas propriedades que moléculas não-polares, tais como ser não-solúvel em água e ser solúvel em solventes orgânicos não-polares.
observações conclusivas
para resumir este artigo podemos dizer que na estrutura de pontos de Lewis do SF6, todos os elétrons de Valência são usados o que resulta na formação de seis ligações únicas entre S-F Sem pares solitários de elétrons.
a hibridação do enxofre nesta molécula é sp3d2 com os ângulos de ligação de 90 graus.
A geometria molecular do SF6 é octaédrica e é uma molécula não-polar.