sześciofluorek siarki lub SF6 jest nieorganicznym gazem cieplarnianym. Jest niepalny, bezwonny i bezbarwny i jest doskonałym izolatorem. Jest to hiperwartościowa cząsteczka ośmiościanu, która była interesującym tematem rozmów wśród entuzjastów chemii.
Henri Moissan odkrył istnienie SF6. Nawiasem mówiąc, jest również odkrywcą fluoru. Standardowym sposobem syntezy SF6 jest wystawienie S8 na F2. Metoda ta powoduje powstawanie kilku fluorków siarki, ale można je wyeliminować poprzez ogrzewanie, a następnie za pomocą NaOH usunąć wszelkie dodatkowe cząsteczki SF4.
SF6 nie może być stosowany bezpośrednio po syntezie. Musi zostać oczyszczony, aby pozbyć się wszystkich reaktywnych fluorków. Następnie musi przejść przez pirolizę.
w tym poście na blogu poznamy strukturę Lewisa SF6 i jego kąty wiązania, geometrię molekularną i kształt, które mogą pomóc nam zrozumieć fizyczne właściwości tej cząsteczki.
| Name of molecule | Sulphur Hexafluoride ( SF6) |
| No of Valence Electrons in the molecule | 48 |
| Hybridization of SF6 | sp3d2 hybridization |
| Bond Angles | 90 degrees |
| Molecular Geometry of SF6 | Octahedral |
Contents
SF6 Valence Electrons
To determine the Lewis Struktura każdej cząsteczki, musimy najpierw poznać całkowitą liczbę elektronów walencyjnych. Tutaj dowiemy się całkowitą liczbę elektronów walencyjnych dla SF6, dodając elektrony walencyjne zarówno dla atomów siarki i fluoru.
całkowita liczba elektronów walencyjnych w SF6 – elektrony walencyjne siarki + elektrony walencyjne fluoru
siarka ma sześć elektronów walencyjnych.
fluor ma siedem elektronów walencyjnych, ale ponieważ w tej cząsteczce jest sześć atomów fluoru, pomnożymy tę liczbę przez 6.
= 6 + 7*6
= 6 + 42
= 48 elektronów walencyjnych
tak więc SF6 ma 48 elektronów walencyjnych, które pomogą nam narysować strukturę kropki Lewisa SF6.
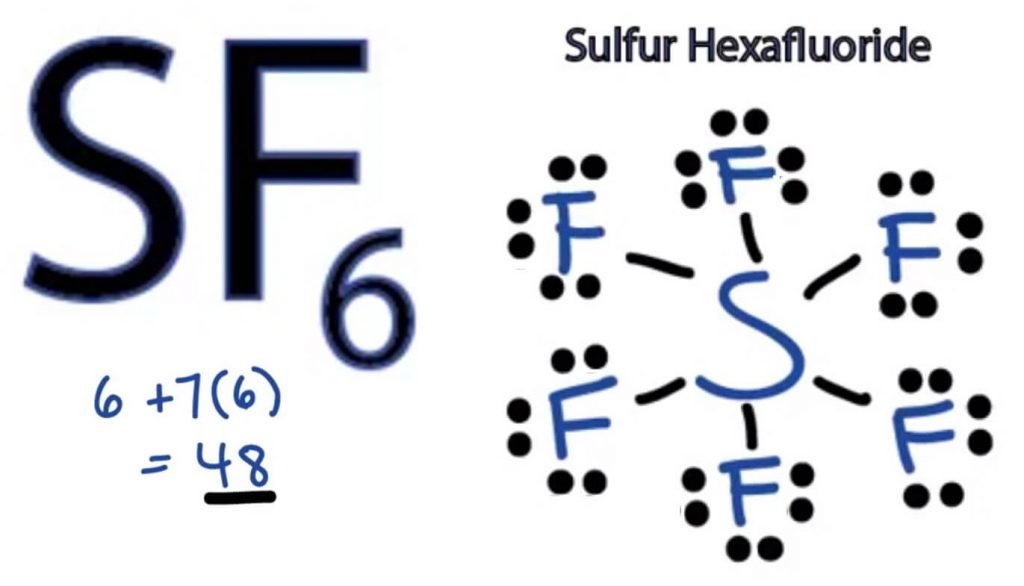
SF6 struktura Lewisa
struktura kropki Lewisa dowolnej cząsteczki jest obrazową reprezentacją atomów zaangażowanych w tworzenie struktury i jej poszczególnych elektronów walencyjnych. Ta struktura pomaga nam poznać formacje wiązań w cząsteczce i rozmieszczenie w niej elektronów.
atom siarki zajmie centralną pozycję, ponieważ jest mniej elektroujemny niż fluor. Więc umieść go w centrum i wszystkie atomy fluoru wokół niego w ten sposób:
atom fluoru potrzebuje tylko jednego elektronu walencyjnego, aby ukończyć swój oktet. Ponieważ każdy atom spełnia zasadę oktetu, aby osiągnąć stabilną strukturę, atom fluoru będzie miał jeden elektron walencyjny atomu siarki. Tak więc Siarka będzie dzielić sześć swoich elektronów walencyjnych ze wszystkimi atomami fluoru, które powodują utworzenie sześciu pojedynczych wiązań między S I F.
w strukturze Lewisa pokazujemy wiązania w strukturze, rysując linię prostą między dwoma atomami. Wszystkie te wiązania zajmą 12 elektronów walencyjnych z 48.
Umieść wszystkie pozostałe elektrony walencyjne wokół atomów fluoru i sprawdź, czy oktety wszystkich atomów fluoru są kompletne.
gdy to zrobisz, zobaczysz elektrony walencyjne w zewnętrznych powłokach wszystkich atomów fluoru, ale siarka ma więcej niż 8 elektronów w swojej zewnętrznej powłoce. Dzieje się tak dlatego, że jest to wyjątek od roli oktetu i może rozszerzyć swój orbital, aby pomieścić więcej elektronów.
stąd jest to właściwa struktura SF6.
hybrydyzacja SF6
teraz, gdy znamy strukturę Lewisa SF6, możemy teraz określić hybrydyzację atomów w cząsteczce. Tutaj, gdy siarka dzieli swoje elektrony z atomami fluoru, przyjrzymy się jej hybrydyzacji.
elektroniczna konfiguracja SF6 w stanie podstawowym to 3s23p4. Ale kiedy dzieli elektrony i jest w stanie wzbudzonym, pary elektronów na orbitalach 3s i 3p zostają niesparowane. Te elektrony poruszają się, aby wypełnić wyższe wolne orbitale 3d. W rezultacie powstaje sześć orbitali hybrydowych ( jeden z 3s, trzy z 3p i dwa 3d). Te hybrydowe orbitale są tymi, które mieszczą wspólne elektrony. Orbitale te pokrywają się z orbitalami 2P atomu fluoru, gdy atomy siarki i fluoru tworzą wiązania. Te sześć orbitali znajduje się w sześciu kierunkach kształtu ośmiościanu.
stąd Heksafluorek siarki ma hybrydyzację sp3d2.
kąt wiązania SF6
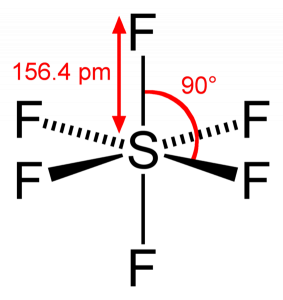
ponieważ siarka dzieli swoje elektrony walencyjne z 6 atomami fluoru, widzimy, że wszystkie sześć elektronów atomu siarki są współdzielone, tworząc wiązania. Kąt wiązania F-S – F wynosi 90 stopni.
geometria molekularna SF6
kiedy patrzymy na cząsteczkę sześciofluorku siarki, Siarka znajduje się w centralnej pozycji z atomami fluoru rozmieszczonymi symetrycznie wokół niej. Atomy są umieszczone w układzie oktaedrycznym, co sprawia, że geometria molekularna SF6 jest oktaedryczna.
kształt SF6
patrząc na geometrię molekularną cząsteczki, możemy powiedzieć, że cząsteczka SF6 ma kształt ośmiościanu, ponieważ ma osiem boków. Jednak ATOM centralny wiąże się z sześcioma atomami fluoru, kształt SF6 jest oktaedryczny.

czy SF6 jest polarny czy niepolarny?
SF6 jest cząsteczką niepolarną. Dzieje się tak, ponieważ teoria VSEPR mówi, że gdy sześć atomów fluoru jest rozmieszczonych symetrycznie wokół atomu siarki, dipole wiązania są anulowane. W rezultacie jest to cząsteczka niepolarna.

ma również takie same właściwości jak cząsteczki niepolarne, takie jak nierozpuszczalne w wodzie i rozpuszczalne w niepolarnych rozpuszczalnikach organicznych.
Uwagi końcowe
podsumowując ten artykuł, możemy powiedzieć, że w strukturze kropki Lewisa SF6 wszystkie elektrony walencyjne są zużywane, co skutkuje utworzeniem sześciu pojedynczych wiązań między S-F bez samotnych par elektronów.
hybrydyzacją siarki w tej cząsteczce jest sp3d2 o kątach wiązania 90 stopni.
geometria cząsteczkowa SF6 jest ośmiościanowa i jest cząsteczką niepolarną.