Schwefelhexafluorid oder SF6 ist ein anorganisches Treibhausgas. Es ist nicht brennbar, geruchs- und farblos und ein hervorragender Isolator. Es ist ein hypervalentes oktaedrisches Molekül, das unter Chemie-Enthusiasten ein interessantes Gesprächsthema war.Henri Moissan entdeckte die Existenz von SF6. Er ist übrigens auch der Entdecker von Fluor. Die Standardmethode zur Synthese von SF6 besteht darin, S8 F2 auszusetzen. Diese Methode bewirkt die Bildung einiger Schwefelfluoride, die jedoch durch Erhitzen und anschließende Verwendung von NaOH zur Entfernung zusätzlicher SF4-Moleküle eliminiert werden können.
SF6 kann nicht unmittelbar nach der Synthese verwendet werden. Es muss gereinigt werden, um alle reaktiven Fluoride loszuwerden. Danach muss es durch Pyrolyse gehen.
Hier in diesem Blogbeitrag lernen wir die Lewis-Struktur von SF6 und seine Bindungswinkel, molekulare Geometrie und Form kennen, die uns helfen können, die physikalischen Eigenschaften dieses Moleküls zu verstehen.
| Name of molecule | Sulphur Hexafluoride ( SF6) |
| No of Valence Electrons in the molecule | 48 |
| Hybridization of SF6 | sp3d2 hybridization |
| Bond Angles | 90 degrees |
| Molecular Geometry of SF6 | Octahedral |
Contents
SF6 Valence Electrons
To determine the Lewis Struktur eines Moleküls, müssen wir zuerst die Gesamtzahl der Valenzelektronen kennen. Hier werden wir die Gesamtzahl der Valenzelektronen für SF6 herausfinden, indem wir die Valenzelektronen für Schwefel- und Fluoratome addieren.
Gesamtzahl der Valenzelektronen in SF6 – Valenzelektronen von Schwefel + Valenzelektronen von Fluor
Schwefel hat sechs Valenzelektronen.
Fluor hat sieben Valenzelektronen, aber da es in diesem Molekül sechs Fluoratome gibt, werden wir diese Zahl mit 6 multiplizieren.
= 6 + 7*6
= 6 + 42
= 48 Valenzelektronen
Somit hat SF6 48 Valenzelektronen, die uns helfen werden, die Lewis-Punktstruktur von SF6 zu zeichnen.
SF6 Lewis-Struktur
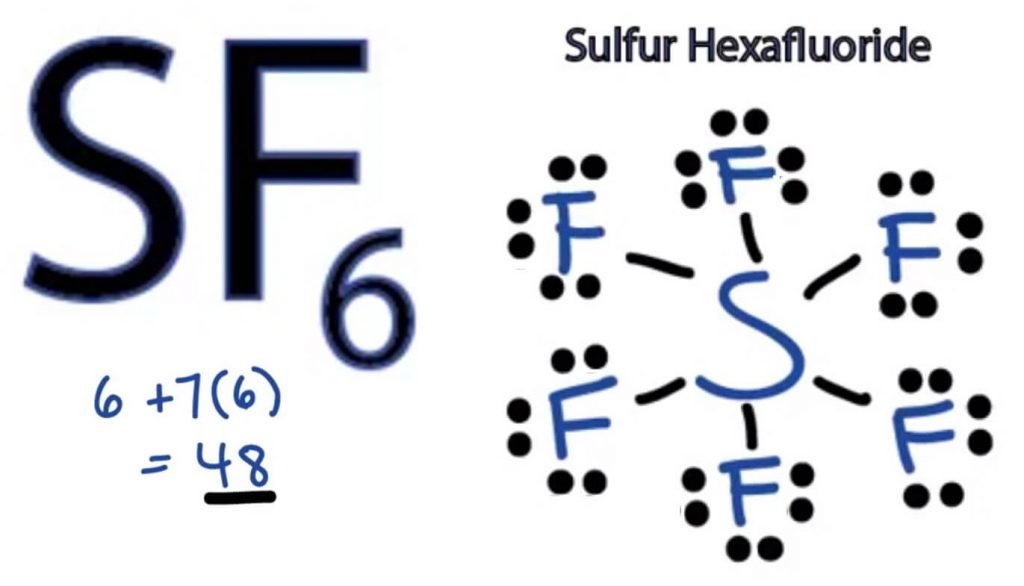
Die Lewis-Punktstruktur eines Moleküls ist eine bildliche Darstellung der Atome, die an der Bildung der Struktur und ihrer einzelnen Valenzelektronen beteiligt sind. Diese Struktur hilft uns, die Bindungsbildungen im Molekül und die Anordnung der Elektronen darin zu kennen.
Schwefelatom wird die zentrale Position einnehmen, da es weniger elektronegativ als Fluor ist. Platzieren Sie es also in der Mitte und alle Fluoratome um es herum wie folgt:
Das Fluoratom benötigt nur ein Valenzelektron, um sein Oktett zu vervollständigen. Da jedes Atom der Oktettregel folgt, um eine stabile Struktur zu erreichen, teilt sich das Fluoratom ein Valenzelektron des Schwefelatoms. Somit teilt Schwefel sechs seiner Valenzelektronen mit allen Fluoratomen, die zur Bildung von sechs Einzelbindungen zwischen S und F führen.
In der Lewis-Struktur zeigen wir die Bindungen in der Struktur, indem wir eine gerade Linie zwischen zwei Atomen zeichnen. Alle diese Bindungen nehmen also 12 von 48 Valenzelektronen auf.
Legen Sie alle verbleibenden Valenzelektronen um die Fluoratome und prüfen Sie, ob die Oktette aller Fluoratome vollständig sind.
Sobald Sie das tun, werden Sie Valenzelektronen in den äußeren Schalen aller Fluoratome sehen, aber Schwefel hat mehr als 8 Elektronen in seiner äußeren Schale. Dies liegt daran, dass es eine Ausnahme von der Oktettrolle darstellt und sein Orbital erweitern kann, um mehr Elektronen aufzunehmen.
Daher ist dies die richtige Lewis-Struktur von SF6.
SF6-Hybridisierung
Nachdem wir nun die Lewis-Struktur von SF6 kennen, können wir nun die Hybridisierung der Atome im Molekül bestimmen. Hier, da Schwefel seine Elektronen mit den Fluoratomen teilt, werden wir seine Hybridisierung betrachten.
Die elektronische Konfiguration von SF6 in seinem Grundzustand ist 3s23p4. Wenn es jedoch Elektronen teilt und sich im angeregten Zustand befindet, werden die Elektronenpaare in 3s- und 3p-Orbitalen ungepaart. Diese Elektronen bewegen sich, um die höheren freien 3D-Orbitale zu füllen. Als Ergebnis werden sechs Hybridorbitale gebildet (eines von 3s, drei von 3p und zwei 3d). Diese Hybridorbitale sind diejenigen, die die gemeinsamen Elektronen aufnehmen. Diese Orbitale überlappen sich mit den 2p-Orbitalen des Fluoratoms, wenn Schwefel- und Fluoratome Bindungen bilden. Diese sechs Orbitale befinden sich in den sechs Richtungen der Oktaederform.
Daher hat Schwefelhexafluorid eine sp3d2-Hybridisierung.
SF6-Bindungswinkel
Da Schwefel seine Valenzelektronen mit 6 Fluoratomen teilt, können wir sehen, dass alle sechs Elektronen des Schwefelatoms geteilt werden, um Bindungen zu bilden. Der Bindungswinkel von FS beträgt 90 Grad.
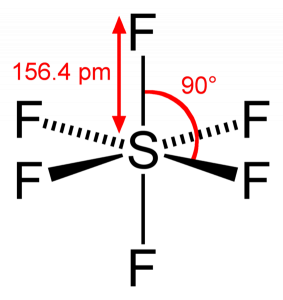
Molekulare Geometrie des SF6
Wenn wir das Schwefelhexafluoridmolekül betrachten, befindet sich Schwefel in der zentralen Position, wobei die Fluoratome symmetrisch um ihn herum angeordnet sind. Die Atome sind im oktaedrischen Muster angeordnet, wodurch die Molekülgeometrie von SF6 oktaedrisch ist.
SF6-Form
Wenn wir die Molekülgeometrie des Moleküls betrachten, können wir sagen, dass das SF6-Molekül eine oktaedrische Form hat, da es acht Seiten hat. Das Zentralatom verbindet sich jedoch mit sechs Fluoratomen, die Form von SF6 ist oktaedrisch.

Ist SF6 polar oder unpolar?
SF6 ist ein unpolares Molekül. Dies liegt daran, dass die VSEPR-Theorie besagt, dass, wenn sechs Fluoratome symmetrisch um das Schwefelatom angeordnet sind, die Bindungsdipole aufgehoben werden. Infolgedessen ist es ein unpolares Molekül.

Es hat auch die gleichen Eigenschaften wie unpolare Moleküle, z. B. in Wasser nicht löslich und in unpolaren organischen Lösungsmitteln löslich.
Abschließende Bemerkungen
Um diesen Artikel zusammenzufassen, können wir sagen, dass in der Lewis-Punktstruktur von SF6 alle Valenzelektronen aufgebraucht sind, was zur Bildung von sechs Einzelbindungen zwischen S-F ohne einsame Elektronenpaare führt.
Die Hybridisierung von Schwefel in diesem Molekül ist sp3d2 mit den Bindungswinkeln von 90 Grad.
Die molekulare Geometrie von SF6 ist oktaedrisch und es ist ein unpolares Molekül.