Svovelheksafluorid eller SF6 er en uorganisk drivhusgass. Det er ikke brennbart, luktfritt og fargeløst, og er en utmerket isolator. Det er et hypervalent oktaedisk molekyl som har vært et interessant tema for samtale blant kjemientusiaster.
Henri Moissan oppdaget EKSISTENSEN AV SF6. Forresten er han også oppdageren av fluor. Den vanlige måten å syntetisere SF6 på er å eksponere S8 Til F2. Denne metoden forårsaker dannelse av noen svovelfluorider, men de kan elimineres gjennom oppvarming og deretter bruke NaOH for å fjerne eventuelle EKSTRA SF4-molekyler.
SF6 kan ikke brukes umiddelbart etter syntese. Det må renses for å kvitte seg med alle reaktive fluorider. Etter det må det gå gjennom pyrolyse. Her i dette blogginnlegget vil vi lære Lewis-Strukturen TIL SF6 og Dens Bindingsvinkler, Molekylær geometri og form som kan hjelpe oss å forstå de fysiske egenskapene til dette molekylet.
| Name of molecule | Sulphur Hexafluoride ( SF6) |
| No of Valence Electrons in the molecule | 48 |
| Hybridization of SF6 | sp3d2 hybridization |
| Bond Angles | 90 degrees |
| Molecular Geometry of SF6 | Octahedral |
Contents
SF6 Valence Electrons
To determine the Lewis Struktur av et molekyl, må vi først vite det totale antall valenselektroner. Her vil vi finne ut det totale antall valenselektroner FOR SF6 ved å legge til valenselektronene for Både Svovel og Fluoratomer.
Totalt antall valenselektroner I SF6 – Valenselektroner Av Svovel + Valenselektroner Av Fluor
Svovel har seks valenselektroner.
Fluor har syv valenselektroner, men da det er seks Fluoratomer i dette molekylet, vil vi multiplisere dette tallet med 6.
= 6 + 7*6
= 6 + 42
= 48 valenselektroner
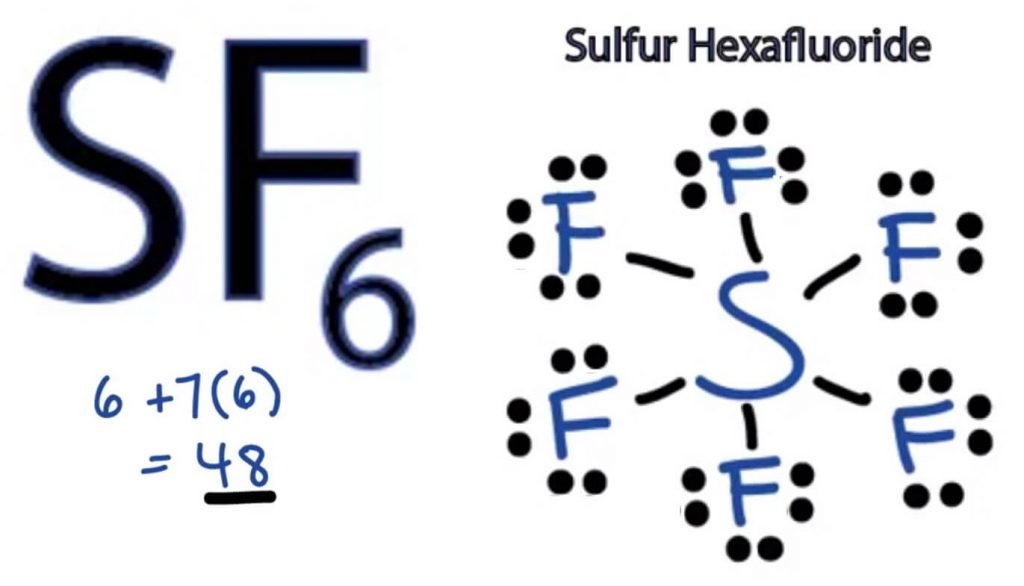
DERMED SF6 HAR 48 valenselektroner som vil hjelpe oss å tegne Lewis Dot Strukturen AV SF6.
SF6 Lewis Struktur
Lewis Dot-strukturen til et hvilket som helst molekyl er en billedlig representasjon av atomene som er involvert i å danne strukturen og dens individuelle valenselektroner. Denne strukturen hjelper oss med å kjenne bindingsformasjonene i molekylet og arrangementet av elektroner i den.
Svovelatom vil ta den sentrale posisjonen da Den er mindre elektronegativ enn Fluor. Så plasser Den i midten og Alle Fluoratomer rundt den slik:
Fluoratom trenger bare en valenselektron for å fullføre sin oktett. Som hvert atom følger oktettregelen for å oppnå en stabil struktur, Vil Fluoratomet dele en valenselektron av Svovelatomet. Således Vil Svovel dele seks av sine valenselektroner med alle fluoratomer som resulterer i å danne seks enkeltbindinger Mellom S og F.
I Lewis-Strukturen viser Vi bindingene i strukturen ved å tegne en rett linje mellom to atomer. Så alle disse bindingene vil ta opp 12 valenselektroner ut av 48.
Plasser alle de gjenværende valenselektronene rundt Fluoratomene og kontroller om oktettene i alle fluoratomer er komplette.
Når du gjør det, vil du se valenselektroner i ytre skall av Alle Fluoratomer, Men Svovel har mer enn 8 elektroner i sitt ytre skall. Dette skyldes at det er et unntak fra oktettrollen og kan utvide sin orbital for å imøtekomme flere elektroner.
Derfor er Dette Den rette Lewis-strukturen TIL SF6.
SF6 Hybridisering
Nå som Vi kjenner Lewis Strukturen TIL SF6, kan vi nå bestemme atomenes hybridisering i molekylet. Her Som Svovel deler sine elektroner med Fluoratomer, vil vi se på hybridiseringen.
DEN elektroniske konfigurasjonen AV SF6 i grunntilstanden er 3s23p4. Men når den deler elektroner og er i opphisset tilstand, blir elektronparene i både 3s og 3p orbitaler uparret. Disse elektronene beveger seg for å fylle de høyere ledige 3d-orbitaler. Som et resultat dannes seks hybridorbitaler (en av 3s, tre av 3p og to 3d). Disse hybrid orbitaler er de som imøtekomme de delte elektronene. Disse orbitaler overlapper med 2p orbitaler av fluoratomet når Svovel og Fluoratomer danner bindinger. Disse seks orbitaler er i seks retninger av oktaedronformen.
Derfor Har Svovelheksafluorid sp3d2 hybridisering.
SF6 Bond angle
Som Svovel deler sine valenselektroner med 6 Fluoratomer, kan vi se at alle seks elektroner I Svovelatomet deles for å danne bindinger. Bindingsvinkelen Til F-S-F er 90 grader.
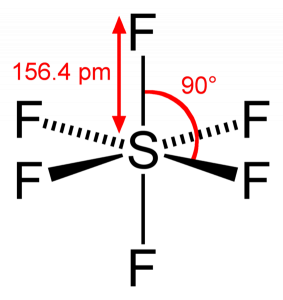
SF6 Molekylær Geometri
Når vi ser På Svovelheksafluoridmolekyl, Er Svovel i sentral posisjon med fluoratomer arrangert symmetrisk rundt den. Atomene er plassert i oktaedisk mønster, noe som gjør at molekylær geometri AV SF6 er oktaedisk.
SF6 Form
Ser vi på molekylets molekylære geometri, kan VI si AT SF6-molekylet har en oktaedisk form som den har åtte sider. Det sentrale atomet bindes imidlertid med seks Fluoratomer, FORMEN PÅ SF6 er oktaedisk.

ER SF6 polar eller ikke-polar?
SF6 er et ikke-polart molekyl. DETTE skyldes AT vsepr-teorien sier at når seks fluoratomer er arrangert symmetrisk rundt svovelatomet, blir bindingsdipolene kansellert. Som et resultat er det et ikke-polært molekyl.

Det har også de samme egenskapene som ikke-polare molekyler som ikke er oppløselige i vann og er oppløselige i ikke-polare organiske løsningsmidler.For å oppsummere denne artikkelen kan vi si at I Lewis dot-strukturen TIL SF6 blir alle valenselektronene brukt opp, noe som resulterer i å danne seks enkeltbindinger Mellom Sf uten lone par elektroner.
hybridiseringen Av Svovel i dette molekylet er sp3d2 med bindingsvinklene på 90 grader.MOLEKYLÆRGEOMETRIEN TIL SF6 er oktaedisk og er et ikke-polært molekyl.