L’esafluoruro di zolfo o SF6 è un gas inorganico a effetto serra. Non è infiammabile, inodore e incolore ed è un ottimo isolante. È una molecola ottaedrica ipervalente che è stata un interessante argomento di conversazione tra gli appassionati di chimica.
Henri Moissan scoprì l’esistenza di SF6. Per inciso, è anche lo scopritore del fluoro. Il modo standard di sintetizzare SF6 è quello di esporre S8 a F2. Questo metodo provoca la formazione di alcuni fluoruri di zolfo, ma questi possono essere eliminati attraverso il riscaldamento e quindi utilizzando NaOH per rimuovere eventuali molecole SF4 aggiuntive.
SF6 non può essere utilizzato immediatamente dopo la sintesi. Deve essere purificato per sbarazzarsi di tutti i fluoruri reattivi. Dopo di ciò, deve passare attraverso la pirolisi.
Qui in questo post del blog, impareremo la struttura di Lewis di SF6 e i suoi angoli di legame, la geometria molecolare e la forma che possono aiutarci a capire le proprietà fisiche di questa molecola.
| Name of molecule | Sulphur Hexafluoride ( SF6) |
| No of Valence Electrons in the molecule | 48 |
| Hybridization of SF6 | sp3d2 hybridization |
| Bond Angles | 90 degrees |
| Molecular Geometry of SF6 | Octahedral |
Contents
SF6 Valence Electrons
To determine the Lewis Struttura di qualsiasi molecola, abbiamo prima bisogno di conoscere il numero totale di elettroni di valenza. Qui scopriremo il numero totale di elettroni di valenza per SF6 aggiungendo gli elettroni di valenza sia per gli atomi di zolfo che di fluoro.
Numero totale di elettroni di valenza in SF6 – Elettroni di valenza di zolfo + Elettroni di valenza di fluoro
Lo zolfo ha sei elettroni di valenza.
Il fluoro ha sette elettroni di valenza, ma poiché ci sono sei atomi di fluoro in questa molecola, moltiplicheremo questo numero per 6.
= 6 + 7*6
= 6 + 42
= 48 elettroni di valenza
Quindi SF6 ha 48 elettroni di valenza che ci aiuteranno a disegnare la struttura del punto di Lewis di SF6.
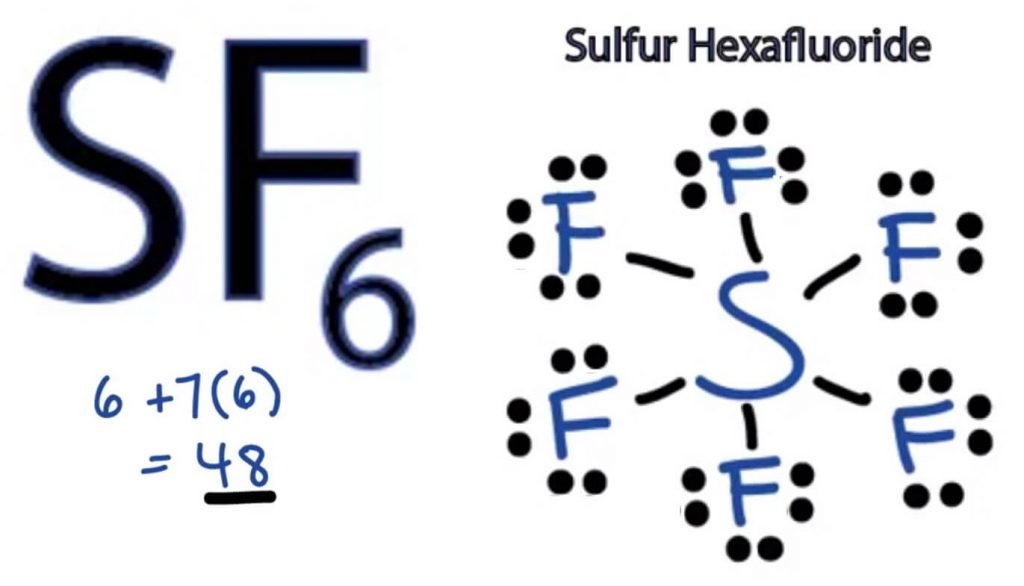
SF6 Struttura di Lewis
La struttura del punto di Lewis di qualsiasi molecola è una rappresentazione pittorica degli atomi coinvolti nella formazione della struttura e dei suoi singoli elettroni di valenza. Questa struttura ci aiuta a conoscere le formazioni di legame nella molecola e la disposizione degli elettroni in essa contenuti.
L’atomo di zolfo assumerà la posizione centrale in quanto è meno elettronegativo del fluoro. Quindi posizionalo al centro e tutti gli atomi di fluoro intorno ad esso in questo modo:
L’atomo di fluoro ha bisogno di un solo elettrone di valenza per completare il suo ottetto. Poiché ogni atomo segue la regola dell’ottetto per ottenere una struttura stabile, l’atomo di fluoro condividerà un elettrone di valenza dell’atomo di zolfo. Quindi, lo zolfo condividerà sei dei suoi elettroni di valenza con tutti gli atomi di fluoro che si traducono nella formazione di sei singoli legami tra S e F.
Nella struttura di Lewis, mostriamo i legami nella struttura disegnando una linea retta tra due atomi. Quindi tutti questi legami assorbiranno 12 elettroni di valenza su 48.
Posiziona tutti gli elettroni di valenza rimanenti attorno agli atomi di fluoro e controlla se gli ottetti di tutti gli atomi di fluoro sono completi.
Una volta fatto ciò, vedrai elettroni di valenza nei gusci esterni di tutti gli atomi di fluoro, ma lo zolfo ha più di 8 elettroni nel suo guscio esterno. Questo perché è un’eccezione al ruolo dell’ottetto e può espandere il suo orbitale per ospitare più elettroni.
Quindi, questa è la giusta struttura di Lewis di SF6.
Ibridazione SF6
Ora che conosciamo la Struttura di Lewis di SF6, possiamo ora determinare l’ibridazione degli atomi nella molecola. Qui, poiché lo zolfo condivide i suoi elettroni con gli atomi di fluoro, esamineremo la sua ibridazione.
La configurazione elettronica di SF6 nel suo stato fondamentale è 3s23p4. Ma quando condivide elettroni ed è nello stato eccitato le coppie di elettroni in entrambi gli orbitali 3s e 3p vengono spaiate. Questi elettroni si muovono per riempire gli orbitali 3d vacanti più alti. Di conseguenza, si formano sei orbitali ibridi ( uno di 3s, tre di 3p e due 3d). Questi orbitali ibridi sono quelli che ospitano gli elettroni condivisi. Questi orbitali si sovrappongono con gli orbitali 2p dell’atomo di fluoro quando gli atomi di zolfo e fluoro formano legami. Questi sei orbitali sono nelle sei direzioni della forma dell’ottaedro.
Quindi, l’esafluoruro di zolfo ha ibridazione sp3d2.
SF6 Angolo di legame
Poiché lo zolfo condivide i suoi elettroni di valenza con 6 atomi di fluoro, possiamo vedere che tutti e sei gli elettroni dell’atomo di zolfo sono condivisi per formare legami. L’angolo di legame di F-S-F è di 90 gradi.
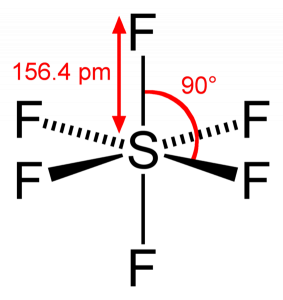
SF6 Geometria molecolare
Quando guardiamo la molecola di esafluoruro di zolfo, lo zolfo si trova nella posizione centrale con gli atomi di fluoro disposti simmetricamente attorno ad esso. Gli atomi sono posti nel modello ottaedrico, che rende la geometria molecolare di SF6 è ottaedrica.
Forma SF6
Guardando la geometria molecolare della molecola, possiamo dire che la molecola SF6 ha una forma ottaedrica in quanto ha otto lati. Tuttavia, i legami atomici centrali con sei atomi di fluoro, la forma di SF6 è ottaedrica.

SF6 è polare o non polare?
SF6 è una molecola non polare. Questo perché la teoria VSEPR dice che quando sei atomi di fluoro sono disposti simmetricamente attorno all’atomo di zolfo, i dipoli di legame vengono annullati. Di conseguenza, è una molecola non polare.

Ha anche le stesse proprietà delle molecole non polari come essere non solubili in acqua ed essere solubili in solventi organici non polari.
Osservazioni conclusive
Per riassumere questo articolo possiamo dire che nella struttura a punti di Lewis di SF6, tutti gli elettroni di valenza sono esauriti, il che si traduce nella formazione di sei singoli legami tra S-F senza coppie di elettroni solitari.
L’ibridazione dello Zolfo in questa molecola è sp3d2 con gli angoli di legame di 90 gradi.
La geometria molecolare di SF6 è ottaedrica ed è una molecola non polare.