L’hexafluorure de soufre ou SF6 est un gaz à effet de serre inorganique. Il est ininflammable, inodore et incolore, et constitue un excellent isolant. C’est une molécule octaédrique hypervalente qui a été un sujet de conversation intéressant parmi les amateurs de chimie.
Henri Moissan a découvert l’existence du SF6. Incidemment, il est également le découvreur du fluor. La méthode standard de synthèse du SF6 consiste à exposer S8 à F2. Cette méthode provoque la formation de quelques fluorures de soufre, mais ceux-ci peuvent être éliminés par chauffage puis en utilisant NaOH pour éliminer toute molécule de SF4 supplémentaire.
Le SF6 ne peut pas être utilisé immédiatement après la synthèse. Il doit être purifié pour se débarrasser de tous les fluorures réactifs. Après cela, il doit passer par la pyrolyse.
Dans cet article de blog, nous allons apprendre la Structure de Lewis du SF6 et ses angles de liaison, sa géométrie moléculaire et sa forme qui peuvent nous aider à comprendre les propriétés physiques de cette molécule.
| Name of molecule | Sulphur Hexafluoride ( SF6) |
| No of Valence Electrons in the molecule | 48 |
| Hybridization of SF6 | sp3d2 hybridization |
| Bond Angles | 90 degrees |
| Molecular Geometry of SF6 | Octahedral |
Contents
SF6 Valence Electrons
To determine the Lewis Structure de toute molécule, nous devons d’abord connaître le nombre total d’électrons de valence. Ici, nous découvrirons le nombre total d’électrons de valence pour le SF6 en ajoutant les électrons de valence pour les atomes de soufre et de fluor.
Nombre total d’électrons de valence dans le SF6 – Électrons de Valence du Soufre + Électrons de Valence du Fluor
Le soufre a six électrons de valence.
Le fluor a sept électrons de valence, mais comme il y a six atomes de fluor dans cette molécule, nous multiplierons ce nombre par 6.
= 6 + 7*6
=6 + 42
= 48 électrons de valence
Ainsi, SF6 a 48 électrons de valence qui nous aideront à dessiner la structure du point de Lewis de SF6.
Structure de Lewis SF6
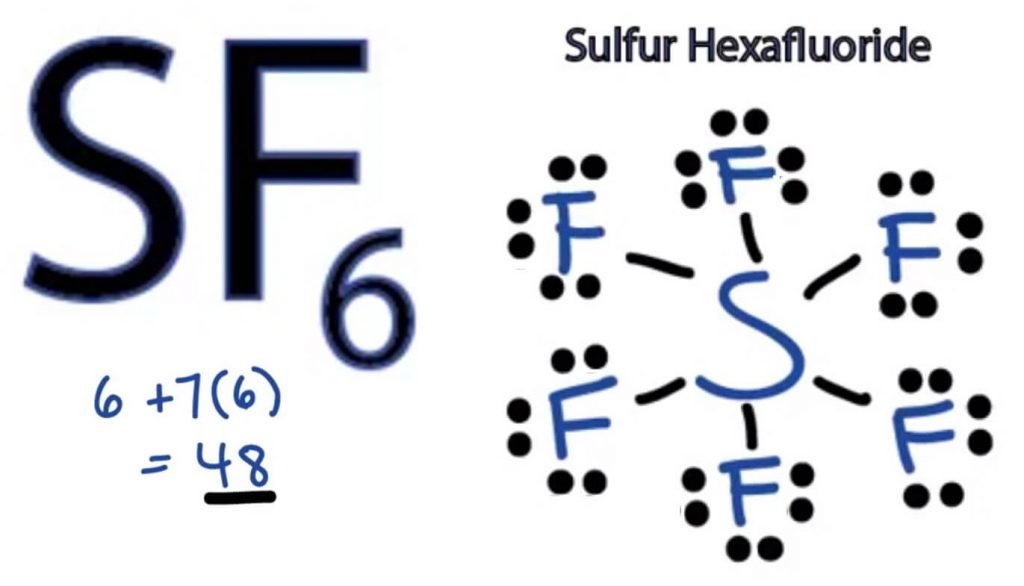
La structure du point de Lewis de toute molécule est une représentation picturale des atomes impliqués dans la formation de la structure et de ses électrons de valence individuels. Cette structure nous aide à connaître les formations de liaisons dans la molécule et la disposition des électrons dans celle-ci.
L’atome de soufre prendra la position centrale car il est moins électronégatif que le fluor. Placez-le donc au centre et tous les atomes de fluor autour de lui comme ceci:
L’atome de fluor n’a besoin que d’un électron de valence pour compléter son octet. Comme chaque atome suit la règle de l’octet pour atteindre une structure stable, l’atome de fluor partagera un électron de valence de l’atome de soufre. Ainsi, le soufre partagera six de ses électrons de valence avec tous les atomes de fluor, ce qui entraînera la formation de six liaisons simples entre S et F.
Dans la Structure de Lewis, nous montrons les liaisons dans la structure en traçant une ligne droite entre deux atomes. Toutes ces liaisons vont donc prendre 12 électrons de valence sur 48.
Placez tous les électrons de valence restants autour des atomes de fluor et vérifiez si les octets de tous les atomes de fluor sont complets.
Une fois que vous faites cela, vous verrez des électrons de valence dans les enveloppes extérieures de tous les atomes de fluor, mais le soufre a plus de 8 électrons dans sa coque extérieure. En effet, c’est une exception au rôle d’octet et peut étendre son orbitale pour accueillir plus d’électrons.
Par conséquent, c’est la bonne structure de Lewis de SF6.
Hybridation SF6
Maintenant que nous connaissons la Structure de Lewis de SF6, nous pouvons maintenant déterminer l’hybridation des atomes dans la molécule. Ici, comme le soufre partage ses électrons avec les atomes de fluor, nous examinerons son hybridation.
La configuration électronique du SF6 dans son état fondamental est 3s23p4. Mais quand il partage des électrons et est à l’état excité, les paires d’électrons dans les orbitales 3s et 3p ne sont pas appariées. Ces électrons se déplacent pour remplir les orbitales 3d vacantes les plus élevées. En conséquence, six orbitales hybrides sont formées (une de 3s, trois de 3p et deux 3d). Ces orbitales hybrides sont celles qui accueillent les électrons partagés. Ces orbitales se chevauchent avec les orbitales 2p de l’atome de fluor lorsque les atomes de soufre et de fluor forment des liaisons. Ces six orbitales sont dans les six directions de la forme de l’octaèdre.
Par conséquent, l’hexafluorure de soufre présente une hybridation sp3d2.
Angle de liaison SF6
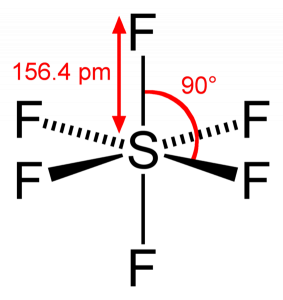
Comme le soufre partage ses électrons de valence avec 6 atomes de fluor, nous pouvons voir que les six électrons de l’atome de soufre sont partagés pour former des liaisons. L’angle de liaison de F-S-F est de 90 degrés.
Géométrie moléculaire SF6
Lorsque nous regardons la molécule d’hexafluorure de soufre, le soufre est en position centrale avec les atomes de fluor disposés symétriquement autour d’elle. Les atomes sont placés dans le motif octaédrique, ce qui rend la géométrie moléculaire de SF6 octaédrique.
Forme SF6
En regardant la géométrie moléculaire de la molécule, on peut dire que la molécule SF6 a une forme octaédrique car elle a huit côtés. Cependant, l’atome central se lie à six atomes de fluor, la forme du SF6 est octaédrique.

Le SF6 est-il polaire ou non polaire?
Le SF6 est une molécule apolaire. En effet, la théorie VSEPR dit que lorsque six atomes de fluor sont disposés symétriquement autour de l’atome de soufre, les dipôles de liaison sont annulés. En conséquence, c’est une molécule non polaire.

Il possède également les mêmes propriétés que les molécules non polaires telles qu’être non soluble dans l’eau et soluble dans les solvants organiques non polaires.
Remarques finales
Pour résumer cet article, nous pouvons dire que dans la structure en points de Lewis de SF6, tous les électrons de valence sont utilisés, ce qui entraîne la formation de six liaisons simples entre S-F sans paires d’électrons isolées.
L’hybridation du soufre dans cette molécule est sp3d2 avec des angles de liaison de 90 degrés.
La géométrie moléculaire du SF6 est octaédrique et c’est une molécule apolaire.