diagrama Lewis a multor molecule, totuși, nu este în concordanță cu proprietățile observate ale moleculei.
Exemplul 1: Ion nitrat
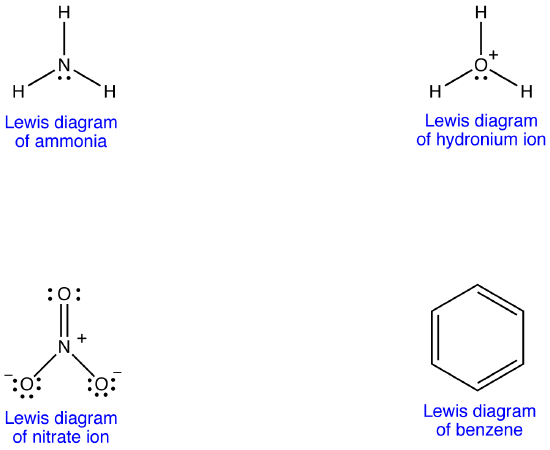
ionul nitrat, conform diagramei sale Lewis, are două tipuri de legături azot-oxigen, o legătură dublă și două legături simple, sugerând că o legătură azot-oxigen în ionul nitrat este mai scurtă și mai puternică decât fiecare dintre celelalte două. De asemenea, structura Lewis implică, în ceea ce privește sarcina formală, că există două tipuri de atomi de oxigen în ionul nitrat, unul formal neutru și fiecare dintre ceilalți doi purtând o sarcină formală de -1. Cu toate acestea, experimental, cele trei legături azot-oxigen din ionul nitrat au aceeași lungime de legătură și aceeași energie de legătură, iar cei trei atomi de oxigen nu se pot distinge. Diagrama Lewis nu explică în mod satisfăcător structura și legătura ionului nitrat.
două diagrame Lewis suplimentare pot fi desenate pentru ionul nitrat.
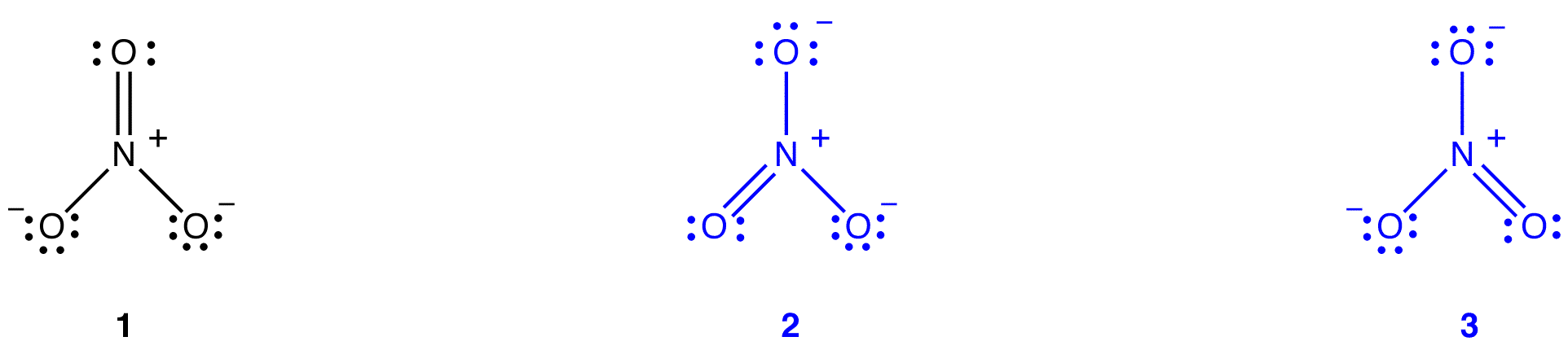
cu toate acestea, niciuna dintre ele nu este în concordanță cu proprietățile observate ale ionului nitrat și, prin urmare, nu descrie corect ionul nitrat.
Exemplul 2: Benzenul, conform diagramei Lewis, are două tipuri de legături carbon-carbon, trei legături duble și trei legături simple, sugerând că fiecare dintre cele trei legături carbon-carbon din benzen este mai scurtă și mai puternică decât fiecare dintre celelalte trei. Experimental, însă, cele șase legături carbon-carbon din benzen au aceeași lungime a legăturii și aceeași energie a legăturii. Diagrama Lewis nu explică în mod satisfăcător structura și legătura benzenului.
un atribut al moleculelor a căror diagramă Lewis clasică nu este în concordanță cu proprietățile observate este că alte diagrame Lewis valide pot fi generate pentru ele. O diagramă Lewis suplimentară poate fi trasă pentru benzen.

cu toate acestea, niciuna dintre ele nu este în concordanță cu proprietățile observate ale benzenului și, prin urmare, nu descrie corect benzenul.
teoria rezonanței este o încercare de a explica structura unei specii, cum ar fi ionul nitrat sau benzenul, a cărui diagramă Lewis nu este în concordanță cu proprietățile observate ale speciei. Avantajul major al teoriei rezonanței este că, deși se bazează pe o analiză matematică riguroasă, teoria rezonanței poate fi aplicată cu succes invocând puțin sau deloc matematică. Teoria rezonanței este explicată mai jos folosind ionul nitrat ca exemplu.
conform teoriei rezonanței, structura ionului nitrat nu este 1, Nici 2, Nici 3, ci media tuturor celor trei, ponderată de stabilitate. Diagramele Lewis 1, 2 și 3 se numesc forme de rezonanță, structuri de rezonanță sau contribuitori de rezonanță ai ionului nitrat. Se spune că structura ionului nitrat este un hibrid de rezonanță sau, pur și simplu, hibrid al formelor de rezonanță 1, 2 și 3. Ori de câte ori este necesar să se arate structura ionului nitrat, formele de rezonanță 1, 2 și 3 sunt desenate, conectate printr-o săgeată cu două capete.
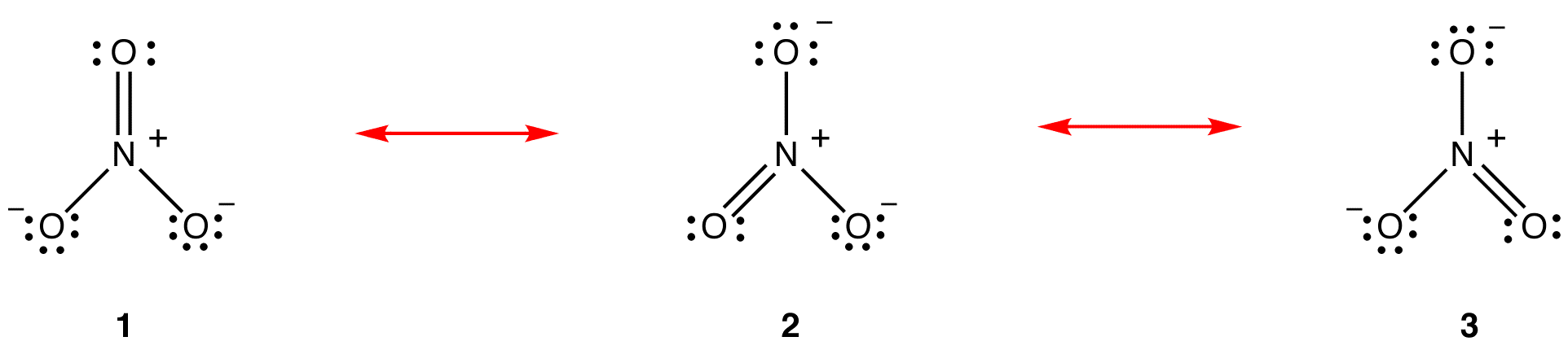
cele trei forme de rezonanță ale ionului nitrat, 1, 2 și 3, sunt identice, deci au aceeași stabilitate și, prin urmare, contribuie în mod egal la hibrid. Deoarece este cunoscută măsura exactă în care fiecare formă de rezonanță a ionului nitrat contribuie la hibrid, ordinea legăturii fiecărei legături azot-oxigen, precum și sarcina formală pe fiecare atom de oxigen din hibrid pot fi ușor determinate:
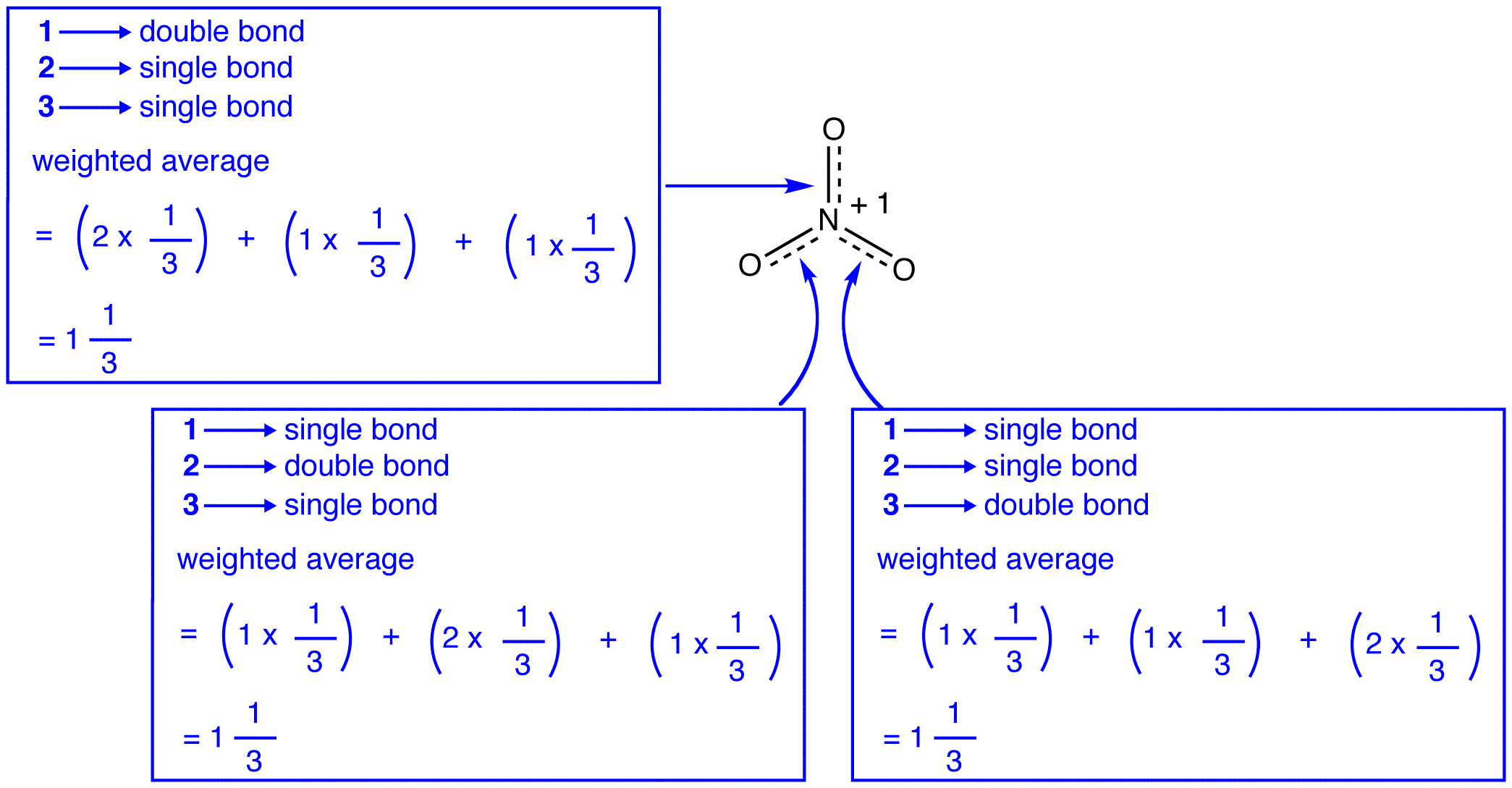
conform teoriei rezonanței, fiecare legătură din ionul nitrat este una și o treime dintr-o legătură, ceea ce este în concordanță cu observația că cele trei legături din ionul nitrat au aceeași lungime a legăturii și aceeași energie a legăturii.
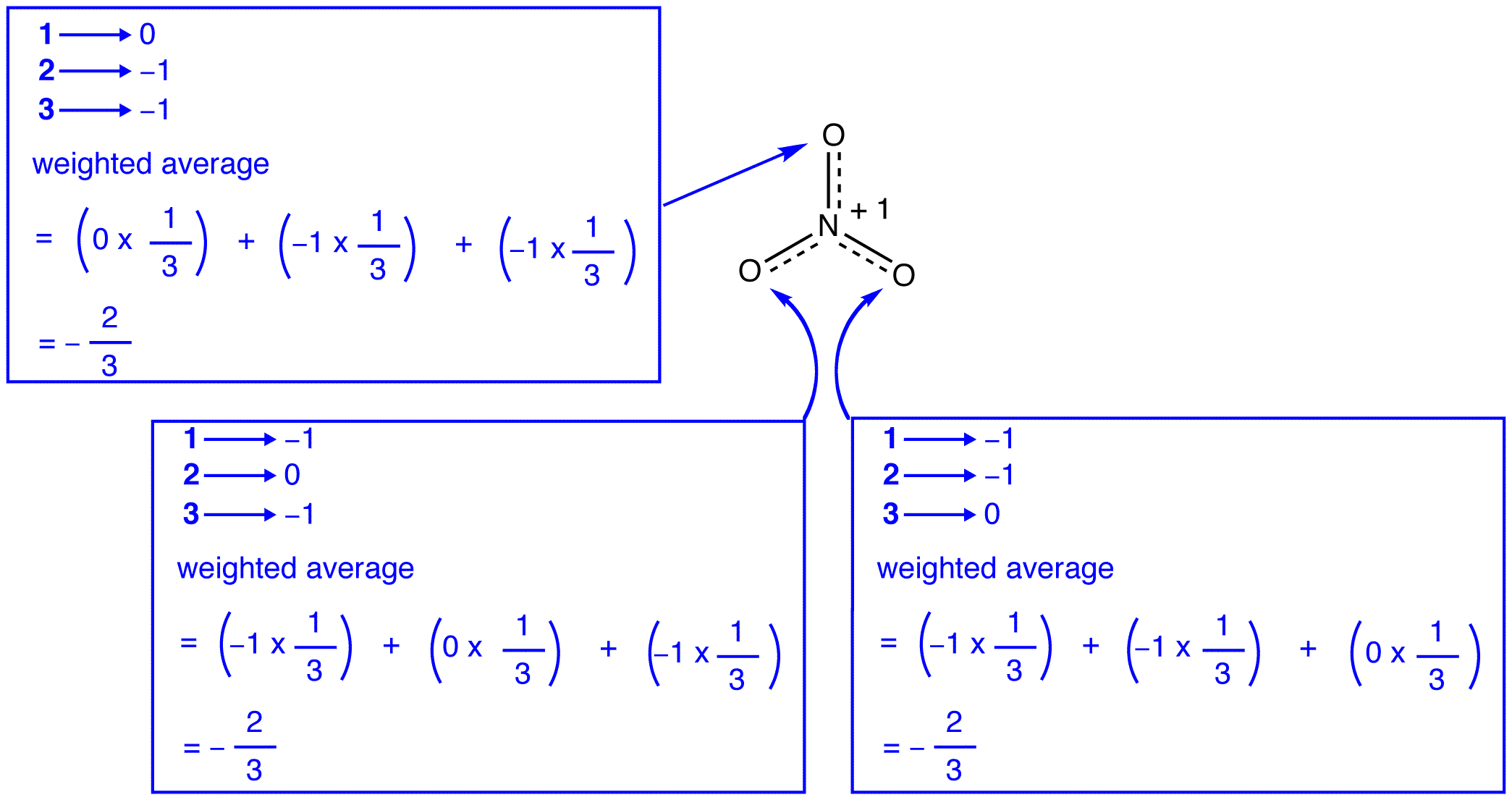
conform teoriei rezonanței, fiecare atom de oxigen din ionul nitrat are o sarcină formală de -2 / 3, care, coroborat cu faptul că cele trei legături azot-oxigen sunt identice, este în concordanță cu observația că cei trei atomi de oxigen din ionul nitrat sunt indistinguibili.
în fiecare formă de rezonanță a ionului nitrat, există doi electroni pi și sunt împărțiți doar de doi atomi. Se spune că un electron împărțit doar de doi atomi este localizat. Astfel, cei doi electroni pi din fiecare formă de rezonanță a ionului nitrat sunt localizați. Ionul nitrat, așa cum este reprezentat de hibrid, are doi electroni pi:
# electroni într-o legătură pi = 2
# electroni într-o treime dintr-o legătură pi = 2/3
# electroni în trei dintre ele = 3 x (2/3) = 2
cei doi electroni pi din ionul nitrat sunt împărțiți de un total de patru atomi, un atom de azot și trei atomi de oxigen. Se spune că un electron împărțit de mai mult de doi atomi este delocalizat. Astfel, cei doi electroni pi din ionul nitrat sunt delocalizați. Delocalizarea electronilor pi în ionul nitrat necesită ca cei patru atomi să fie pe același plan, permițând suprapunerea laterală a orbitalilor p pe ei.

dacă energia ionului nitrat ar fi media ponderată a energiilor celor trei forme de rezonanță ale sale, la fel cum structura ionului nitrat este media ponderată a structurilor celor trei forme de rezonanță ale sale, ar trebui să fie egală cu energia uneia dintre cele trei forme de rezonanță identice:

dacă energia hibridului ar fi egală cu cea a unei forme de rezonanță, având în vedere că toate entitățile chimice (particule elementare, atomi, molecule etc.) în mod natural tind să fie în cea mai mică stare de energie posibilă, nu ar exista niciun avantaj ca ionul nitrat să existe ca hibrid; ar putea exista pur și simplu ca formă de rezonanță. Deoarece ionul nitrat există ca hibrid, nu ca formă de rezonanță, se poate deduce că energia hibridului este mai mică decât cea a oricăreia dintre formele de rezonanță.

conform teoriei rezonanței, energia unei molecule este mai mică decât cea a formei de rezonanță cu cea mai mică energie. Deoarece ionul nitrat are o energie mai mică și, prin urmare, este mai stabil decât oricare dintre formele sale de rezonanță, se spune că ionul nitrat este stabilizat prin rezonanță.
există două concepții greșite despre teoria rezonanței în rândul studenților începători, probabil datorită interpretării literale a cuvântului rezonanță. Acestea sunt descrise mai jos, folosind ionul nitrat ca exemplu.
conceptie gresita 1: Ionul nitrat există ca formă de rezonanță 1 pentru un moment și apoi se schimbă fie în forma de rezonanță 2, fie în forma de rezonanță 3, care se interconvertesc sau revin la 1.

structura ionului nitrat nu este 1, Nici 2, Nici 3, ci hibridul și nu se modifică în timp decât dacă suferă o reacție.
concepția greșită 2: într-un eșantion de ioni de nitrați, la un moment dat, o treime din ioni există ca formă de rezonanță 1, o altă treime ca formă de rezonanță 2, iar restul de o treime ca formă de rezonanță 3.

într-o probă de ioni de nitrați, la un moment dat, toți ionii au aceeași structură, care este hibridul.
analogia clasică folosită pentru a clarifica aceste două concepții greșite este catârul (Morrison, R. T.; Boyd, R. N. Chimie Organică, ediția a cincea; Allyn și Bacon: Boston, 1987, pag. 373). Din punct de vedere biologic, un catâr este un hibrid între un cal și un măgar. Acest lucru nu înseamnă că un catâr seamănă cu un cal pentru o clipă și apoi se schimbă pentru a semăna cu un măgar. Aspectul unui catâr este o combinație între cea a unui cal și cea a unui măgar și nu se schimbă cu timpul. Nici nu înseamnă că, într-o turmă, unii catâri seamănă cu un cal, iar ceilalți cu un măgar. Într-o turmă, toți catârii au același aspect, care este o combinație între un cal și un măgar. Slăbiciunea acestei analogii este că caii și măgarii există, în timp ce formele de rezonanță sunt strict ipotetice. O analogie mai bună, citată în Morrison și Boyd, este rinocerul. Văzând un rinocer, s-ar putea descrie ca hibridul unui dragon și al unui unicorn, două creaturi care nu există.
reguli pentru desenarea formelor de rezonanță
1. Formele de rezonanță sunt diagrame Lewis, care se bazează pe teoria legăturii de valență.Prin urmare, ei trebuie să respecte regulile de bază ale teoriei legăturii de valență. Astfel, hidrogenul nu poate avea mai mult de doi electroni de valență; perioada-două elemente nu pot avea mai mult de opt electroni de valență; elementele din perioada trei și mai jos pot avea mai mult de opt electroni de valență. de exemplu: în fiecare formă de rezonanță a ionului nitrat, există două elemente, azot și oxigen, care sunt două elemente de perioadă. În niciuna dintre formele de rezonanță ale ionului nitrat nu există mai mult de opt electroni de valență pe niciunul dintre atomi.
2. Toate formele de rezonanță trebuie să aibă același cadru de legătură sigma, diferind doar în locațiile electronilor pi și ale electronilor de valență fără legătură. eg: toate cele trei forme de rezonanță ale ionului nitrat au același cadru sigma-bond:
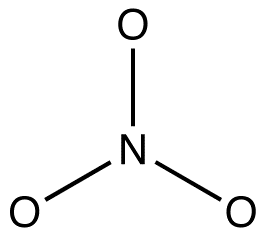
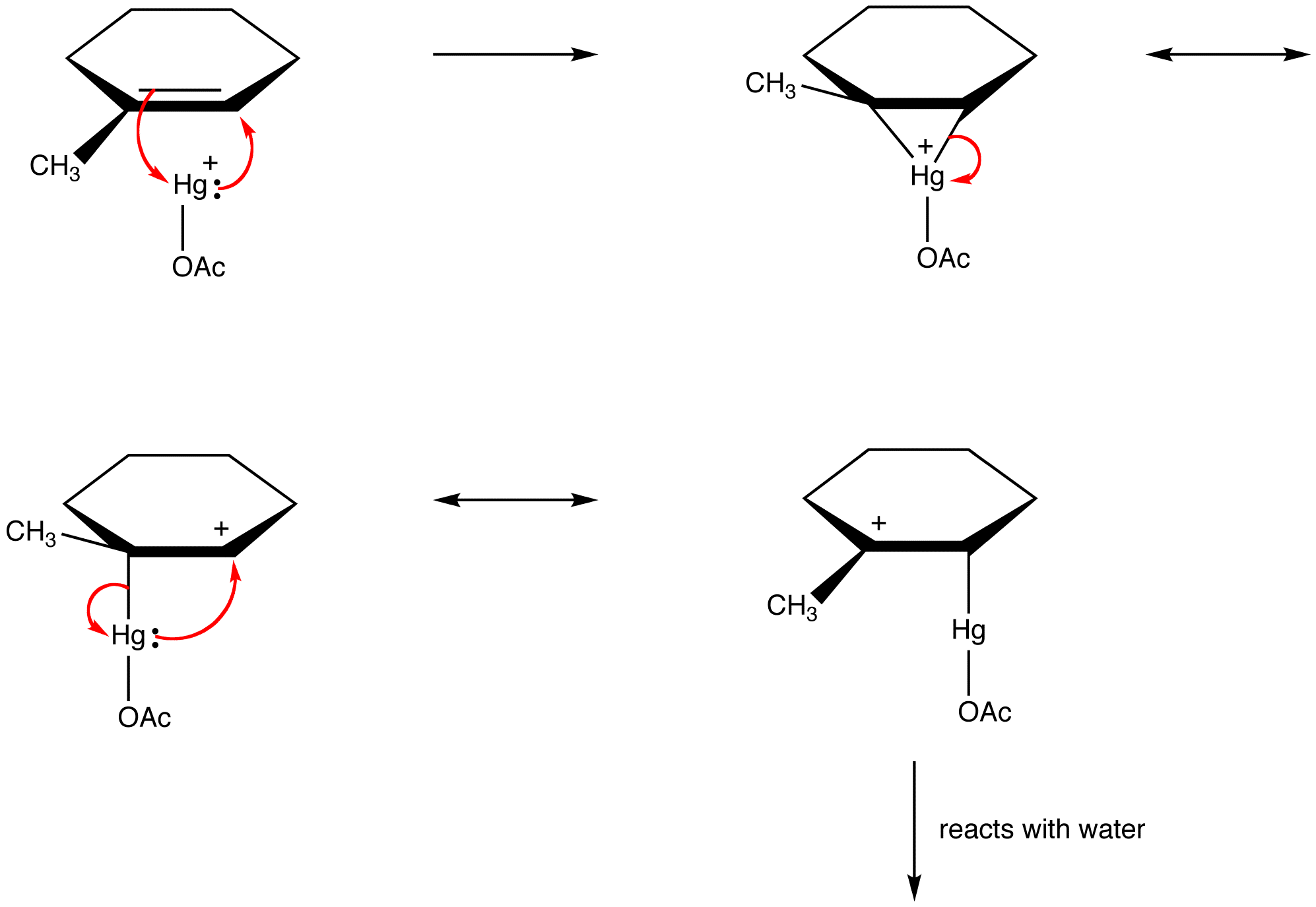
ele diferă una de alta numai în locațiile electronilor pi și perechilor singulare.chimiștii organici încalcă din ce în ce mai mult această regulă pentru a explica structurile intermediarilor reactivi ca specii stabilizate prin rezonanță. eg: oximercurație
determinarea contribuției Relative a formelor de rezonanță la hibrid
cele trei forme ale ionului nitrat sunt identice și, prin urmare, au aceeași stabilitate. În consecință, ele contribuie în mod egal la hibrid. Formele de rezonanță ale majorității moleculelor stabilizate prin rezonanță sunt diferite unele de altele, deci nu contribuie în mod egal la hibrid. Cu cât forma de rezonanță este mai stabilă, cu atât contribuie mai mult la hibrid. Astfel, determinarea contribuției relative sau a formelor de rezonanță la hibrid necesită determinarea stabilității lor relative. Utilizați următoarele reguli pentru a determina stabilitatea relativă a formelor de rezonanță. Regula 1: o formă de rezonanță în care toți atomii au un octet de electroni de valență este mai stabilă decât una în care cel puțin un atom nu are. eg:
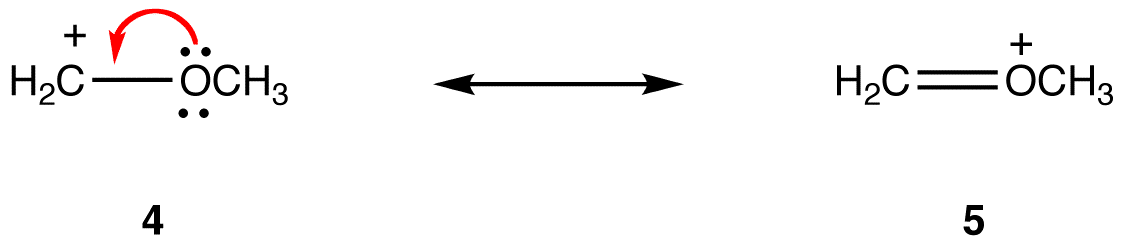
în forma de rezonanță 5, toți atomii au un octet de electroni de valență; în 4, un atom, atomul de carbon care poartă sarcina formală de +1, nu. Astfel, forma de rezonanță 5 este mai stabilă decât forma de rezonanță 4.
Regula 2:
toate celelalte fiind egale, o formă de rezonanță care are o sarcină negativă formală pe un atom mai electronegativ este mai stabilă decât una care are o sarcină negativă formală pe un atom mai puțin electronegativ. eg:
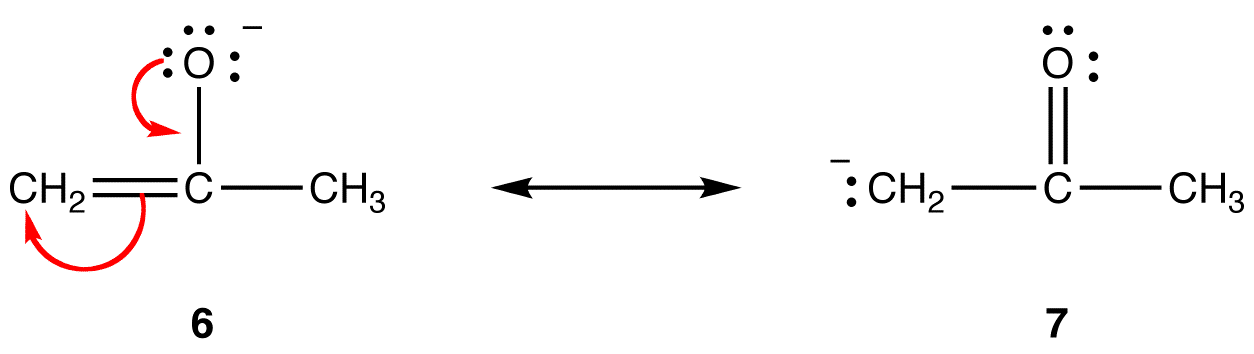
în forma de rezonanță 6, sarcina negativă formală este pe un atom de oxigen; în 7, este pe un atom de carbon. Oxigenul este mai electronegativ decât carbonul. Astfel, forma de rezonanță 6 este mai stabilă decât forma de rezonanță 7.
tendința este opusă în ceea ce privește taxele oficiale pozitive. Toate celelalte fiind egale, o formă de rezonanță care are o sarcină pozitivă formală pe un atom mai puțin electronegativ este mai stabilă decât una care are o sarcină pozitivă formală pe un atom mai electronegativ. eg:
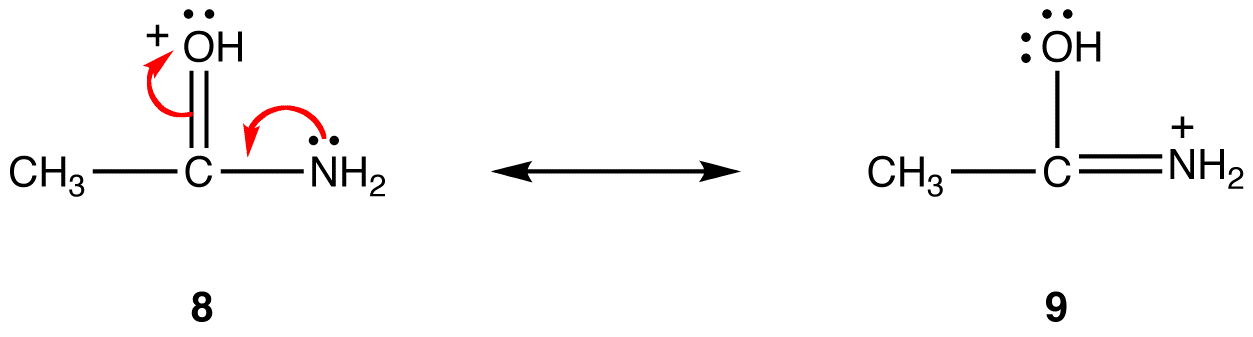
în forma de rezonanță 8, sarcina pozitivă formală este pe un atom de oxigen; în 9, este pe un atom de azot. Azotul este mai puțin electronegativ decât oxigenul, astfel, forma de rezonanță 9 este mai stabilă decât forma de rezonanță 8.
Regula 3:
toate celelalte fiind egale, o formă de rezonanță care nu are o separare a sarcinii, numită formă de rezonanță dipolară, este mai stabilă decât una care are. eg:
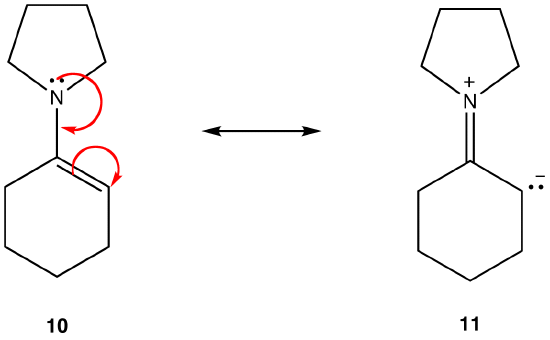
forma de rezonanță 11 este o formă de rezonanță dipolară; 10 nu este. Astfel, 10 este mai stabil decât 11. Această regulă este o consecință a formei vectoriale a legii lui Coloumb, conform căreia taxele opuse atrag. Corolarul este că, pentru a menține sarcinile opuse separate, este necesară energie, ceea ce înseamnă că 11 are o energie mai mare decât 10, deci 10 este mai stabil decât 11.
Regula 4:
în formele de rezonanță dipolară, toate celelalte fiind egale, cu cât este mai mare distanța dintre sarcinile separate, cu atât este mai stabilă forma de rezonanță. eg:
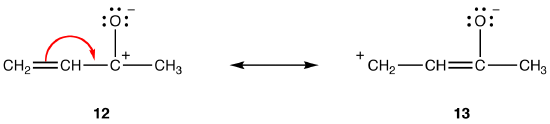
ambele forme de rezonanță 12 și 13 sunt forme de rezonanță dipolară. Distanța dintre sarcinile separate este mai mare în 13 (trei legături) decât în 12 (o legătură), deci 13 este mai stabil decât 12. Această regulă este o consecință a formei scalare a legii lui Coloumb, care afirmă că forța atractivă dintre sarcinile opuse este invers proporțională cu pătratul distanței dintre ele. Astfel, energia necesară pentru a menține sarcinile opuse separate în 12 este mai mare decât cea din 13, ceea ce înseamnă că 12 are o energie mai mare decât 13, deci 13 este mai stabil decât 12.
regulile de mai sus nu se pot aplica rezonanței care implică elemente din perioada trei și mai jos, datorită capacității lor de a găzdui mai mult de opt electroni în învelișul de valență. eg:
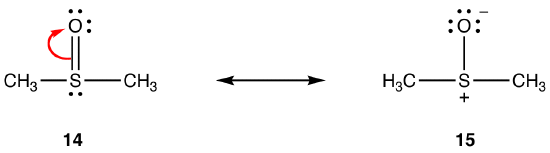
legătura dublă din 14 constă dintr-o legătură sigma și o legătură formată prin suprapunerea unui orbital 2P, purtând doi electroni, în atomul de oxigen și un orbital 3D gol în atomul de sulf. Acești doi orbitali au energii, dimensiuni și forme foarte diferite, astfel încât suprapunerea dintre ei, cunoscută sub numele de interacțiune pn–dn, este slabă. În consecință, există un caracter dublu de legătură în legătura sulf-oxigen din hibrid, adică 15 este forma de rezonanță majoră.
colaboratori și atribuții
- Gamini Gunawardena de pe site-ul OChemPal (Utah Valley University)